- •Иониты в водоподготовке и водоотведении
- •Введение
- •1. Иониты и ионный обмен
- •1.1. Общие свойства ионитов
- •1.2. Классификация ионитов
- •1.3. Органические синтетические иониты
- •1.4. Неорганические иониты
- •2. Основные физико-химические свойства ионитов
- •2.1. Обменная емкость
- •2.2. Ионизация ионитов
- •2.3. Сольватационные свойства ионитов
- •2.4. Способность ионитов к регенерации
- •3. Применение ионообменных материалов
- •3.1. Умягчение природной воды
- •3.2. Обессоливание природных вод
- •3.3. Обескислороживание воды редокситами
- •3.4. Нейтрализация кислотно-щелочных стоков
- •3.5. Получение оловянной кислоты и двуокиси олова из отходов производства
- •3.6. Утилизация аммиака
- •3.7. Очистка сточных вод гальванических производств
- •3.8. Очистка воды от поверхностно-активных веществ
- •1 ‑ Адсорбер с анионитом; 2, 3 ‑ баки раствора нс1;
- •4 ‑ Бак раствора щелочи; 5 ‑ электродиализная установка
- •3.9. Ионообменная очистка и возврат в производство
- •3.10. Применение ионитов для защиты воздушной среды
- •3.11. Антимикробная обработка воздуха
- •Библиографический список
- •Иониты в водоподготовке и водоотведении
1.3. Органические синтетические иониты
Наибольшее
практическое значение имеют синтетические
органические иониты. Они представляют
собой гели полиэлектролитов, состоящие
из пространственной сетки углеводородных
цепей с фиксированными на ней активными
группами. Пространственная сетка носит
название матрицы. При набухании активные
группы диссоциируют на подвижные
противоионы и неподвижные ионы, связанные
с матрицей, которые и являются
фиксированными ионами (рис. 1).

-
а) б)
Рис. 1. Схематическое изображение структуры ионообменников:
а) катионит, б) анионит
Сорбированные, то есть закрепленные на матрице ионы, не способны перейти во внешний раствор. Ионы, противоположные по знаку заряда фиксированным ионам (противоионы), легко переходят во внешний раствор в обмен на строго эквивалентное количество ионов того же знака, поступающих в ионит из внешнего раствора.
Эквивалентность обмена является главным признаком ионита и ионного обмена. Она основана на условии электронейтральности фазы ионита: суммарный заряд всех противоионов должен быть равен общему заряду фиксированных ионов. При этом количество эквивалентов противоионов должно быть равно количеству эквивалентов фиксированных ионов. Следует отметить, что это положение справедливо в разбавленных растворах электролитов.
При контакте ионитов с раствором электролита устанавливается обменное равновесие, так как при этом происходит диффузия ионов из растворов в ионит и эквивалентная диффузия подвижных противоионов из ионита в раствор.
Положение равновесия определяется, в общем, законом действия масс.
При введении ионита в органическую или неорганическую жидкость происходит сольватация противоионов и фиксированных ионов с одновременным увеличением объема, то есть набухание полимерной матрицы. Набухший ионит можно сравнить с губкой, подвергающейся чередованию сжатия и растяжения трехмерной структуры, через которую осуществляется движение обменивающихся ионов. Структурные неоднородности матрицы ионита, по которым движутся обменивающиеся ионы, образуют «каналы» и «микропоры».
1.4. Неорганические иониты
Неорганическими ионитами могут быть очень многие труднорастворимые неорганические соединения. Наиболее важными представителями этой группы являются цеолиты.
Цеолиты - алюмосиликаты общей формулы M2/nAl2O3xSiO2yH2O, где М - щелочной или щелочноземельный металл, n – степень его окисления. Цеолиты отличаются строго регулярной структурой пор, которые в обычных температурных условиях заполнены молекулами воды.
Если из цеолита удалить воду, поры могут быть заполнены снова водой или другими веществами. Поглощение вещества происходит в адсорбционных полостях, соединяющихся друг с другом входами-окнами. Проникнуть через окно могут только те молекулы, критический диаметр которых (диаметр по наименьшей оси молекулы) меньше диаметра входного окна.
Благодаря этому свойству цеолиты применяются в качестве молекулярных сит для разделения молекул разного размера.
К цеолитам относятся такие минералы, как анальцим Na[Si2AlO6]H2O, шабазит (Ca,Na)[Si2AlO6]26H2O, гейландит Ca[Si3AlO8]2, натролит Na3[Si3Al2O10]2H2O и др.
Отдельные атомы и определенные, прочно связанные между собой группы атомов соединяются в сетчатое соединение с трехмерной структурой. В пространственной решетке цеолитов имеются трещины или каналы приблизительно одного размера (диаметром 0,5-0,6 нм и меньше), по которым могут перемещаться обменивающиеся ионы. При этом решетку цеолита принято считать неподвижной.
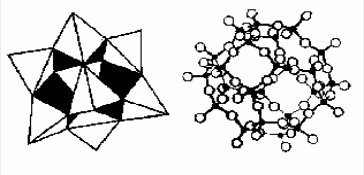
В цеолитах сравнительно большие расстояния между узлами решетки. Они построены из чередующихся тетраэдров SiO2 и Al2O3, соединенных друг с другом вершинами. В центре тетраэдров находятся ионы кремния или алюминия, а в вершинах - ионы кислорода (рис. 6.2).
Структура цеолитов
Природные цеолиты обладают пространственной трехмерной структурой. Однородная внутренняя система каналов одинаковой ширины, свойственная кристаллической структуре природных цеолитов, ни у одного синтетического ионита не осуществляется в таком совершенстве.
Для цеолитов общего назначения мольное соотношение SiO2:Al2O3 от 1 до 2, а для кислотостойких цеолитов (эрионита, морденита, клиноптилолита) – от 6 до10.
|
а) б)
Рис. 2. Схематическое изображение основной структурной единицы (кубооктаэдра) цеолитов типа А, Х (а) и Y (б): - кремний и алюминий; O – кислород |
Способность цеолитов к ионному обмену
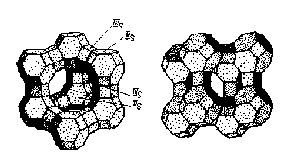
В силикатной решетке часть ионов Si4+ замещена ионами А13+. Недостающий положительный заряд (один элементарный заряд на каждый атом алюминия) возмещается щелочными или щелочноземельными ионами, которые не связаны с какими-либо определенными местами в решетке. Они играют роль противоионов и могут обмениваться на другие катионы (рис. 3).
Многие неорганические иониты способны в зависимости от условий (главным образом от рН раствора) к обмену катионов или анионов. Иногда обмен катионов и анионов протекает одновременно.
Среди неорганических различают сорбенты, в которых обменная емкость прямо связана со стехиометрией соединения, и сорбенты, в которых такая связь отсутствует.
К первой группе относят многие алюмосиликаты, предельная обменная емкость которых (ммоль-экв/г сорбента) равна содержанию алюминия (ммоль-экв/г сорбента).
Вторая группа более сложная, так как включает сорбенты, в которых предельная обменная емкость не достигается по самым разным причинам, например, из-за частичного проявления ситового эффекта, экспериментальной недостижимости условий полного обмена (концентрации и рН раствора).
|
а) б)
Рис. 3. Структура цеолита типа (А) (а) и типа Х и Y (б). ШS и ПS – возможные места локализации катионов |
Как правило, алюмосиликаты являются катионитами, но на некоторых из них наряду с обменом катионов может происходить обмен анионов (например, на монтмориллоните, каолините, полевых шпатах и др., на которых ОН- - ионы обмениваются на ионы СI-, SO42-, PO43-).
Глинистые ионообменники типа монтмориллонита (общий состав SiO2, Al2O3, Fe2O3, MgO, CaO, H2O) имеют слоистое строение и значительно набухают в водных растворах. Поглощенная вода и способные к обмену ионы находятся между слоями. Обмен происходит при диффузии ионов раствора в межслоевое пространство.
У неорганических ионитов с плотной упаковкой кристаллов в решетке, таких как глаукониты, суспензии глин, гидроксиды железа и алюминия, способность к ионному обмену связана с образованием двойного электрического слоя.
Набухание неорганических ионитов
Способность сорбировать растворитель у большинства неорганических ионитов мала. Сорбция растворителя не сопровождается значительным изменением объема – параметры полимерной решетки изменяются незначительно (за исключением слоистых структур).
Например, алюмосиликаты с жесткой кристаллической структурой почти не изменяют параметров решетки при обмене одних ионов на другие и почти не способны к набуханию. Волокнистые и слоистые алюмосиликаты характеризуются способностью к гидратации с изменением параметров решетки (слоистые алюмосиликаты) в процессе обмена. В случае бентонитов, имеющих слоистое строение, процесс набухания связан с увеличением расстояния между слоями. Между слоями у кальциевого бентонита (монтмориллонита) оно меняется в зависимости от количества поглощенной воды (в пределах 10-60 г на 100 г сухого вещества) от 1,13 до 2,07 нм. Предполагается, что обменивающиеся ионы располагаются между слоями и взаимодействуют с водой.
При изучении набухания монтмориллонита в растворах одно- и многовалентных катионов в зависимости от их концентрации обнаружено, что набухание протекает при высоких концентрациях ионов однозарядных сильных электролитов (H+, Li+, Na+), гидратационной энергии которых достаточно, чтобы преодолеть электростатические силы решетки и постепенно раздвинуть слои на 2,0 нм. Дальнейшее раздвижение решетки, величина которого обратно пропорциональна корню квадратному из концентрации раствора, происходит при более сильном разбавлении действующих растворов вследствие преодоления ван-дер-ваальсовых и лондоновских сил осмотическими силами.
Раствором хлорида натрия удается раздвинуть слои в пределах ~ 4,0 -14,0 нм. У ионов калия, аммония, цезия, очевидно, энергия гидратации недостаточна, чтобы вызвать такое сильное набухание. Эти катионы способствуют раздвижения слоев только до 1,5 нм. Подобная же величина раздвижения наблюдается у таких многозарядных ионов, как Mg2+, Ca2+, Ba2+ и Al3+, хотя энергия гидратации у них, наверное, достаточна. Объяснить это удовлетворительно пока не удалось.
Рентгеноструктурные данные показали, что противоионы в цеолитах могут занимать различные кристаллографические позиции. В зависимости от типа цеолита и вида противоиона в цеолите может содержаться от 1 до 5 молекул воды на один противоион.
Синтетические цеолиты получают кристаллизацией при 80-100 0С смеси силиката и алюмината натрия. К образовавшемуся кристаллиту добавляют 15-20 % пластичной глины и смесь формуют в виде гранул диаметром 2-4 мм. В результате катионного обмена, например в растворе СаС12, из Na-формы цеолита получают Са-форму.
Насыпная плотность гранулированного цеолита 0,62-0,78 г/см3; предел прочности при сжатии - 8-15 МПа; удельная теплоемкость 0,83-1,00 кДж/(кгК); динамическая влагоемкость - 90-160 мг/см3.
Применение цеолитов
Цеолиты выпускаются промышленностью. Они применяются при сушке, очистке и разделении веществ, кроме того, в качестве ионообменников для сорбции веществ из растворов электролитов, а также в хроматографии, катализе и для адсорбции газообразных веществ. Известно их применение для дезактивации радиоактивных отходов.