
- •Закономерности химических процессов. Электрохимические процессы
- •Введение
- •Тема 1. Определение тепловых эффектов химических реакций. Оценка возможности самопроизвольного протекания процессов
- •1.1. Вопросы для подготовки к лабораторной работе
- •1.2. Решения типовых заданий
- •1.3. Задания для самостоятельного решения
- •Тема 2. Скорость химических реакций.
- •2.1. Вопросы для подготовки к лабораторной работе
- •2.2. Решения типовых заданий
- •2.3. Задания для самостоятельного решения
- •Тема 3. Химическое равновесие
- •3.1. Вопросы для подготовки к лабораторной работе
- •3.2. Решения типовых заданий
- •3.3. Задания для самостоятельного решения
- •3.4. Вопросы и типовой вариант контрольной работы Вопросы
- •Типовой вариант контрольной работы
- •Тема 4. Окислительно-восстановительные реакции
- •4.1. Вопросы для подготовки к лабораторной работе
- •4.2. Решения типовых заданий
- •4.3. Задания для самостоятельного решения
- •Тема 5. Химическая активность металлов
- •5.1. Вопросы для подготовки к лабораторной работе
- •Стандартные электродные потенциалы в водных растворах при 298 к
- •5.2. Решения типовых заданий
- •5.3. Задачи для самостоятельного решения
- •Тема 6. Коррозия и защита металлов
- •6.1. Вопросы для подготовки к лабораторной работе
- •6.2. Решения типовых заданий
- •6.3. Задачи для самостоятельного решения
- •Тема 7. Электролиз водных растворов электролитов
- •7.1. Вопросы для подготовки к лабораторной работе
- •7.2. Решения типовых заданий
- •7.3. Задачи для самостоятельного решения
- •7.4. Вопросы и типовой вариант контрольной работы Вопросы
- •Библиографический список
- •Оглавление
- •Закономерности химических реакций. Электрохимические процессы
- •Закономерности химических процессов. Электрохимические процессы
2.2. Решения типовых заданий
Задание 1. Напишите кинетические уравнения для приведенных реакций:
1) N2(г) + 3Н2(г) → 2NН3(г);
2) С(тв.) + 2Н2(г) → СН4(г);
3) Fe2О3(тв.) + 3Н2(г) → 2 Fe (тв.) + 3Н2О(г) .
Решение. Реакция N2(г) + 3Н2(г) → 2NН3(г) является гомогенной. Для неё кинетическое уравнение, согласно закону действия масс, имеет вид
![]()
В
случае гетерогенных реакций в уравнение
закона действия масс входят концентрации
только тех веществ, которые находятся
в газообразной фазе или растворе, поэтому
кинетические уравнения для реакции
образования СН4
(уравнение
2) имеет вид:
![]() ,
,
а
для реакции восстановления Fe
(уравнение 3) -
![]()
Задание 2. Рассчитайте, во сколько раз изменится скорость реакции образования оксида серы (VI), протекающей по уравнению
2SO2 + O2 → 2SO3,
а) при увеличении концентрации оксида серы (IV) в 2 раза;
б) при увеличении внешнего давления в 3 раза.
Решение. Согласно закону действующих масс запишем кинетическое уравнение реакции:
![]() ,
,
а) определим скорость реакции при концентрации в два раза больше исходной:
![]() .
.
Затем находим отношение скоростей процесса:
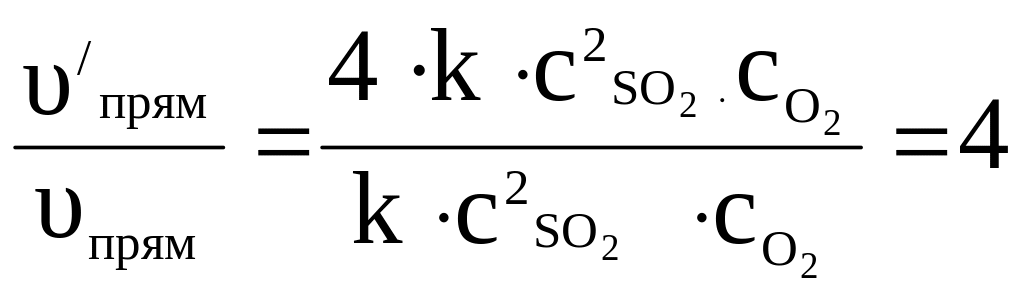
Таким образом, при увеличении концентрации SO2 в 2 раза скорость реакции возросла в 4 раза;
б) при увеличении давления над системой в 3 раза концентрация каждого из реагирующих веществ на единицу объема увеличится в 3 раза, т.к. все вещества находятся в газообразном состоянии. Скорость реакции станет равной:
![]() .
.
Следовательно,

Таким образом, при увеличении давления в 3 раза скорость реакции увеличится в 27 раз.
Задание 3. Во сколько раз возрастет скорость реакции, если температура увеличится на 40 оС? Температурный коэффициент реакции равен 2.
Решение. Согласно уравнению Я.Х. Вант-Гоффа (2.3)
.
Рассчитаем, во сколько раз увеличится скорость химической реакции, подставив в уравнение данные из условия задачи:

Таким образом, при повышении температуры на 40 оС скорость данной реакции увеличится в шестнадцать раз.
Задание 4. Какие процессы экономически более выгодны – идущие в системах с высоким или низким значением энергии активации?
Решение. В химическое взаимодействие вступают только активные молекулы, те, которые обладают энергией активации. Чем ниже энергия активации, тем большее число молекул ею обладают и тем больше результативных соударений, приводящих к образованию новых веществ, то есть тем больше скорость реакции.
Чем выше энергия активации процесса, тем меньше скорость реакции. Для того чтобы увеличить скорость реакции, необходимо либо повысить температуру, либо использовать катализатор, а это требует материальных затрат.
Поэтому экономически более выгодными являются процессы, идущие в системах с низким значением энергии активации.
2.3. Задания для самостоятельного решения
1. Рассчитайте, во сколько раз изменится скорость реакции 3Н2 + N2 → 2NH3 при увеличении концентрации водорода в 2 раза. Каков физический смысл константы скорости, от каких факторов она зависит?
2. Во сколько раз увеличится скорость реакции при повышении температуры с 20 до 60 оС, если температурный коэффициент реакции равен трем.
3. Рассчитайте, во сколько раз изменится скорость реакции образования хлорида железа (III) 2Fe(тв.) + 3Cl2(г) → 2FeCl3(тв.), если давление в системе увеличить в 5 раз?
