
- •Введение
- •Тема 1. Равновесия в водных растворах электролитов
- •1.1. Вопросы для подготовки к лабораторному занятию
- •1.2. Выполнение типовых заданий
- •Сильные и слабые электролиты
- •Константы диссоциации кислот и оснований в водных растворах
- •Правила составления уравнений ионно-молекулярных реакций
- •1.3. Вопросы и типовые задания к контрольной работе Вопросы
- •Типовой вариант контрольной работы
- •Тема 2. Приготовление растворов заданной концентрации
- •2.1. Вопросы для подготовки к лабораторной работе
- •2.2. Выполнение типовых заданий
- •2.3. Вопросы и типовые задачи к контрольной работе Вопросы
- •Типовые задачи
- •Тема 3. Жёсткость природных вод
- •3.1. Вопросы для подготовки к лабораторной работе
- •3.2. Выполнение типовых заданий
- •1 Л воды содержит 3,8 ммоль/л ∙ 55,5 мг/ммоль CaCl2,
- •5000 Л воды содержат х мг соли.
- •Тема 4. Методы очистки природных вод
- •4.1. Вопросы для подготовки к лабораторной работе
- •4.2. Выполнение типовых заданий
- •4.3. Вопросы и типовые задания к коллоквиуму Вопросы
- •Типовые задания
- •Тема 5. Гетерогенные дисперсные системы
- •5.1. Вопросы для подготовки к лабораторной работе
- •5.2. Выполнение типовых заданий
- •5.3 Вопросы и типовые задания к контрольной работе Вопросы
- •Типовые задания
- •Тема 6. Химия минеральных вяжущих веществ
- •6.1. Вопросы для подготовки к занятиям
- •6.2. Выполнение типовых заданий
- •6.3. Вопросы и типовые задания к контрольной работе Вопросы
- •Типовые задания
- •Библиографический список
- •Оглавление
- •Растворы. Дисперсные системы
- •394006 Воронеж, ул. 20-летия Октября, 84
Тема 5. Гетерогенные дисперсные системы
5.1. Вопросы для подготовки к лабораторной работе
1. Классификация дисперсных систем.
2. Причины термодинамической неустойчивости гетерогенных дисперсных систем и факторы устойчивости.
Литература: [1 ─ Работа 18]; [2 ─ § 8.7]; [3 ─ § 7.8].
5.2. Выполнение типовых заданий
Задание 1. Образование сульфида марганца происходит в результате взаимодействия водных растворов хлорида марганца и сульфида натрия:
а) напишите в молекулярной и полной ионно-молекулярной форме уравнение реакции;
б) составьте схему мицеллы сульфида марганца в случае избытка хлорида марганца и в случае избытка сульфида натрия. Укажите структурные части мицелл: ядро, потенциалопределяющие ионы, противоионы адсорбционного и диффузного слоя, границу возникновения электрокинетического потенциала;
в) выберите наиболее эффективный коагулянт для золя с положительным и с отрицательным зарядом коллоидной частицы среди следующих электролитов: NaCl, Na2SO4, CаCl2, AlCl3, Na3PO4.
Ответ.
а) MnCl2 + Na2S → MnS + 2NaCl;
Mn2+ + 2Cl‾ + 2Na+ + S2‾ → MnS + 2Na+ + 2Cl‾.
б) Рассмотрим строение мицеллы в случае избытка хлорида марганца.
Mn2+ + 2Cl‾ + 2Na+ + S2‾ → MnS + 2Na+ + 2Cl‾.
избыток избыток малорастворимое соединение
Ядро коллоидной частицы состоит из агрегата молекул малорастворимых в воде частиц – m(MnS). Родственные ядру и находящиеся в избытке ионы Mn2+ образуют слой потенциалопределяющих ионов – nMn2+. Ионы, противоположные по знаку потенциалопределяющим ионам (противоионы), – Cl‾ (тоже содержатся в избытке), вследствие электростатического взаимодействия притягиваются к потенциалопределяющим Mn2+.
Часть противоионов с молекулами воды 2(n–х)Cl‾∙ уН2О входят в адсорбционный слой, а оставшаяся часть – 2хCl‾∙ zН2О образует диффузный слой. Всё вместе составляет мицеллу, которая электронейтральна. На границе адсорбционного и диффузного слоя возникает электрокинетический ζ (дзета)– потенциал, Это важнейший фактор стабильности коллоидных систем.
Коллоидная частица состоит из ядра, потенциалопределяющих ионов и противоионов адсорбционного слоя. Ясно, что коллоидная частица имеет электрический заряд, величина которого равна разности зарядов потенциалопределяющих ионов и противоионов. Отсюда следует, что заряд коллоидной частицы положительный.
ζ– потенциал
{[( m (MnS)) ∙ nMn2+ ∙ 2 (n─x) Cl‾ ∙ уH2O]2х+ + 2x Cl‾ ∙ zH2O }
ядро потенциал- адсорбционный диффузный
определяющие слой слой
ионы противоионов противоионов
[ …… коллоидная частица ………………….]
{ _______________________ мицелла ____________________ }.
Графическое изображение строения мицеллы гидрозоля MnS представлено на рис. 1.
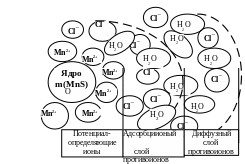
Рис. 1. Схема строения гидрозоля сульфида марганца,
полученная в избытке MnCl2
Строение мицеллы в случае избытка сульфида натрия будет отличаться по составу структурных составляющих, кроме ядра.
Mn2+ + 2Cl‾ + 2Na+ + S 2‾ → MnS + 2Na+ + 2Cl‾.
избыток избыток нерастворимое соединение
Слой потенциалопределяющих ионов будет состоять из родственных ядру ионов S2‾, противоионами будут находящиеся в избытке ионы Na+, и коллоидная частица будет иметь отрицательный заряд.
ζ– потенциал
{[( m (MnS) ∙ n S 2‾ ∙ 2 (n─x) Na+ ∙ уH2O]2х‾ + 2x Na+ ∙ zH2O }
ядро потенциал- адсорбционный диффузный
определяющие слой слой
ионы противоионов противоионов
[ ………… коллоидная частица ……………..]
{ ______________________ мицелла ______________________ }.
в) Если противоионы будут преимущественно скапливаться в адсорбционном слое, то заряд коллоидной частицы и ζ – потенциал будут уменьшаться, что приведёт к потере стабильности золя и его коагуляции (увеличению размера частиц вследствие их слипания). Такое явление происходит при введении в золь электролита-коагулянта, в котором ионом-коагулятором будет ион со знаком заряда, противоположным заряду коллоидной частицы, т.е. одинаковым с зарядом противоионов. Чем больше заряд иона-коагулятора, тем выше его коагулирующая сила и меньше порог коагуляции. Под порогом коагуляции понимают наименьшую концентрацию электролита, вызывающую коагуляцию. Предложенные электролиты диссоциируют следующим образом:
NaCl → Na+ + Cl‾; Na2SO4 → 2Na+ + SO42‾; CаCl2 → Ca2+ + 2Cl‾;
AlCl3→ Al3+ + 3Cl‾; Na3PO4→ 3Na+ + PO43‾.
Наибольший отрицательный заряд имеет ион PO43‾, поэтому Na3PO4 будет наиболее эффективным коагулянтом для положительно заряженного золя сульфида марганца, т.к. для разрушения коллоидной системы его потребуется меньше. Для отрицательно заряженного золя наименьший порог коагуляции имеет AlCl3.
Задание 2. В результате гидролиза соли Fe2 (SO4)3, протекающего в соответствующих условиях (повышенная температура и разбавление раствора) с практически полным смещением равновесия в сторону продуктов реакции, образуется положительно заряженный золь гидроксида железа:
а) напишите молекулярное и полное ионно-молекулярное уравнение гидролиза сульфата железа (II);
б) составьте схему мицеллы гидрозоля железа, укажите её составные части: ядро, потенциалопределяющие ионы, противоионы адсорбционного и диффузного слоя. Укажите коллоидную частицу, её заряд и границу возникновения электрокинетического потенциала.
t0
Ответ. а) Fe2 (SO4)3 + 6 Н2О → 2 Fe(OH)3 + 3 H2SO4;
разбавление раствора
2 Fe 3+ + 3 SO42‾ + 6 Н2О → 2 Fe(OH)3 + 6 H+ + 3 SO42‾.
избыток избыток малорастворимое соединение
б)
ζ– потенциал
{[( m Fe(OH)3) ∙ 2n Fe 3+ ∙ 3 (n─x) SO42‾ ∙ уH2O]2х+ + 3x SO42‾ ∙ zH2O }
ядро потенциал- адсорбционный диффузный
определяющие слой слой
ионы противоионов противоионов
[ …………….. коллоидная частица ……………..]
{ _______________________ мицелла _________________________ }.
Задание 3. Изобразите графически, как поверхностно-активное вещество стабилизирует эмульсию типа «вода в масле».
Ответ. Эмульсии состоят из несмешивающихся жидкостей, причём полярные жидкости условно называют «вода», а неполярные – «масло». Равновесному, устойчивому состоянию системы отвечает её разделение на две фазы: «вода» и «масло». Чтобы предотвратить такое разделение, вводят стабилизаторы, например поверхностно-активные вещества (ПАВ), которые имеют неполярную (гидрофобную) часть и полярную (гидрофильную) часть.
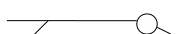
неполярная часть полярная часть
ПАВ располагаются на границе раздела фаз «вода» –«масло» таким образом, чтобы полярная часть молекулы была обращена к полярной фазе (воде), а неполярная – к неполярной фазе (маслу) (рис.2). На границе раздела фаз создаётся защитный молекулярно-адсорбционный слой, который предотвращает укрупнение частиц дисперсной фазы.
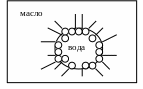
Рис. 2. Схема стабилизации эмульсии типа «вода в масле»
молекулами поверхностно-активного вещества
