
- •ВВЕДЕНИЕ
- •1. СОСТАВ И ТЕПЛОТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ ТОПЛИВА
- •1.1. Краткие теоретические сведения
- •1.2. Практические задания
- •1.3. Задание № 1 на курсовой проект
- •2. МАТЕРИАЛЬНЫЙ БАЛАНС ПРОЦЕССА ГОРЕНИЯ
- •2.1. Краткие теоретические сведения
- •2.2. Практические задания
- •2.3. Задание № 2 на курсовой проект
- •3. ТЕПЛОВОЙ БАЛАНС ПРОЦЕССА ГОРЕНИЯ
- •3.1. Краткие теоретические сведения
- •3.2. Практические задания
- •3.3. Задание № 3 на курсовой проект
- •4.1. Краткие теоретические сведения
- •4.2. Практические задания
- •4.3. Задание № 4 на курсовой проект
- •5. ОСОБЕННОСТИ ГОРЕНИЯ ГАЗООБРАЗНОГО, ЖИДКОГО И ТВЁРДОГО ТОПЛИВА
- •5.1. Краткие теоретические сведения
- •5.2. Практические задания
- •5.3. Задание № 5 на курсовой проект
- •6. ТОПЛИВОСЖИГАЮЩИЕ УСТРОЙСТВА
- •ОТВЕТЫ НА ПРАКТИЧЕСКИЕ ЗАДАНИЯ
- •ЗАКЛЮЧЕНИЕ
- •ПРИЛОЖЕНИЕ 1
- •ПРИЛОЖЕНИЕ 2
- •ПРИЛОЖЕНИЕ 3
- •ПРИЛОЖЕНИЕ 5
- •ПРИЛОЖЕНИЕ 6
- •ПРИЛОЖЕНИЕ 7
- •ПРИЛОЖЕНИЕ 8
- •ПРИЛОЖЕНИЕ 9
- •ПРИЛОЖЕНИЕ 10
- •ПРИЛОЖЕНИЕ 11
- •ПРИЛОЖЕНИЕ 12
3. ТЕПЛОВОЙ БАЛАНС ПРОЦЕССА ГОРЕНИЯ
3.1. Краткие теоретические сведения
Целью составления теплового баланса процесса горения является определение температуры горения топлива, т.е. температуры, которую имеют продукты сгорания на выходе из зоны горения.
Величина температуры горения зависит от теплоты сгорания топлива, физического тепла компонентов горения, т.е. воздуха и топлива, коэффициента избытка воздуха, потерь теплоты от диссоциации продуктов сгорания и других потерь теплоты, например, потерь через ограждающие конструкции, от химической неполноты сгорания и т.д.
В зависимости от этих факторов различают калориметрическую (адиабатную) tк , теоретическую tт и действительную tд температуру горения топ-
лива.
Уравнение теплового баланса, применяемое для определения действительной температуры горения tд , учитывает все перечисленные выше парамет-
ры и выглядит следующим образом:
|
h =V C |
г |
t |
д |
=Qр |
+Q |
+Q |
|
−Q |
−Q |
, кДж/кг (кДж/м3), |
(3.1) |
|||||||||
|
г |
г |
|
|
|
|
|
н |
|
ф.в. |
|
ф.т. |
|
дис |
пот |
|
|||||
где h – действительная энтальпия продуктов сгорания, кДж/кг (кДж/м3); |
|||||||||||||||||||||
г |
– теплоёмкость продуктов сгорания, кДж/(м3·K); |
|
|||||||||||||||||||
Cг |
|
||||||||||||||||||||
Qф.в. – физическое |
тепло |
воздуха, |
подаваемого на горение, |
кДж/кг |
|||||||||||||||||
(кДж/м3); |
|
– физическое тепло топлива, кДж/кг (кДж/м3); |
|
||||||||||||||||||
Q |
|
|
|||||||||||||||||||
ф.т. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Qдис |
– теплота, |
затрачиваемая |
на |
диссоциацию продуктов сгорания, |
|||||||||||||||||
кДж/кг (кДж/м3); |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Q |
|
– другие потери теплоты, кДж/кг (кДж/м3). |
|
||||||||||||||||||
пот |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для вычисления теоретической температуры tт из уравнения (3.1) ис- |
|||||||||||||||||||||
ключают потери теплоты Qпот : |
|
|
|
|
|
|
|
|
|||||||||||||
|
|
h =V C |
г |
t |
т |
=Qр +Q |
+Q |
−Q , кДж/кг (кДж/м3), |
(3.2) |
||||||||||||
|
|
г |
г |
|
|
|
|
|
|
н |
ф.в. |
|
|
ф.т. |
|
дис |
|
|
|||
Для вычисления калориметрической температуры tк из уравнения (3.1) |
|||||||||||||||||||||
исключают Qпот и Qдис : |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
h =V C |
г |
t |
к |
=Qр |
+Q |
|
+Q |
, кДж/кг (кДж/м3), |
(3.3) |
|||||||||
|
|
|
г |
|
г |
|
|
|
н |
|
ф.в. |
|
|
ф.т. |
|
|
|
||||
20
Калориметрическую и теоретическую температуры горения можно определить двумя методами:
1) методом последовательных приближений из формул (3.2) и (3.3).
При данном методе теплоёмкости газов, составляющих продукты сгорания, в первом приближении принимаются при фиксированной (заданной) температуре горения топлива. Теплоёмкость продуктов сгорания стехиометрической смеси при этом вычисляется по формуле
|
|
|
|
|
|
|
|
|
о |
|
|
|
о |
|
|
|
С |
г |
= 0,01 |
C |
RO2 |
|
VRO2 |
+C |
|
VN2 |
+C |
H2O |
|
VH2O |
|
, кДж/(м3·K), |
(3.4) |
|
||||||||||||||||
|
|
|
|
V |
|
N2 |
V |
|
|
V |
|
|
|
|||
|
|
|
|
|
|
г |
|
|
г |
|
|
|
г |
|
|
|
где CRO2 , CN2 , CH2O – изобарные теплоёмкости трёхатомных газов (определяется для CO2 ), азота и водяного пара, кДж/(м3·K);
VRO2 , VNо2 , VHо2O – теоретические объёмы соответствующих компонен-
тов продуктов сгорания, м3/кг (м3/м3).
Средние изобарные теплоёмкости компонентов продуктов сгорания приведены в прил. 6. Для вычисления теплоёмкости для любой заданной температуры необходимо воспользоваться формулой линейной интерполяции, которая в общем виде выглядит следующим образом:
Y =Y +(Y −Y ) |
X − X1 |
. |
(3.5) |
|||
|
||||||
1 |
2 |
1 |
X2 |
− X1 |
|
|
|
|
|
|
|||
Параметры в данной формуле определяются по табличным данным в соответствии со следующей схемой:
X |
→Y |
|
|
|
1 |
1 |
|
|
X →Y |
. |
|
|
|
→Y2 |
|
X2 |
|
||
При вычислении теплоёмкости параметру Y здесь соответствует искомое значение C , параметру X – заданная температура t . Параметры X1 ,
X2 – табличные значения температуры t1 и t2 , между которыми находится значение t . Параметры Y1 и Y2 – соответствующие t1 и t2 значения теплоёмко-
сти C1 и C2 .
После вычисления теплоёмкости продуктов сгорания из балансовых соотношений (3.1), (3.2), (3.3) определяется соответствующая температура горения топлива.
21
Затем определяется относительная погрешность приближения по фор-
муле
δt = |
|
t1 −t2 |
|
100, %, |
(3.6) |
|
|
||||
|
|||||
|
t |
|
|||
|
|
|
|
|
|
|
|
1 |
|
|
|
где t1 – заданное значение температуры горения топлива, °C; t2 – вычисленное значение температуры горения, °C.
Если погрешность δt <5 %, то в качестве температуры горения топлива принимается вычисленная температура t2 . Если δt >5 %, то выполняется вто-
рое приближение в том же порядке, что и в первом приближении;
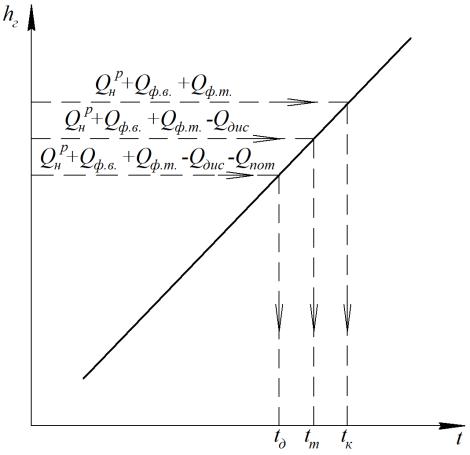
2) графическим методом, построив h −t -диаграмму продуктов сгорания. При данном методе на оси энтальпий h −t -диаграммы откладывается
значение теплоты, соответствующее искомой температуре (рис. 3.1).
Рис. 3.1. H −t -диаграмма продуктов сгорания топлива
Расчёт действительной температуры горения по формуле (3.1) затруднён из-за отсутствия точных данных по величине Qпот , которая зависит от условий
теплообмена продуктов сгорания с окружающей средой. Поэтому на практике действительную температуру определяют по формуле
22
tд =tк ηпир , °C, |
(3.7) |
где ηпир – пирометрический коэффициент, определяемый опытным путём. Он
зависит от конструкции топливопотребляющей установки и её режима работы и имеет значение от 0,65 до 0,8.
Величина энтальпии продуктов сгорания вычисляется по формуле
h |
|
= hо +(α −1) |
hо + h , кДж/кг (кДж/м3), |
(3.8) |
|
г |
г |
в |
зл |
|
|
где hо – энтальпия |
теоретического |
объёма продуктов сгорания, |
кДж/кг |
||
г |
|
|
|
|
|
(кДж/м3); |
|
|
|
|
|
hво – энтальпия теоретически необходимого для процесса горения воз-
духа, кДж/кг (кДж/м3);
hзл – энтальпия летучей золы, кДж/кг (кДж/м3).
Значения этих энтальпий вычисляются по следующим формулам:
hо = (V |
C |
RO2 |
+V о |
C |
H2O |
+V о |
C |
) t ; |
(3.9) |
||||
г |
RO2 |
|
|
H2O |
|
|
N2 |
|
N2 |
|
|||
|
|
|
hо =V о |
C t ; |
|
|
(3.10) |
||||||
|
|
|
в |
|
в |
|
в |
|
|
|
|
|
|
|
|
h = |
|
Ap a |
ун |
С |
|
t , |
|
|
(3.11) |
||
|
|
|
|
зл |
|
|
|||||||
|
|
|
|
|
|
|
|||||||
|
|
зл |
100 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
где t – температура продуктов сгорания, удаляемого воздуха и золы, °C; Vво – теоретический объём воздуха, м3/кг (м3/м3);
Cв – изобарная теплоёмкость воздуха, кДж/(м3·K);
Сзл – изобарная теплоёмкость золы, кДж/(кг·K).
Средние изобарные теплоёмкости воздуха и летучей золы приведены в прил. 6.
Энтальпия золы учитывается только при сжигании твёрдого топлива, и только в случае, если выполняется условие
Ap a |
|
|
|
ун |
>1,43 |
, (%·кг)/МДж. |
(3.12) |
|
|||
Qр |
|
|
|
н |
|
|
|
При подаче атмосферного воздуха на горение обычно осуществляется его предварительный подогрев, например, в воздухоподогревателе котельного агрегата. Это позволяет повысить экономичность сжигания любого топлива, независимо от его теплоты сгорания. Физическое тепло воздуха в этом случае вычисляется по формуле
23
Q |
=α V о С |
в |
t |
, кДж/кг (кДж/м3), |
(3.13) |
ф.в. |
в |
в |
|
|
где tв – температура воздуха, подаваемого на горение, °C.
Физическое тепло топлива в случае его предварительного нагрева вычис-
ляется по формуле |
|
|
|
|
|
|
Q |
=С |
тл |
t |
тл |
, кДж/кг (кДж/м3), |
(3.14) |
ф.т. |
|
|
|
|
где tтл – температура топлива, °C; |
|
|
|
|
|
||||||
Стл – теплоёмкость топлива, кДж/(кг·K) (кДж/(м3·K)). |
|
||||||||||
Теплоёмкость рабочей массы твёрдого топлива вычисляется по следую- |
|||||||||||
щей формуле: |
|
|
|
|
|
|
|
|
|
|
|
С |
р |
= |
W р |
+С |
|
с |
|
100 −W р |
, кДж/(кг·K), |
(3.15) |
|
тл |
100 |
тл |
100 |
||||||||
|
|
|
|
|
|
||||||
где Стлс . – теплоёмкость сухой массы твёрдого топлива, кДж/(кг·K). Значение теплоёмкости принимается по данным табл. 3.1.
|
Теплоёмкость сухой массы топлива |
Таблица 3.1 |
||||
|
|
|||||
Топливо |
Температура топлива, °C |
|
|
|||
0 |
100 |
200 |
300 |
400 |
||
|
||||||
Антрацит и тощие |
0,9209 |
0,9630 |
1,0467 |
1,1304 |
1,1723 |
|
угли |
|
|
|
|
|
|
Каменный уголь |
0,9630 |
1,0886 |
1,2560 |
1,4235 |
- |
|
Бурый уголь |
1,0886 |
1,2560 |
1,4654 |
- |
- |
|
Сланцы |
1,0467 |
1,1304 |
1,2979 |
- |
- |
|
Фрезерный торф |
1,2979 |
1,5073 |
1,8003 |
- |
- |
|
Теплоёмкость мазута вычисляется по общей формуле |
|
|||||
|
Стл = 0,415 +0,0006 tм , кДж/(кг·K), |
(3.16) |
||||
где tм – температура мазута, °C.
Теплоёмкость газообразного топлива, отнесённая к 1 м3 сухого газа, определяется по формуле
24
Стл = 0,01 (СН2 H2 +CCO CO +CCH4 CH4 +CCO2 |
CO2 +....)+ |
(3.17) |
|||
+0,00124 C |
|
d |
, кДж/ (м3 K), |
|
|
H2O |
|
|
|||
|
г |
|
|
|
|
где СН2 , CCO , CCH4 , CCO2 , CH2O – соответственно теплоёмкости водорода, окиси |
|||||
углерода, метана, углекислого газа и водяного пара, кДж/ (м3 K); |
|
||||
H2 , CO , CH4 , CO2 – процентное содержание водорода, окиси углерода,
метана, углекислого газа в 1 м3 сухого газового топлива, %.
При определении теплоёмкости газообразного топлива по формуле (3.17) необходимо учитывать все газы, составляющие топливо. Значения теплоёмкостей негорючих газов приведены в прил. 6, горючих газов – в прил. 7.
Количество теплоты, затраченное на диссоциацию продуктов сгорания, определяется по формуле
Q |
=12640 |
kCO2 |
V |
+10800 |
kH2O V |
, кДж/кг (кДж/м3), |
(3.18) |
|
дис |
|
д |
CO2 |
|
д |
H2O |
|
|
где kдCO2 , kдH2O – константы (степень) диссоциации соответственно двуокиси уг-
лерода и водяного пара, выраженные в долях (прил. 5).
Для вычисления степени диссоциации двуокиси углерода и водяного пара необходимо определить их парциальные давления в продуктах сгорания. При общем абсолютном давлении продуктов сгорания, равном атмосферному давлению, они определяются по формулам
pCO2 |
= rCO2 |
P, Па; |
(3.19) |
|
pH2O = rH2O P, Па. |
||||
|
||||
где P – нормальное атмосферное давление, Па.
rCO2 , rH2O – доля двуокиси углерода и водяного пара в продуктах сгорания. Доля газов определяется по формулам
|
V |
|
V о |
|
|||
r |
= |
RO2 |
; r |
= |
H2O |
. |
(3.20) |
|
|
||||||
CO2 |
|
Vг |
H2O |
|
Vг |
|
|
|
|
|
|
|
|||
Степень диссоциации соответствующего газа определяется с помощью табл. Д.1 и Д.2 по двум параметрам – парциальному давлению и калориметрической температуре горения топлива tк . Для вычисления степени диссоциации
необходимо воспользоваться формулой линейной интерполяции (3.5). При этом интерполяция осуществляется в три этапа:
25
