
Laboratornye_raboty_po_fome / 1 Зонная плавка (каскадная) / Методические указания - Каскадная плавка
.pdfМИНОБРНАУКИ РОССИИ Государственное образовательное учреждение высшего
профессионального образования «Санкт-Петербургский государственный электротехнический университет
«ЛЭТИ» им.В.И.Ульянова (Ленина)» (СПбГЭТУ)
__________________________________________________________________
Марголин В.И., Скобелев В.Н., Тупик В.А., Фантиков В.С.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ к выполнению лабораторной работы
«Каскадная плавка» по курсу «Физические основы микроэлектроники»
Санкт-Петербург
2012
Марголин В.И., Скобелев В.Н., Тупик В.А., Фантиков В.С. Каскадная плавка. Методические указания к выполнению лабораторной работы. СПб.: Издво СПбГЭТУ "ЛЭТИ", 2012
Содержит методические указания к выполнению лабораторной работы «Каскадная плавка» по курсу «Физические основы микроэлектроники».
Утверждено редакционно-издательским советом университета
вкачестве методических указаний
СПбГЭТУ "ЛЭТИ", 2012
Введение
Цель работы заключается в исследовании математической модели фазовых переходов и массопереноса на примере процесса зонной плавки , используемой дли очистки веществ от примесей.
Для решения этой задачи в распоряжение студента предоставляется ЭВМ. Для понимания процессов, происходящих при очистке вещества методом зонной плавки, и принципов, лежащих в основе построения модели процесса, студент должен хорошо представлять физические основы явлений, происходящих при зонной плавке: диффузию, растворения сегрегации примесей, массопереноса вещества через межфазную границу. В основе теории всех этих явлений лежит термодинамика и кинетика многокомпонентных систем.
Кроме того, в процессе подготовки к выполнении работы студент должен разобраться в том, каким образом осуществляется моделирование физического процесса на ЭВМ, а в процессе выполнения работы и диалога с ЭВМ - в особенностях проведения компьютерного эксперимента.
1 ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
1.1 Растворы
Растворами называют смесь двух или нескольких веществ, молекул (или атомы которых перемешаны случайным образом. Если одного из веществ в смеси значительно больше, чем других то его называют растворителем, а остальные растворенными веществами).
Существуют также твердые растворы, т.е кристаллы, содержащие различные атомы (ионы, молекулы). Твердые растворы металлов называются сплавами.
1.2 Термодинамический потенциал
Подобно тому, как потенциальная энергия в механике U(x,y,z) характеризует положение точки в пространстве координат x,y,z и является функцией положения (состояния) точки в пространстве. В термодинамике также вводятся функции состояния системы в соотвествующем “пространстве координат” – термодинамических параметров, например T и
V, V и P, P и S, и т.п. |
|
К ним относятся: |
|
а) Внутрення энергия- U(V,T) |
|
dU= -pdS + TdS, |
(1) |
б) Свободная энергия – F(V,T) |
|
F= U – TS, |
(2) |
Ее приращение равно dF= dU – TdS-SdT= - pdV – SdT. |
|
в) Энтальпия – H(S,P) |
|
H=U + pV, |
(3) |
Ее приращение равно pdV + Vdp = TdS + Vdp. |
|
г) Термодинамический потенциал Гиббса – Ф =H – TS. Его полный |
|
дифференциал равен: |
|
-TdS-SdT = Vdp – SdT, |
(4) |
Полезно в число параметров, от которых зависит термодинамический потенциал Гиббса, включить число N систем.
д) Химический потенциал |
|
M =(dФ/dN)p,T, |
(5) |
Понятие химического потенциала для систем с переменным числом частиц.
1.3 Условие равновесия фаз
Рассмотрим систему из двух фаз, находящихся в равновесии друг с другом. Фазой называем физически однородную часть системы, отличающуюся своими свойствами от других частей и отделенную от них четко выраженной границей. Примером двухфазной системы может служить жидкость и кристалл, пар и жидкость, две модификации одного кристалла и тп.
В двух фазной системе термодинамический потенциал зависит, кроме P и T, от числа частиц в каждой фазе N1 и N2:
Ф = Ф(p,T,N1,N2). Следовательно,
dФ = - SdT + Vdp + M1dN1 +M2dN2, (6) где M1 = (dФ/dN1)T,p,N2;
M2 = (dФ/dN2)T,p,N1
химические потенциалы первой и второй фаз соответственно.
Если в системе происходит процесс выравнивания, термодинамический потенциал уменьшается: dФ<0.
Но: N1 + N2 = N=const и следовательно при P,T=const, (M1-M2)dN1<0, Откуда следует, что dN1<0 при M1>M2 и, ноборот, dN1>0 при M1<M2 т.е поток вещества направлен от фазы с большим химическим потенциалом к
фазе с меньшим химическим потенциалом.
В состоянии термодинамического равновесия термодинамический потенциал системы Ф имеет минимум dФ = 0,откуда следует, что равновесие двух фаз достигается при равенстве химических потенциалов.
Итак, равновесие двух фаз требует равенства а)Температур T1 = T2,
б)Давлений P1 = P2 (тк, в равновесии силы, с которыми действуют друг на друга соприкасающиеся фазы, равны.
в)Равенства химических потенциалов: M1 = M2
Рассмотрим равновесие двух соприкасающихся фаз растворителя, в каждой из которых растворено некоторое количество одного и того же вещества (так называемые соединения).
Из условий равенства фаз,
M0’(p,T) – C1kT = M0’’(p,T) – C2kT, (7)
kTlnC1 + G1(p,T) = kTlnC2 + G2(p,T), (8)
где C1 и C2 – концентрации, Mo’,M0’’- химические потенциалы обеих фаз чистого растворителя, k – постоянная Больцмана, а G1 и G2 – некоторые величины, различные в обеих фазах. Из (7),(8) следует, что при задании p и T лишь одна из концентрации может быть задана независимо.
Из (7) находим,
C1/C2 = exp(G2 – G1)/kT. (9)
Правая сторона этого равенства есть функция только от p и T. Таким образом, растворенное вещество распределяется между двумя соприкасающимися фазами растворителя так, чтобы отношение концентрации было всегда одинаково, независимо от полного количества растворенного вещества и растворителя.
Отношение (9) носит название коэффициента разделения или коэффициента сегрегации – K0. При соприкосновении твердой (solidus) и жидкой (liquidus) фаз: K0=Cs/CL (10)
, где Cs-концентрация примеси в твердой, а CL – в жидкой фазе.
1.4 Диффузия
Процессы, с помощью которых происходит установление состояния равновесия называются кинетическими. Если концентрация какого-либо раствора различна в разных его местах, то благодаря тепловому движению частиц (молекул,атомов). Он с течением времении перемешивается: растворенное вещество переходит из мест с большей в места с меньшей концентрацией до тех пор, покак состав раствора не станет одинаковым по всему объему, этот процесс называется диффузией.
Пусть концентрация раствора (обозначим ее C) меняется только вдоль одного направления оси x. Плотностью диффузионного потока j называют количество растворенного вещества, переходящее в единицу времени через перпендикулярную оси x поверхность единичной площади. Поскольку вещество переходит из мест с большей в места с меньшей концентрацией. Знак потока противоположен знаку производной dC/dx-градиент концентрации. Если dC/dx = 0,т.е концентрация раствора везде одинакова, то диффузионный поток отсутствует.
Плотность диффузионного потока связана с градиентом концентрации уравнением:
j = - DdC/dx (11)
Здесь D- коэффициент диффузии.
Некоторые вещества обладают способностью образовывать друг с другом смешанные кристаллы, т.е. кристаллы, содержащие атомы как одного, так и другого вещества. Такие смешанные кристаллы называют твердыми растворами. Твердые растворы металлов называют сплавами.
Состав сплавов может меняться в более или менее широких интервалах.Этим они отличаются от кристаллов, представляющих собой «Химические соединения». Состав которых должен вполне определенным.В то время как кристаллическая структура твердого раствора определяется структурой растворителя. Для химического соединения характерна своя специфическая структура.

Характер теплового движения атомов в твердых телах обуславливает медленность процессов диффузии в них. В газах молекулы перемешиваются по всему занимаемому телом объему. В твердых же телах атомы почти все время находятся вблизи определенных положений равновесия узлов решетки, совершая малые колебания. Принять участие в диффузии могут атомы, покидающие свои места в решетке, переходя от одного узла к другому. Диффузия осуществляется постепенно. Причем длина элементарных «шагов» порядка одного атомного диаметра. В сумме элементарные прыжки обеспечивают перемещение атомов на большие расстояния.
В твердых растворах замещения преобладает диффузия за счет движения вакансий (свободных узлов кристаллической решетки). Диффузия осуществляется путем «перепрыгивания» на вакантные места атомов из соседних занятых узлов.
Вакансии имеются во всех кристаллах, как бы тщательно последние не выращивались. Под действием теплового движения в реальном кристалле постоянно возникают и исчезают вакансии.Число атомов, энергия тепловых колебаний которых при температуре T превышает энергию образования вакансий Ev, пропорционально exp (-E\kT). Следовательно, в кристалле, содержащем N атомных узлов, количество вакантных мест равно:






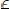



 (12)
(12)
Таким образом, количество вакансий быстро растет с температурой. Энергия образования вакансий в алюминии равна 0.75 эВ. При температуре плавления на каждую тысячу атомов алюминия приходится одна вакансия. А при комнатной температуре только одна вакансия на 

 атомов. Отношение 1:1000 типично для твердых металлов в непосредственной близости от точек плавления.
атомов. Отношение 1:1000 типично для твердых металлов в непосредственной близости от точек плавления.
Для того, чтобы атом переместился по решетке, необходимо, вопервых, для чтобы оказалось вакантным место одного из его блтжайших

соседей, во-вторых, для того, чтобы занять вакантное место, атом должен преодолеть потенциальный барьер высоты Em. Т.к диффундирующему атому необходимо «протиснуться» между соседними атомами. В результате зависимость коэффициента диффузии от температуры имеет вид:
D = D0

 , (13)
, (13)
где энергия активации Q =Ev + Em. Примерно половина величины Q соответствует энергии образования вакансии Ev. А другая половина-энергии перемещения Em.
Среднее расстояние Z , на которое распространяется диффундирующее вещество за время t задается формулой:
L ~



 (14)
(14)
Диффузия в жидкой среде чрезвычайно важна при проведении зонной плавки и при выполнении других операции. Которые применяются для изготовления полупроводников p-n-типа и кристаллических триодов p-n- типа. При одинаковой температуре диффузия в жидкости происходит гораздо быстрее, чем в твердых телах.
Вжидкостях существует некоторый геометрический порядок. В расположении ближайших соседей: данный атом имеет примерно такое же количество ближайших соседей, как в кристалле этого же вещества. При этом ближайшие соседи и в жидкости, и в кристалле находятся примерно на одинаковых расстояниях. Однако на далеких расстояниях расположение атомов в жидкости является сильно неупорядоченным по сравнению с твердыми телами.
Вто же время и в жидкостях, как и в газах, хаотическое тепловое движение молекул (атомов) содержит в себе «поступательную составляющую» .Молекулы перемещаются по занимаемому телом объему. В жидкостях,как и в газах, под действием поля сил тяжести может происходить выравнивание состава среды, сопровождающееся ее движением. Это явление

называется конвекцией в направлении конвекционных потоков выравнивание концентрации происходит гораздо быстрее,чем за счет истинной дифузии.
В тех направлениях, где конвекционный перенос отсутствует, выравнивание концентрации происходит только за счет диффузии, при этом этом уравнения (11) и (14) одинакова применимы как к твердым телам, так и к жидкостям. (Уравнение (14) впервые вывел Эйштейн для описания броуновского движения мельчайших частиц в жидкости).
Итересная особенность всех экспериментальных данных, полученных для простых жидкостей, состоит в том, что вблизи точки плавления. Значения коэффициентов диффузии всегда находятся в интервале от 1*

 до 10*
до 10*

 м/с.
м/с.
Эти значения в подавляющем большенстве случаев гораздо выше, чем коэффициенты диффузии в твердой фазе в непосредственной близости от точки плавления.
1.5 Пример условия равновесия фаз бинарной смеси
Рассмотрим в качестве примера вещество A, содержащие примесь B.Обозначим через Cs концентрацию примеси в твердой фазе, выпадающей осадок из жидкой фазы, где концентрация примеси равна CL согласно (10).
Изображенный на рис.1 расплавленный стержень длиной L, концентрация примеси B в котором равна c0 охлаждается с левого конца и затвердевает.
Предполагается, что в твердой фазе диффузия атомов примеси не происходит, а в жидкой диффузия происходит так быстро, что концентрация все время остается однородной. Это предположение представляется весьма правдопадобным, так как коэффициенты диффузии примеси в твердой и жидкой фазах отличаются в сотни тысяч раз.
Например, при температуре плавления алюминия (660 С) коэффициент диффузии цинка в алюминии: Ds =5*; Dz = 2.5*.
