
Химический состав бактериальной клетки: содержание, локализация в клеточных структурах и биологическая роль воды, белков, нуклеиновых кислот, липидов, углеводов и минеральных веществ. Источники азота, углерода. Факторы роста.
Значительную часть клетки составляет вода - от 70 до 85% от общей массы. Вода служит средой, в которой протекают разнообразные химические процессы микробной клетки. В ней растворяются кристаллоиды, диссоциируют электролиты, формируются коллоиды. Кроме того, сама вода как химический компонент, непосредственно участвует в реакциях гидролиза белков, углеводов и липоидов. Количество воды в клетке постоянно, и это постоянство регулируется цитоплазматической мембраной.
Сухой остаток микробной клетки составляет от 15% до 30%. Из них половина приходится на белки. Это простые белки - протеины и сложные белки - протеиды. Аминокислотный состав белков характерен для различных видов микроорганизмов. Белки входят в состав ферментов. Белками являются экзотоксины, с которыми связана патогенность целого ряда микробов; белками являются многие антигены, с ними связана специфичность микробов.
Нуклеиновые кислоты являются важнейшими компонентами микробов. В ДНК зашифрована вся наследственная информация клетки, а РНК участвует в процессах считывания информации, передачи се на рибосомы и синтеза в них белка - соответственно: матричная РНК (мРНК), рибосомальная РНК (рРНК) и транспортная РНК (тРНК).
Установлено, что состав нуклеотидов ДНК, а именно соотношения гуанин + цитозин/аденин + тимин является стабильным признаком. Поэтому его можно использовать для определения таксономического положения бактерий. Например, у стафилококков процентное содержание Г+Ц-28%-39%, а у сходных с ними микрококков Г+Ц=65%-83%, следовательно, они принадлежат к разным родам.
Липиды у бактерий, не содержащих жировые вещества в виде включений, составляют около 10% сухого остатка. У бактерий, имеющих особые жировые включения, например, у микобактерий туберкулеза, количество липидов достигает 40%, что обеспечивает этим бактериям устойчивость к кислотам, щелочам, спиртам. В состав липидов входят нейтральные жиры, фосфолипиды и свободные жирные кислоты. Фосфолипиды являются составной частью цитоплазматической мембраны, принимают участие в транспорте веществ. Липиды входят в состав липополисахарида клеточной стенки грамотрицательных бактерий - это их эндотоксин и О-антиген.
Углеводы выполняют в клетке пластическую роль и являются источником энергии, необходимым для обменных процессов. Количество углеводов в клетке непостоянно даже у одной и той же бактерии (от 10% до 30%) и зависит не только от рода и вида, но и от условий развития микробов. Бактерии содержат моносахариды, дисахариды, полисахариды. У некоторых бактерий полисахаридный антиген настолько специфичен, что позволяет разграничить отдельные типы внутри вида. Например, капсульный антиген пневмококков, поверхностный С-антиген стрептококков.
Минеральные вещества микроорганизмов разнообразны, количество и состав их зависит от вида микробов и состава питательной среды. Основные элементы, необходимые для жизнедеятельности клетки - натрий, калий, фосфор, кальций, магний, железо, медь, сера, хлор, кремний. Некоторые металлы - железо, кальций - входят в состав ферментов. Фосфор входит в состав аденозинтрифосфорной кислоты, которая является своеобразным аккумулятором энергии. Ионы металлов участвуют в поддержании постоянства осмотического давления, реакции среды (рН) в клетке. Реакция цитоплазмы слабощелочная. Заряд на поверхности бактерий - отрицательный, у спирохет - положительный. Благодаря одноименному заряду, бактерии в физрастворе образуют равномерно-мутную взвесь. Склеивание их между собой и образование хлопьев наблюдается при реакции агглютинации, а также при потере поверхностного заряда клетки, например, у шероховатых R-форм бактерий.
Что такое энергетический и конструктивный метаболизм? Особенности обмена веществ бактерий. Ферменты бактерий. Механизм расщепления веществ. Способы поступления их в клетку. Типы питания микробов. Могут ли микроорганизмы изменить тип питания? Каковы типы питания патогенных микробов?
Питание микробов (конструктивный метаболизм).
Как у всего живого, метаболизм микроорганизмов состоит из двух взаимосвязанных, одновременно протекающих, но противоположных процессов - анаболизма, или конструктивного метаболизма, и катаболизма, или энергетического метаболизма.
Обмен веществ у микроорганизмов имеет свои особенности.
1) Быстрота и интенсивность обменных процессов. За сутки микробная клетка может переработать такое количество питательных веществ, которое превышает ее собственный вес в 30-40 раз.
2) Выраженная приспособляемость к изменяющимся условиям внешней среды.
3) Питание осуществляется через всю поверхность клетки. Прокариоты не проглатывают питательные вещества, не переваривают их внутри клетки, а расщепляют их вне клетки с помощью экзоферментов до более простых соединений, которые транспортируются в клетку.
Для роста и жизнедеятельности микроорганизмов обязательно наличие в среде обитания питательных материалов для построения компонентов клетки и источники энергии. Для микробов необходимы вода, источники углерода, кислорода, азота, водорода, фосфора, калия, натрия и других элементов. Требуются также микроэлементы: железо, марганец, цинк, медь для синтеза ферментов. Различные виды микробов нуждаются в тех или иных факторах роста, таких, как витамины, аминокислоты, пуриновые и пиримидиновые основания.
В зависимости от способности усваивать органические или неорганические источники углерода и азота микроорганизмы делятся
на две группы - аутотрофов и гетеротрофов.
Аутотрофы (греч. autos - сам, trophic - питающийся) получают углерод из углекислоты (СО2) или ее солей. Из простых неорганических соединений они синтезируют белки, жиры, углеводы, ферменты.
Гетеротрофы (греч. heteros - другой, trophic - питающийся) используют сложные органические соединения, такие как углеводы, спирты, аминокислоты, органические кислоты. Среди гетеротрофных микроорганизмов различают сапрофитов (греч. sapros - гнилой, phyton - растение) и паразитов. Сапрофиты используют мертвые органические соединения. Они широко распространены в природе, разлагают органические вещества, отбросы, участвуя таким образом в санитарной очистке окружающей среды. Паразиты живут и размножаются в тканях человека, животных, растений.
Микробы могут изменять свой тип питания с паразитического на сапрофитный. Их можно культивировать вне организма, на питательных средах. Среди прокариотов исключение составляют риккетсии и хламидии, которые могут жить только в живых клетках хозяина. Их называют строгими, или облигатными паразитами (лат. obligatus - обязательный). Облигатными паразитами являются также все вирусы.
Транспорт питательных веществ
Через клеточную стенку и цитоплазматическую мембрану внутрь клетки прокариотов проникают только небольшие молекулы, поэтому белки, полисахариды и другие биополимеры вначале расщепляются экзоферементами до более простых соединений, которые транспортируются внутрь клетки.
Проникновение питательных веществ в клетку происходит с помощью различных механизмов.
Пассивная диффузия - вещества поступают в клетку за счет диффузии по градиенту концентрации, то есть вследствие того, что концентрация вне клетки выше, чем внутри.
Облегченная диффузия - также совершается по градиенту концентрации, но с участием ферментов-переносчиков, так называемых пермеаз. Этот фермент присоединяет к себе молекулы вещества на внешней стороне цитоплазматической мембраны и отдает его на внутренней стороне в неизмененном виде. Затем свободный переносчик перемещается снова к наружной стороне мембраны, где связывает новые молекулы вещества. При этом каждая пермеаза переносит какое-то определенное вещество.
Эти два механизма переноса не требуют энергетических затрат.
Активный перенос происходит также с участием пермеаз, причем осуществляется против градиента концентрации. Микробная клетка может накопить вещество в концентрации, в тысячи раз превышающих ее во внешней среде. Такой процесс требует затрат энергии, то есть расходуется АТФ.
Транслокация радикалов - это четвертый механизм передачи веществ. Это активный перенос химически измененных молекул, с участием пермеаз. Например, такое простое вещество, как глюкоза, переносится в фосфорилированном виде.
Выход веществ из бактериальной клетки происходит путем пассивной диффузии или путем облегченной диффузии с участием пермеаз.
Каким требованиям должны соответствовать питательные среды? Классификация питательных сред по консистенции, по целевому назначению. Основные питательные среды. Специальные питательные среды, их названия; для каких бактерий предназначены? Элективные питательные среды, состав, применение. Приведите примеры.
По происхождению среды подразделяют на естественные, искусственные и синтетические. К естественным питательным средам относятся натуральные продукты животного или растительного происхождения – молоко, яйца, овощи, животные ткани, желчь, сыворотка крови. Искусственные среды готовятся по определённым рецептам из различных настоев или отваров животного или растительного происхождения с добавлением неорганических солей, углеводов и азотистых веществ. Синтетические среды содержат определённые химические соединения в точно указанных концентрациях.
По составу среды делятся на простые и сложные. К простым средам относятся такие, как мясо-пептонный агар (МПА), мясо-пептонный бульон (МПБ). Сложные среды в своём составе содержат различные дополнительные компоненты, необходимые для роста микроорганизмов.
По консистенции среды подразделяют на жидкие, полужидкие, плотные, сыпучие. Жидкие среды чаще применяют для изучения физико-биохимических особенностей микроорганизмов, для накопления биомассы и продуктов обмена в микробиологической промышленности. Полужидкие среды обычно используют для длительного хранения культур. Они содержат в своём составе 0,5-0,7% агар-агара, который в настоящее время используют в качестве уплотнителей для питательных сред. Агар-агар представляет собой полисахарид, выделенный из морских водорослей. Он способен образовывать в воде гель, плавящийся при 1000С и уплотняющийся при 450С и ниже. Большинство микроорганизмов не используют его в качестве питательного субстрата. Плотные среды, содержащие 1,5-2% агар-агара, применяются для выделения чистых культур микроорганизмов, изучения морфологии колоний, количественного учёта, определения антагонистических свойств и других целей. Сыпучие среды используют для хранения посевного материала, культур-продуцентов в микробиологической и медицинской промышленности. К ним относят разваренное пшено, кварцевый песок, пропитанный питательным раствором.
Питательные среды по целевому назначению могут быть разделены на основные, специальные, элективные и дифференциально-диагностические. Основные питательные среды: мясо-пептонный бульон и мясо-пептонный агар. Специальные питательные среды применяются для выращивания тех микробов, которые не могут расти на основных средах. Например, кровяной агар и сахарный бульон для стрептококка, сывороточный агар для менингококка и гонококка. Элективные питательные среды применяются для выделения одного какого-либо вида микроорганизма из смеси различных бактерий. Данный вид бактерий растёт на этой среде быстрее и лучше других, опережая их в своем росте; а рост других бактерий задерживается. Например, свёрнутая сыворотка для палочки дифтерии, щелочная пептонная вода для холерного вибриона, желчный бульон для палочек брюшного тифа, солевые среды для стафилококка. Дифференциально-диагностические питательные среды применяются для отличия одних видов бактерий от других на основании их биохимических свойств. В этих средах в качестве основы применяют разнообразные органические и неорганические соединения: питательный бульон или 1% пептонную воду. К ним добавляют углеводы, спирты, мочевину и другие вещества; при расщеплении которых происходит сдвиг рН в кислую (углеводы, спирты, липиды) или щелочную (белки) сторону, что изменяет цвет индикатора, также входящего в состав среды.
Подробнее эти среды описаны в дополнительном материале к занятию 9 (тема: «Ферменты бактерий»).
Дифференциально-диагностические среды, их названия; для чего применяются? Что такое рост микробов, размножение микробов? Как размножаются бактерии? Фазы роста бактериальной культуры в жидкой питательной среде (начертить кривую). Размножение бактерий в непрерывно–проточной среде. Условия культивирования бактерий.
Дифференциально-диагностические среды делят на 4 основные группы:
Среды, содержащие белки, дающие характерные изменения под действием бактериальных ферментов и токсинов (кровь, желатин, молоко и др.); их применяют для определения гемолитических или протеолитических свойств: кровяной агар (КА), среда с желатином, молоко, желточно-солевой агар (ЖСА).
Среды, содержащие углеводы или многоатомные спирты и индикаторы: ферментативное расщепление субстрата приводит к сдвигу рН и изменению окраски индикатора. Например, среда Эндо, среда Левина, среда Плоскирева, среды Гисса, среда Олькеницкого.
Среды для дифференциации микробов по редуцирующей способности. В эту группу входят среды с красителями, обесцвечивающимися при восстановлении, а также среды с нитратами для определения денитрифицирующей активности бактерий.
Среды, включающие вещества, ассимилируемые только определённой группой бактерий. Наиболее распространёнными средами данной группы являются цитратный агар Симмонса и цитратная среда Козера.
Что такое культура бактерий, чистая культура, штамм?
Культура клеток - это клетки из органа животного или человека, которые живут и размножаются вне организма в питательном растворе (в среде 199 или в среде Хенкса)
Чистая культура - это культура микробов одного вида, полученная из одной колонии. В лабораториях для различных исследований применяют определенные известные штаммы микробов.
Штамм - это чистая культура микробов, полученная из определенного источника, в определенное время, обладающая известными свойствами.
Особенности биологического окисления у микробов. Группы микробов по типу биологического окисления. Каковы различия между аэробным и анаэробным типом (основные этапы, ферменты, участие свободного кислорода, конечный акцептор водорода, продукты окисления). Перечислите патогенные анаэробы.
У микроорганизмов существует два типа биологического окисления: аэробный и анаэробный. При аэробном типе участвует кислород, и этот процесс называется дыханием в строгом смысле слова. При анаэробном типе биологического окисления освобождение энергии из органических молекул происходит без участия кислорода и называется брожением.
Начальный этап анаэробного расщепления глюкозы с образованием пировиноградной кислоты (ПВК) происходит одинаково. Эта кислота является тем центральным пунктом, от которого расходятся пути дыхания и многих видов брожений.
При аэробном типе дыхания пировиноградная кислота вступает в цикл трикарбоновых кислот. Водород ПВК поступает в дыхательную цепь. Это цепь окислительных ферментов (цитохромы и цитохромоксидаза). По цепи цитохромов передается водород и присоединяется к активированному под действием цитохромоксидазы кислороду с образованием воды. Конечные продукты аэробного окисления глюкозы - диоксид углерода (углекислота) и вода. В процессе дыхания на одну молекулу глюкозы образуется 38 молекул АТФ.
При анаэробном типе биологического окисления энергия образуется в результате брожений. При спиртовом брожении ПВК превращается в конечном итоге в спирт и углекислоту. Конечным продуктом молочнокислого брожения является молочная кислота, маслянокислого брожения - масляная кислота. При процессах брожения на одну молекулу глюкозы образуется только 2 молекулы АТФ.
Микробную природу брожений впервые открыл и доказал Пастер. Изучая маслянокислое брожение, Пастер впервые столкнулся с возможностью жизни без кислорода, то есть с анаэробиозом. Он также установил явление, которое впоследствии было названо "эффектом Пастера": прекращение процесса брожения при широком доступе кислорода.
Анаэробиоз существует только среди прокариотов. Все микроорганизмы по типу дыхания делятся на следующие группы: облигатные аэробы, облигатные анаэробы, факультативные анаэробы, микроаэрофилы.
Облигатные аэробы размножаются только при наличии свободного кислорода. К ним можно отнести микобактерии туберкулеза, холерный вибрион, чудесную палочку. ,
Облигатные или строгие анаэробы получают энергию при отсутствии доступа кислорода. Они имеют неполный набор окислительно-восстановительных ферментов, у них нет цитохромной системы, поэтому у них не происходит полного окисления субстрата (глюкозы) до конечных продуктов - СО2 и Н2О. Более того, в присутствии свободного кислорода образуются токсические соединения: перекись водорода Н2О2 и свободный перекисный радикал кислорода О2. Аэробы при этом не погибают, так как продуцируют ферменты, разрушающие эти токсические соединения (супероксиддисмутазу и каталазу). Спорообразующие анаэробы в этих условиях прекращают размножение и превращаются в споры. Неспорообразующие анаэробы погибают даже при кратковременном контакте с кислородом.
К облигатным спорообразующим анаэробам относятся клостридии столбняка, ботулизма, анаэробной раневой инфекции; к неспорообразующим анаэробам - бактероиды, пептобактерии, бифидумбактерии.
Большинство патогенных бактерий - факультативные (условные) анаэробы, например, энтеробактерии. Они имеют полный набор ферментов и при широком доступе кислорода окисляют глюкозу до конечных продуктов; при низком содержании кислорода они вызывают брожение.
Микроаэрофилы размножаются в присутствии небольших количеств кислорода. Например, кампилобактеры могут размножаться при 3-6% кислорода.
Что такое окислительно-восстановительный потенциал среды, какие микробы лучше растут при низких его значениях, какие - при более высоких?
Окислительно-восстановительный потенциал среды –
Анаэробы – лучше при низком потенциале среды, аэробы наоборот
Типы брожения. Что такое аэрация питательной среды, как она осуществляется?
Спиртовое, уксуснокислое, молочнокислое, маслянокислое, а также разложение целлюлозы (клетчатки). Микроорганизмы, вызывающие брожение, имеют промышленное значение.
Спиртовое брожение - распад углеводов с образованием этилового спирта и диоксида углерода - вызывают дрожжевые грибы. Этот вид брожения известен давно и используется при изготовлении спиртных напитков.
Уксуснокислые бактерии окисляют этиловый спирт в аэробных условиях до уксусной кислоты. Они используются в промышленности, но при попадании в вино или пиво могут приводить к их порче.
Молочнокислое брожение вызывают лактобактерии. Конечным продуктом процесса является молочная кислота, которая губительно действует на гнилостные микробы кишечника. Молочнокислые бактерии применяют для изготовления кисломолочных продуктов: простокваши, йогурта, ацидофилина. Препарат лактобактерии, применяемый для устранения дисбактериоза, содержит культуру живых молочнокислых бактерий.
Маслянокислое брожение осуществляют анаэробные бактерии. Конечным продуктом брожения является масляная кислота, образование которой вызывает порчу консервированных продуктов.
Аэрация - обогащение питательной среды стерильным воздухом или кислородом с целью увеличить выход биомассы при культивировании (обычно глубинном) аэробных микроорганизмов в жидкой питательной среде. Встряхивание, пропускание струи стерильного воздуха под давлением через среду.
Особенности культивирования анаэробных бактерий. Среды, методы и приборы, используемые для их культивирования.
Для культивирования анаэробов необходимо понизить окислительно-восстановительный потенциал среды, создать анаэробиоз путем удаления кислорода физическими, химическими или биологическими методами.
К физическим методам можно отнести:
1) механическое удаление воздуха с помощью насоса из анаэ-ростата, в котором помещают чашки с посевами. Одновременно можно заменить воздух индифферентным газом: азотом, водородом, углекислым газом.
2) выращивание в среде, содержащей редуцирующие вещества. Среда Китта-Тароцци - это сахарный бульон с кусочками печени или мяса. Глюкоза и кусочки органов обладают редуцирующей способностью. Среду заливают сверху слоем вазелинового масла, чтобы преградить доступ кислорода воздуха.
3) Наиболее простой, но менее надежный способ - выращивание в глубине высокого столбика сахарного агара.
Химические методы заключаются в том, что чашки с посевами анаэробов ставят в герметически закрытый эксикатор, куда помещают химические вещества, например, пирогаллол и щелочь, реакция между которыми идет с поглощением кислорода.
Биологический метод основан на одновременном выращивании анаэробов и аэробов на плотных питательных средах в чашках Петри, герметически закрытых после посева. Вначале кислород поглощается растущими аэробами, а затем начинается рост анаэробов.
Выделение чистой культуры анаэробов начинают с накопления анаэробных бактерий путем посева на среду Китта-Тароцци. В дальнейшем получают изолированные колонии одним из двух способов:
1) посев материала производят путем смешивания с расплавленным теплым сахарным агаром в стеклянных трубках. После застывания агара в глубине его вырастают изолированные колонии, которые извлекают путем распила трубки и пересевают на среду Китта-Тароцци (способ Вейнберга);
2) посев материала производят на чашки с питательной средой и инкубируют в анаэростате. Выросшие на чашке изолированные колонии пересевают на среду Китта-Тароцци (способ Цейсслера).
Среда Китта-Тароцци: на чём основано её действие, что входит в её состав, что делают со средой перед посевом и для чего?
Среда Китта-Тароцци. Содержит мясо-пептонный бульон, 0,5% глюкозы и 0,15% агара. На дно пробирки для адсорбции О2 помещают кусочки варёной печени или фарша слоем 1-1,5 см и заливают 6-7 мл среды. Среду перед посевом регенерируют (прогревают 15-20 мин. на водяной бане для удаления воздуха, а затем быстро охлаждают). После посева среду заливают вазелиновым маслом и помещают в термостат.
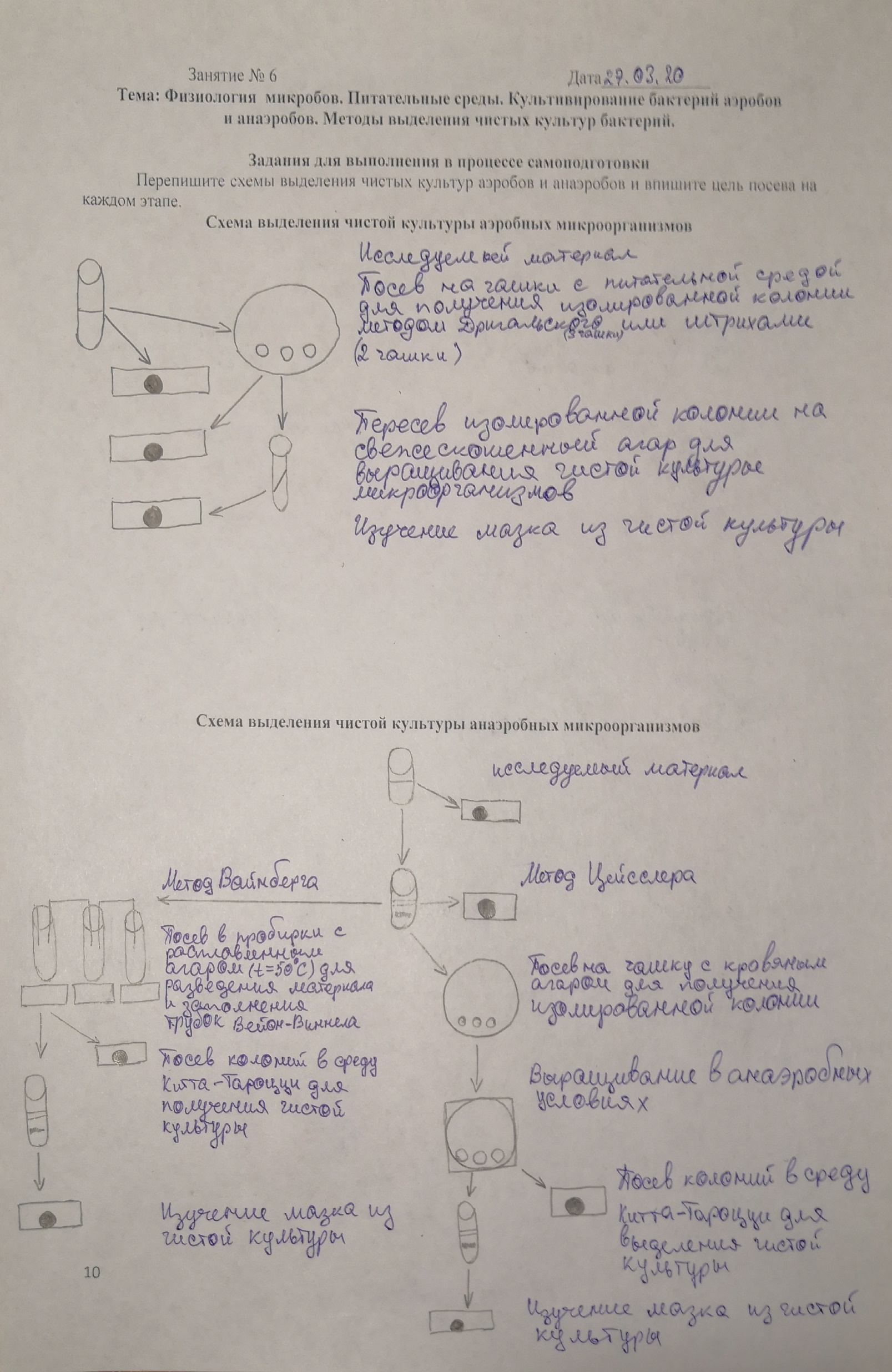
Рассказать поэтапно выделение чистой культуры микробов-аэробов.
Выделение чистых культур аэробов занимает, как правило, три дня и производится по следующей схеме:
1-й день - микроскопия мазка из исследуемого материала, окрашенного (обычно по Граму) - для предварительного ознакомления с микрофлорой, что может быть полезным в выборе питательной среды для посева. Затем посев материала на поверхность застывшего питательного агара для получения изолированных колоний. Рассев можно произвести по методу Дригальского на три чашки Петри с питательной средой. Каплю материала наносят на первую чашку и распределяют шпателем по всей чашке. Затем этим же шпателем распределяют оставшуюся на нем культуру на второй чашке и таким же образом - на третьей. Наибольшее количество колоний вырастет на первой чашке, наименьшее - на третьей. В зависимости от того, сколько было микробных клеток в исследуемом материале, на одной из чашек вырастут изолированные колонии.
Такого же результата можно достигнуть, произведя рассев на одной чашке. Для этого делят чашку на четыре сектора. Исследуемый материал засевают бактериологической петлей штрихами на первом секторе, затем, прокалив и остудив петлю, распределяют посев из первого сектора во второй и таким же образом последовательно в третий и четвертый сектор. Из отдельных микробных клеток после суточного инкубирования в термостате образуются изолированные колонии.
2-й день - изучение колоний, выросших на чашках, описание их. Колонии могут быть прозрачными, полупрозрачными или непрозрачными, они имеют различные размеры, округлые правильные или неправильные очертания, выпуклую или плоскую форму, гладкую или шероховатую поверхность, ровные или волнистые, изрезанные края. Они могут быть бесцветными или иметь белый, золотистый, красный, желтый цвет. На основании изучения этих характеристик выросшие колонии разделяются на группы. Затем из исследуемой группы отбирают изолированную колонию, готовят мазок для микроскопического исследования с целью проверки однородности микробов в колонии. Из этой же колонии производят посев в пробирку со скошенным питательным агаром.
3-й день - проверка чистоты культуры, выросшей на скошенном агаре путем микроскопии мазка. При однородности исследуемых бактерий выделение чистой культуры можно считать законченным.
Рассказать поэтапно выделение чистой культуры микробов–анаэробов.
Выделение чистой культуры анаэробов начинают с накопления анаэробных бактерий путем посева на среду Китта-Тароцци. В дальнейшем получают изолированные колонии одним из двух способов:
1) посев материала производят путем смешивания с расплавленным теплым сахарным агаром в стеклянных трубках. После застывания агара в глубине его вырастают изолированные колонии, которые извлекают путем распила трубки и пересевают на среду Китта-Тароцци (способ Вейнберга);
2) посев материала производят на чашки с питательной средой и инкубируют в анаэростате. Выросшие на чашке изолированные колонии пересевают на среду Китта-Тароцци (способ Цейсслера).
Что такое психрофилы, мезофилы, термофилы? Оптимальная температура для роста патогенных микробов.
Для психрофилов оптимальная температура для роста 10-15°С. минимальная 0-5°С, максимальная 25-30°С. Большинство из них свободноживущие и паразиты холоднокровных животных, по есть и патогенные для человека, например, иерсинии, псевдомонады. Они размножаются при температуре бытового холодильника и более вирулентны при низких температурах.
Мезофилы размножаются преимущественно в организме теплокровных животных и человека. Оптимальная температура для их роста 30-37°С, максимальная 43-45°С, минимальная 15-20°С. Большинство патогенных микроорганизмов относятся к мезофилам. В окружающей среде они обычно не размножаются, но могут сохраняться живыми.
Для термофилов оптимальная температура для роста 50-60°С, минимальная равна 45°С максимальная 90°С. Термофильные бактерии живут в юрячей воде гейзеров. Они не размножаются в организме человека.
Как, по каким признакам проводится описание изолированных колоний бактерий на плотных питательных средах?
Для идентификации выделенных бактерий изучаются культураль-ные признаки, то есть характер роста на жидких и плотных питательных средах. Например, стрептококки на сахарном бульоне образуют придонный и пристеночный осадок, на кровяном агаре - мелкие, точечные колонии; холерный вибрион образует пленку на поверхности щелочной пептонной воды, а на щелочном агаре - прозрачные колонии; палочка чумы на питательном агаре образует колонии в виде «кружевных платочков» с плотным центром и тонкими волнистыми краями, а в жидкой питательной среде - пленку на поверхности, а затем -нити, отходящие от нее в виде «сталактитов».
Что входит в понятие «культуральные свойства микробов»? Для чего их изучают?
Культуральные свойства данного вида микроорганизмов - это: 1) условия, необходимые для размножения, и 2) характер роста на питательных средах. Культуральные свойства - это одна из характеристик, которые учитываются при идентификации (определения вида) микроорганизмов.
Пигменты микробов, их характеристика: приведите примеры микробов, образующих пигменты, растворимые в воде, растворимые в органических растворителях и нерастворимые пигменты.
Некоторые виды микробов вырабатывают красящие вещества -пигменты. Если пигмент растворим в воде, то окрашенными представляются и колонии микробов, и питательная среда. Например, синий пигмент, выделяемый синегнойной палочкой (Pseudomonas aeruginosa), окрашивает среду в синий цвет. Пигменты, растворимые в органических растворителях, но нерастворимые в воде, не окрашивают питательную среду. Такой пигмент красного цвета, так называемый продигиозан, растворимый в спирте, выделяет чудесная палочка (Serratia marcescens). К этой же группе относятся пигменты желтого, оранжевого, красного цвета, характерные для кокковой воздушной микрофлоры. У некоторых видов микробов пигменты настолько прочно связаны с протоплазмой клетки, что не растворяются ни в воде, ни в органических растворителях. Среди патогенных бактерий такие пигменты золотистого, палевого, лимонно-желтого цвета образуют стафилококки.
Цвет пигмента используется для определения вида бактерий.
Некоторые микроорганизмы в процессе метаболизма вырабатывают ароматические вещества. Например, для синегнойной палочки характерен запах жасмина. Характерный запах сыров, сливочного масла, особый "букет" вина объясняется жизнедеятельностью микробов, которые используются для производства этих продуктов.
Свечение (люминесценция) микробов происходит в результате освобождения энергии при биологическом окислении субстрата. Свечение бывает тем интенсивнее, чем сильнее приток кислорода Светящиеся бактерии были названы фотобактериями. Они придают свечение чешуе рыб в море, грибам, гниющим деревьям, пищевым продуктам, на поверхности которых размножаются. Свечение может наблюдаться при низких температурах, например, в холодильнике. Патогенных для человека среди фотогенных бактерий не установлено.
Свечение пищевых продуктов, вызванное бактериями, не приводит к их порче, и даже может свидетельствовать о том. что в этих продуктах не происходит гниения, поскольку оно прекращается при развитии гнилостных микроорганизмов.
Определите понятия: асептика; антисептика, дезинфекция, стерилизация.
Асептика - комплекс мероприятий, направленных на предупреждение попадания микробов в рану, или в пробирку с питательной средой, в ампулу с лекарственным средством и т.д.
Антисептика - способ обеззараживания ран, операционного поля, рук хирурга, а также воздействие на инфекцию в организме пациента с помощью химических веществ - антисептиков.
Дезинфекция - уничтожение патогенных микробов в окружающей среде и различных объектах с целью прервать путь передачи и распространения инфекционного заболевания. Для дезинфекции используют химические вещества, лучевые и другие воздействия.
Стерилизация - процесс, направленный на полное уничтожение всех микроорганизмов в каком-либо объекте. Для стерилизации используют физические, химические методы и их сочетание.
К физическим способам относятся: стерилизация высокой температурой, УФ-облучением, ионизирующим излучением, ультразвуком, фильтрованием через бактериальные фильтры.
Перечислите методы стерилизации, применяемые в микробиологической практике и медицине. Охарактеризуйте каждый из этих методов: аппаратура, режим стерилизации (температура и время), стерилизуемые материалы, контроль успешной стерилизации.
Прокаливание на огне. Это надежный метод стерилизации, но он имеет ограниченное применение из-за порчи предметов. Таким способом стерилизуются бактериологические петли.
Стерилизация сухим жаром. Проводится в печи Пастера (сухожаровой шкаф) при температуре 160-170°С в течение 1-го часа. Этим способом стерилизуют лабораторную стеклянную посуду, пипетки, завернутые в бумагу, пробирки, закрытые ватными пробками. При температуре выше 170°С начинается обугливание бумаги, ваты, марли.
Стерилизация паром под давлением (автоклавирование). Наиболее универсальный метод стерилизации. Проводится в автоклаве - водо-паровом стерилизаторе. Принцип действия автоклава основан на зависимости температуры кипения воды от давления.
Автоклав представляет собой двустенный металлический котел с герметически закрывающейся крышкой. На дно автоклава наливают воду, в рабочую камеру помещают стерилизуемые предметы, закрывают крышку, сначала не завинчивая ее герметически. Включают нагревание и доводят воду до кипения. Образующийся при этом пар вытесняет из рабочей камеры воздух, который выходит наружу через открытый выпускной кран. Когда весь воздух будет вытеснен, и из крана пойдет непрерывной струей пар, кран закрывают, крышку закрывают герметически. Доводят пар до нужного давления под контролем манометра. Температура пара зависит от давления: при нормальном атмосферном давлении стрелка манометра стоит на 0 атм. - температура пара 100°С, при 0,5 атм. - 112°С, при 1 атм. -121°С, при 1,5 атм. - 127°С, при 2 атм. - 134°С. По окончании стерилизации автоклав отключают, ждут, пока давление не снизится, выпускают постепенно пар и открывают крышку. Обычно при давлении 1 атм. в течение 20-40 минут стерилизуют простые питательные среды и растворы, не содержащие белков и углеводов, перевязочный материал, белье. Стерилизуемые материалы должны быть проницаемы для пара. При стерилизации материалов в больших объемах (хирургические материалы) время увеличивают до 2 часов. При давлении 2 атм. производят обеззараживание патологического материала и отработанных культур микробов.
Питательные среды, содержащие сахара, нельзя стерилизовать при 1 атм., так как они карамелизуются, поэтому их подвергают дробной стерилизации текучим паром, или автоклавированнию при 0,5 атм.
Для контроля режима стерилизации применяются биологический и физический методы. Биологичесжй метод основан на том, что одновременно со стерилизуемым материалом помещают споры Bacillus stearothermophilus, которые погибают при 121°С за 15 минут. После проведения стерилизации споры не должны дать рост на питательной среде. Физический метод основан на применении веществ, имеющих определенную точку плавления, например, серу (119°С), бензойную кислоту (120°С). Запаянные трубки, содержащие вещество в смеси с сухим красителем (фуксин) помещают в автоклав вместе со стерилизуемым материалом. Если температура в автоклаве достаточна, вещество расплавится и окрасится в цвет красителя.
Стерилизация текучим паром_проводится в аппарате Коха или в автоклаве при незавинченной крышке и открытом выпускном кране. Воду в аппарате нагревают до 100°С. Образующийся пар проходит через заложенный материал и стерилизует его. Однократная обработка при 100°С не убивает споры. Поэтому применяют дробный метод стерилизации - 3 дня подряд по 30 минут, в промежутках оставляя на сутки при комнатной температуре. Прогревание при 100°С вызывает тепловую активацию спор, вследствие чего они прорастают до следующего дня в вегетативные формы и погибают при втором и третьем прогревании. Вследствие этого стерилизация текучим паром могут подвергаться только питательные среды, т.к. для прорастания спор необходимо наличие питательных веществ.
Для материалов, разрушающихся при 100°С (например, сыворотки, питательные среды, содержащие белок) применяют другой вид дробной стерилизации - тиндализацию. Стерилизуемый материал прогревают на водяной бане при 56-60°С в течение 5-6 дней подряд - в первый день в течение 2 часов, в остальные дни по 1 часу.
