
КФ 2
.pdf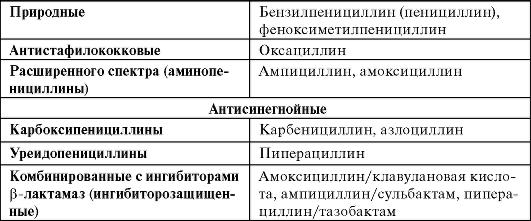
Резистентность к β-лактамам возможна у большинства микроорганизмов и обусловлена разнообразными механизмами.
Первый механизм - в большей степени бактерии защищаются от действия антибиотиков путем продукции ферментов - β-лактамаз. Эти ферменты нарушают целостность β-лактамного кольца, что приводит к инактивации антибиотиков. β-Лактамазы часто вырабатывают такие микроорганизмы, как стафилококки, кишечная палочка, гонококки, анаэробы.
β-лактамазы разделяют:
-по субстратному профилю - пенициллиназы, цефалоспорина-зы, карбапенемазы;
-по локализации в микробной клетке генов, кодирующих продукцию β-лактамаз: хромосомные и плазмидные.
Из всех β-лактамных препаратов только карбапенемы отличаются высокой стабильностью к гидролизу всеми хромосомными и плаз-мидными β-лактамазами, в том числе β-лактамазы расширенного спектра действия.
Для преодоления резистентности, связанной с продукцией β-лактамаз, были разработаны соединения, способные подавлять активность этих ферментов, так называемые ингибиторы β-лактамаз, - кла-вулановую кислоту, сульбактам и тазобактам. Их используют при создании комбинированных (ингибиторозащищенных) пенициллинов (амоксициллин/клавулановая кислота, ампициллин/сульбактам и др.), а также цефалоспоринов (цефоперазон/сульбактам), но сами по себе антимикробной активностью они не обладают.
Второй механизм - изменение ПСБ участка микробной клетки, на которую действует антибиотик (модификация мишени). Это ведет
к тому, что антибиотик не может связаться с мишенью, на которую направлена его активность. Примером таких микроорганизмов можно считать пенициллинорезистентный пневмококк.
Третий механизм - синтез дополнительного ПСБ (механизм «обходного пути»). При этом, несмотря на действие антибиотика, жизнедеятельность микроорганизма не нарушается. Такой механизм характерен для стафилококков, устойчивых к метициллину®, оксацил-лину и другим пенициллинам и цефалоспоринам.
Четвертый механизм - нарушение проницаемости клеточной стенки для β-лактамов. Такой механизм обеспечивает устойчивость синегнойной палочки к β-лактамам.
Фармакокинетика
Основные фармакокинетические свойства пенициллинов следующие:
•сохраняют активность в очаге воспаления (при низком рН, концентрации О2, высокой концентрации белка, большом количестве лейкоцитов);
•плохо проникают в моноциты и через гематоэнцефалический барьер при отсутствии воспалительного процесса;
•менее активны в отношении колоний с высокой концентрацией бактерий;
•как правило, безопасны при беременности.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Наиболее высокой биодоступностью (93%) обладают специальные растворимые таблетки амоксициллина - флемоксин солютаб*.
Бензилпенициллин, карбокси- и уреидопенициллины в значительной степени разрушаются в желудке, из-за этого их вводят только парентерально. Феноксиметилпенициллин, оксациллин и аминопенициллины более кислотоустойчивы, их можно назначать внутрь. Наилучшее всасывание из ЖКТ характерно для амок-сициллина - 75-93%, в то же время его биодоступность не зависит от пищи. Всасывание феноксиметилпенициллина составляет 40-60% (при приеме натощак концентрация в крови несколько выше). Хуже всасываются ампициллин (35-40%) и оксациллин (25-30%), причем пища значительно снижает их биодоступность. Всасывание ингибитора β-лактамаз - клавулановой кислоты - составляет 75%.
Бензилпенициллина новокаиновую соль* и бензатина бензил-пенициллин вводят только внутримышечно. Медленно всасыва-
ясь из места инъекции, они создают более низкие, по сравнению с натриевой и калиевой солями бензилпенициллина, концентрации в сыворотке крови. Обладают пролонгированным действием, их иногда называют «депо-пенициллины». Терапевтическая концентрация бензилпенициллина новокаиновой соли* в крови сохраняется на протяжении 18-24 ч, а бензатина бензилпеницил-лина - 3-4 нед.
Пенициллины распределяются во многих органах, тканях и биологических жидкостях. Создают высокие концентрации в легких, почках, слизистой оболочке кишечника, репродуктивных органах, костях, плевральной и перитонеальной жидкости. Наиболее высокая концентрация в желчи характерна для уреидопенициллинов. проникают через плаценту и в грудное молоко. Плохо проходят через гематоэнцефалический и гематоофтальмический барьер, а также в предстательную железу. При менингите проницаемость гематоэнцефалического барьера увеличивается.
Клинически значимой биотрансформации в печени могут подвергаться оксациллин (до 45%) и уреидопенициллины (до 30%). Другие пенициллины практически не подвергаются метаболизму и выводятся из организма в неизмененном виде. Среди ингибиторов β-лактамаз наиболее интенсивно биотрансформируется клавулановая кислота (около 50%), в меньшей степени - сульбактам (около 25%), еще слабее - тазобактам.
Большинство пенициллинов экскретируется почками. Их Т1 / 2 составляет в среднем около 1 ч (кроме «депопенициллинов») и значительно возрастает при почечной недостаточности. Оксациллин и уреидопенициллины выводятся двумя путями - через почки и желчевыводящие пути. Их Т1 / 2 в меньшей степени изменяется при нарушении функций почек.
Почти все пенициллины полностью удаляются при гемодиализе. Концентрация пиперациллин/тазобактама снижается при проведении гемодиализа на 30-40%.
Спектр активности пенициллинов
Природные пенициллины
Все препараты из группы природных пенициллинов обладают идентичным спектром активности против следующих микроорганизмов. • Грамположительные аэробные кокки (кроме стафилококков) и палочки:
-стрептококки (за исключением пневмококка и некоторых штаммов зеленящих стрептококков) - возбудители фарингита, тонзиллита, флегмоны, рожистого воспаления, эндокардита, синусита, отита;
-энтерококки - возбудители инфекций мочевых путей, сепсиса, эндокардита (встречаются резистентные штаммы);
-Corynebacterium diphteriae - возбудитель дифтерии;
-Bacillus antracis - возбудитель сибирской язвы;
-листерии.
• Грамотрицательные микроорганизмы:
-менингококки;
-некоторые штаммы гонококков;
-большинство бактерий рода Leptospira;
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
-спирохеты (Treponema pallidum - возбудитель сифилиса, Borrelia burgdorferi - возбудитель болезни Лайма);
-анаэробные микроорганизмы (кроме Bacteroides spp.).
•Actinomices israelii - возбудитель актиномикоза.
•Клостридии - возбудители газовой гангрены, столбняка.
Антистафилококковые пенициллины
Основной антибиотик этой группы - оксациллин. По антимикробному спектру он близок к природным пенициллинам, но уступает им по активности в отношении большинства микроорганизмов. Оксациллин устойчив к действию стафилококковой пенициллиназы, следовательно, активен в отношении пенициллинорезистентных стафилококков. Исходя из этого стафилококковые инфекции (абсцессы, эндокардит, остеомиелит, флегмона) считают основным показанием к назначению данного препарата. Однако необходимо помнить о наличии так называемых метициллиноустойчивых штаммов стафилококков (MRSA - meticillin resistant staphylococcus aureus), устойчивых как к пенициллинам, так и цефалоспоринам.
Аминопенициллины
В начале применения в клинической практике аминопенициллины имели преимущество по сравнению с природными пенициллинами, в основном благодаря действию на грамотрицательные палочки - представители семейства Enterobacteriacea (возбудителей кишечных инфекций): E. mli, шигелл, сальмонелл, а также энтерококков, P. mirabilis, H. pylori (только амоксициллин), листерий. Однако в настоящее время все больше видов приобретают устойчивость к аминопенициллинам.
К ампициллину устойчивы большинство штаммов шигелл, клебси-елл, 30-50% E. coli, значительная часть P. mirabilis, разной степенью устойчивости обладает H. influenza, встречаются резистентные штаммы сальмонелл. Следует помнить, что аминопенициллины разрушаются всеми β-лактамазами, и применение комбинации с β- лактамазами значительно расширяет спектр действия аминопенициллинов.
Ингибиторозащищенные аминопенициллины
Антимикробный спектр ингибиторозащищенных аминопеницил-линов (амоксициллин/клавулановая кислота, ампициллин/сульбак-там) расширен за счет микроорганизмов, резистентность которых к аминопенициллинам обусловлена выработкой некоторых видов β-лактамаз - стафилококков, гонококков, гемофилов, E. coli, P. mirabilis, клебсиелл, P. vulgaris, C. diversus, а также некоторых анаэробов (в том числе группы B. fragilis).
Карбоксипенициллины
Спектр действия карбенициллина и в отношении грамположи-тельных бактерий в целом совпадает с таковым других пеницилли-нов, но уровень активности ниже. Карбоксипенициллины действуют на некоторые штаммы P. aeruginosa и Proteus spp. Следует учитывать, что многие штаммы P. aeruginosa уже устойчивы к антибиотикам этой группы. Эффективность карбоксипенициллинов ограничена способностью многих бактерий к выработке β-лактамаз, разрушающих эти антибиотики.
Ингибиторозащищенные карбоксипенициллины
Тикарциллин/клавулановая кислота имеет более широкий антимикробный спектр в сравнении с тикарциллином за счет стафилококков, клебсиелл, протеев, анаэробов. Однако необходимо иметь в виду, что тикарциллин/клавулановая кислота не имеет преимуществ перед тикарциллином по действию на P. aeruginosa.
Уреидопенициллины
Азлоциллин и пиперациллин обладают сходным спектром и практически равноценным уровнем антибактериальной активности. По действию на грамположительные бактерии они существенно превосходят карбоксипенициллины и приближаются к природным пенициллинам и аминопенициллинам. Уреидопенициллины высокоактивны в отношении многих грамотрицательных бакте-
рий семейства Enterobacteriaceae, не вырабатывающих β-лактамаз, большинства штаммов Citrobacter spp., Klebsiella spp., Enterobacter spp., P. aeruginosa и других неферментирующих бактерий (Burkholderia cepacia, Stenotrophomonas maltophilia).
Ингибиторозащищенные уреидопенициллины
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Самостоятельное клиническое значение уреидопенициллинов достаточно ограничено, что объясняется их лабильностью к действию большинства β-лактамаз как стафилококков, так и грамотри-цательных бактерий.
Этот недостаток в значительной степени компенсирован у инги-биторозащищенного препарата - пиперациллин/тазобактам, обладающего наиболее широким спектром (все анаэробные бактерии) и высоким уровнем антибактериальной активности среди всех пени-циллинов. Однако штаммы, вырабатывающие β-лактамазы расширенного спектра действия, устойчивы к пиперациллину/тазобактаму.
Показания к применению
Природные пенициллины
В зависимости от особенностей и тяжести течения инфекции возможно применение природных пенициллинов для парентерального введения (обычных или пролонгированных) или приема внутрь при следующих состояниях.
•Инфекции, вызванные стрептококками, и их последствия (тон-зиллофарингит, скарлатина, рожистое воспаление), а также для круглогодичной профилактики ревматизма.
•Менингококковая инфекция.
•Сифилис.
•Лептоспироз.
•Клещевой боррелиоз.
•Газовая гангрена.
•Актиномикоз.
•Профилактика бактериального эндокардита перед стоматологическими процедурами.
Поскольку пролонгированные пенициллины не создают высоких концентраций в крови и практически не проникают через гемато-энцефалический барьер, они не применяются для лечения тяжелых инфекций. Показания к их применению включают в себя только
лечение сифилиса (кроме нейросифилиса), длительную профилактику ревматической лихорадки, рожистого воспаления, скарлатины.
Феноксиметилпенициллин применяют для лечения легких и среднетяжелых стрептококковых инфекций (тонзиллофарингит, рожистое воспаление).
Из-за нарастания устойчивости гонококков к пенициллину его эмпирическое применение при гонорее не оправдано.
Оксациллин
Показан при подтвержденных или предполагаемых стафилококковых инфекциях различной локализации: кожи, мягких тканей, костей и суставов; пневмонии, инфекционном эндокардите, сепсисе.
Аминопенициллины и ингибиторозащищенные аминопенициллины
Основные показания к применению этих препаратов совпадают. Назначение аминопенициллинов более обосновано при легких и неосложненных инфекциях, а их ингибиторозащищенных производных - при более тяжелых или рецидивирующих формах, а также наличии данных о высокой частоте распространения β-лактамазапродуцирующих бактерий. Путь введения (парентерально или внутрь) выбирают в зависимости от тяжести инфекции. Для приема внутрь более целесообразно назначать амоксициллин или амоксициллин/клавулановая кислота.
Препараты данной группы применяют для лечения внебольнич-ных бактериальных инфекций:
-верхних и нижних дыхательных путей (средний отит, синусит, обострение хронического бронхита, внебольничная пневмония);
-внебольничных инфекций мочевыводящих путей, вызванных энтерококком (острый цистит, пиелонефрит);
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
-менингита, вызванного гемофильной палочкой или Listeria monocytogenes (ампициллин в высокой дозе внутривенно);
-эндокардита (ампициллин в сочетании с гентамицином или стрептомицином) и его профилактики;
-кишечных инфекций - шигеллеза, сальмонеллеза (ампициллин в больших дозах); эрадикации H.
pylori (амоксициллин).
Дополнительными показаниями считают инфекции кожи и мягких тканей, органов малого таза, интраабдоминальные инфекции, периоперационную профилактику в хирургии.
Карбоксипенициллины,уреидопенициллины и их ингибиторозащищенные соединения
Карбоксипенициллины в настоящее время потеряли клиническое значение и практически полностью вытеснены пиперацил-лином или комбинированными препаратами (тикарциллин/клаву-лановая кислота, пиперациллин/тазобактам). Уреидопенициллины (азлоциллин, пиперациллин) в сочетании с аминогликозидами применяют при синегнойной инфекции (в случае чувствительности P. aeruginosa).
Пиперациллин/тазобактам назначают при лечении тяжелых, преимущественно нозокомиальных, смешанных (аэробно-анаэробных) инфекций различной локализации, например дыхательных путей (нозокомиальные пневмонии, включая вентиляционную; эмпиема плевры, абсцесс легкого); кожи и мягких тканей (включая диабетическую стопу); интраабдоминальных и тазовых инфекций; послеродовых гнойно-септических осложнений; инфекций желчевыводя-щих путей, желчного перитонита, абсцессов печени; осложненных инфекций мочевыводящих путей; инфекций на фоне нейтропении; раневых и ожоговых инфекций.
Нежелательные лекарственные реакции
Обычно пенициллины хорошо переносятся. Наиболее частыми НЛР пенициллинов считают аллергические реакции: крапивницу, сыпь, отек Квинке, лихорадку, эозинофилию, бронхоспазм, анафилактический шок (чаще при введении бензилпенициллина). Аллергия имеет перекрестный характер ко всем антибиотикам пенициллино-вой группы. У некоторых пациентов с аллергией на цефалоспорины может отмечаться аллергия и на пенициллины. Необходимо учитывать данные аллергологического анамнеза, в сомнительных случаях проводить кожные пробы со специальными аллергенами, приготовленными на основе метаболитов пенициллина. Пациентам с аллергией на прокаин (новокаин*) нельзя назначать бензилпенициллина новокаиновую соль*. При появлении признаков аллергической реакции (сыпи) во время лечения пенициллинами следует немедленно отменить антибиотик.
При применении аминопенициллинов иногда отмечается неаллергическая «ампициллиновая» макулопапулезная сыпь, которая не сопровождается зудом и может исчезнуть без отмены препарата. «Ампициллиновая» сыпь отмечается у 75-100% пациентов
с инфекционным мононуклеозом, получающих аминопеницил-лины.
Могут появляться неврологические симптомы: головная боль, тремор, судороги (чаще у детей и у пациентов с почечной недостаточностью при применении карбенициллина или очень высоких доз бензилпенициллина); психические расстройства (при введении высоких доз бензилпенициллина новокаиновой соли*).
Со стороны ЖКТ иногда отмечают боли в животе, тошноту, рвоту, диарею, псевдомембранозный колит (чаще при применении ампициллина и ингибиторозащищенных пенициллинов). При приеме оксациллина в дозах более 6 г/сут или ингибиторозащищенных пенициллинов могут появляться НЛР со стороны печени.
При применении высоких доз калиевой соли бензилпенициллина у пациентов с почечной недостаточностью, а также при ее сочетании с калийсберегающими диуретиками, препаратами калия или ИАПФ может развиваться гиперкалиемия. При назначении карбеницилли-на, высоких доз натриевой соли бензилпенициллина может развиться гипернатриемия, что сопровождается появлением или усилением отеков у пациентов с сердечной недостаточностью, повышением АД.
При парентеральном введении пенициллинов возможны местные реакции: болезненность и инфильтраты при внутримышечном введении (особенно калиевой соли бензилпенициллина), флебиты при внутривенном введении (чаще при применении карбеницилли-на).
Введение «депо-пенициллинов» (бензилпенициллина новокаино-вая соль* и бензатина бензилпенициллин) может приводить к развитию сосудистых осложнений: синдрома Онэ (ишемия и гангрена конечностей при введении в
артерию), синдрома Николау (эмболия сосудов легких и головного мозга при введении в вену). Для предотвращения подобных осложнений следует соблюдать правила введения «депо-пенициллинов»: препараты вводят строго внутримышечно в верхний наружный квадрант ягодицы; пациент во время инъекции должен находиться в горизонтальном положении; непосредственно перед введением препарата необходимо потянуть поршень шприца на себя для предотвращения попадания в сосуд.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Возможны гематологические реакции: анемия, нейтропения (чаще при введении оксациллина); нарушение агрегации тромбоцитов, иногда - тромбоцитопения (при применении карбенициллина, реже - уреидопенициллинов).
Очень редко отмечается транзиторная гематурия (оксациллин); интерстициальный нефрит.
Взаимодействие с другими препаратами
Пенициллины нельзя смешивать в одном шприце или в одной инфузионной системе с аминогликозидами из-за их физико-химической несовместимости.
При сочетании ампициллина с аллопуринолом возрастает риск развития «ампициллиновой» сыпи. Оксациллин проявляет антагонизм к рифампицину.
Применение высоких доз калиевой соли бензилпенициллина в сочетании с калийсберегающими диуретиками, препаратами калия или ИАПФ повышает риск развития гиперкалиемии. Необходимо соблюдать осторожность при сочетании антисинегнойных пеницил-линов с антикоагулянтами и антиагрегантами из-за потенциального риска повышения кровоточивости. Не рекомендовано сочетание с тромболитиками.
29.3. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ ЦЕФАЛОСПОРИНОВ
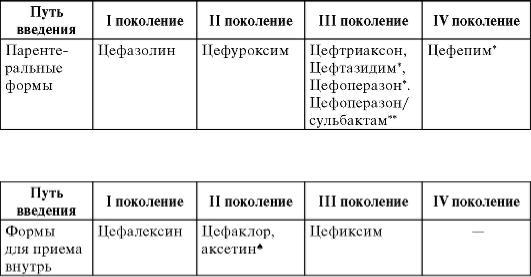
Цефалоспорины - один из самых обширных классов антибиотиков. Наиболее распространена классификация цефалоспоринов по поколениям (табл. 29-2), внутри каждого поколения выделяют препараты для парентерального применения и приема внутрь.
Механизм действия такой же, как и других β-лактамных препаратов.
Таблица 29-2. Классификация цефалоспоринов
Окончание табл. 29.2
*Препараты с антисинегнойной активностью.
**Сочетание цефоперазона с ингибитором β-лактамаз - сульбактамом, обладает антисинегнойной и антианаэробной активностью.
Фармакокинетика
Цефалоспорины для парентерального применения и приема внутрь значительно различаются по своим фармакокинетическим характеристикам.
Цефалоспорины для приема внутрь быстро и хорошо всасываются из ЖКТ, биодоступность составляет от 40-50% (цефиксим) до 95% (цефалексин, цефаклор). Одновременный прием с пищей замедляет скорость всасывания цефаклора, цефиксима и цефтибутена, но не снижает биодоступность этих препаратов. Аксетин* представляет собой пролекарство, гидролизуется в ЖКТ с высвобождением активного цефуроксима, причем пища способствует этому процессу.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Цефалоспорины распределяются во многих органах, тканях и биологических жидкостях (легкие, почки, печень, мышцы, кожа и мягкие ткани, кости, синовиальная, плевральная, перикардиаль-ная и перитонеальная жидкость). Цефалоспорины III (цефотаксим, цефтриаксон и цефтазидим), а также IV поколения (цефепим) хорошо проникают через гематоэнцефалический барьер и подходят для лечения менингитов. Цефалоспорин II поколения цефу-роксим проникает через ГЭБ только при воспалении мозговых оболочек.
Большинство цефалоспоринов не подвергаются метаболизму. Исключением считают цефотаксим, 50% введенной дозы которого подвергается биотрансформации с образованием активного метаболита - дезацетилцефотаксима, обладающего антимикробной активностью и более длительным (по сравнению с цефотаксимом)
Т1 / 2 (1,5 ч).
Т1 / 2 большинства цефалоспоринов составляет 1-2 ч, что определяет необходимость назначения антибиотиков этой группы 3-4 раза в сутки. Больший Т1 / 2 (3-4 ч) характерен для цефалоспоринов III поколения - цефиксима и цефтибутена и их принимают 1 раз
в сутки. Наибольшим Т1/2 обладает препарат III поколения цефтри-аксон (до 5-7 ч), который при большинстве инфекций назначают 1 раз в сутки, а при менингите - 1-2 раза в сутки.
Большинство цефалоспоринов выделяются почками в неизмененном виде, создавая высокие концентрации в моче. Цефтриаксон и цефоперазон имеют двойной путь выведения (печень и почки).
Спектр активности
Следует отметить «пробелы» в спектре активности, характерные для всех цефалоспоринов. Они не активны в отношении MRSA, энтерококков, листерий, микобактерий, внутриклеточных возбудителей (легионелл, хламидий, микоплазм).
По активности против анаэробов большинство цефалоспори-нов обладают умеренным действием на фузобактерии, пептококки, пептстрептококки и не действуют на неспорообразующие анаэробы группы В. fragilis.
Цефалоспорины I поколения (ЦС-I) имеют узкий спектр антимикробной активности, напоминающий спектр аммиопеницил-линов.
Цефалоспорины II поколения (ЦС-II) отличаются от ЦС-I более высокой активностью против грамотрицательных микроорганизмов (гонококков, менингококков, H. influenzae, M. catarrhalis, E. coli, P. mirabilis, P. vulgaris, Klebsiella spp.), S. pneumoniae, по действию на стафилококков и стрептококков близки к ЦС-I. Следует отметить, что ЦС-II для приема внутрь - цефаклор менее активен против гемо-фил и пневмококков, чем цефуроксим. Несмотря на хорошую активность in vitro, ЦС-II не применяют для лечения кишечных инфекций и менингита вследствие большей эффективности цефалоспоринов III поколения (цефотаксима и цефтриаксона).
Цефалоспорины III поколения (ЦС-III) обладают более высокой, чем ЦС-I-II поколения, активностью в отношении грамотрица-тельных микроорганизмов (гонококков, менингококков, гемофил, M. catarrhalis, представителей семейства Enterobacteriaceae), пневмококков (в том числе пенициллинорезистентных штаммов), высоко активны против других стрептококков, но несколько уступают ЦС-I-II поколения по антистафилококковой активности.
Необходимо отметить, что все ЦС-III не действуют на представителей семейства Enterobacteriaceae, имеющих механизмы приобретенной резистентности: продуцирующие β-лактамазу расширенного
спектра действия штаммы E. coli и K. pneumoniae, штаммы энтеробак-тера, цитробактера, серрации и провиденции, являющиеся гиперпродуцентами хромосомных β-лактамаз класса AmpC.
Среди ЦС-III поколения два препарата - цефоперазон и особенно цефтазидим обладают клинически значимой антисинегнойной активностью. Однако по активности против стрептококков и пневмококков антисинегнойные цефалоспорины уступают цефуроксиму, цефотаксиму и цефтриаксону.
Цефоперазон/сульбактам (сочетание антисинегнойного ЦС-III - цефоперазона с ингибитором β-лактамаз - сульбактамом) отличается высокой активностью против β-лактамазапродуцирующих микроорганизмов: грамотрицательных бактерий семейства Enterobacteriaceae, ацинетобактера, B. fragilis и других неспорообразующих анаэробов.
ЦС-III для приема внутрь (цефиксим и цефтибутен) обладают более узким спектром активности, чем парентеральные препараты того же поколения. Прежде всего это касается активности против пенициллинорезистентных пневмококков и связано с относительно невысокой биодоступностью и меньшей степенью аффинности этих препаратов к ПСБ.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
Цефалоспорины IV поколения (ЦС-IV) (цефепим) более активны в сравнении с ЦС-III в отношении штаммов Enterobacteriaceae, особенно против энтеробактера, цитробактера, серрации и провиден-ции,
продуцирующих хромосомные AmpC β-лактамазы; P. aeruginosa и стафилококков. По действию на пневмококки, другие стрептококки, анаэробы, ЦС-IV близки к ЦС-III. Обладают большей устойчивостью к β-лактамазам по сравнению с ЦС-III.
Показания к применению
Принимая во внимание различия в спектре антимикробной активности и фармакокинетических показателей цефалоспоринов разных поколений, а также препаратов одного поколения для парентерального применения и приема внутрь можно выделить следующие основные показания к их назначению.
ЦС-I в настоящее время применяют для лечения инфекций, вызванных стрептококками (но не пневмококками и энтерококками) и метициллиночувствительными стафилококками. Так, цефазолин применяют для лечения внебольничных инфекций кожи и мягких
тканей, костей и суставов, а также для периоперационной профилактики в хирургии.
Основные показания для назначения ЦС-I для приема внутрь:
-стрептококковый тонзиллофарингит;
-внебольничные инфекции кожи и мягких тканей, костей и суставов легкой и средней степени тяжести, вызванные чувствительными к ним стрептококками и стафилококками.
Применение ЦС-I при инфекциях мочевыводящих и дыхательных путей в настоящее время нельзя считать рациональным, что обусловлено узким спектром активности, распространением устойчивости среди наиболее вероятных возбудителей и появлением в клинической практике более эффективных антибактериальных препаратов.
ЦС-II можно назначать при всех состояниях, перечисленных для ЦС-I, а также при следующих заболеваниях:
-инфекциях верхних дыхательных путей (остром среднем отите, остром синусите);
-инфекциях нижних дыхательных путей (обострении хронического бронхита, внебольничной пневмонии);
-инфекциях мочевыводящих путей (остром цистите, пиелонефрите).
Цефуроксим считают альтернативой цефазолину в качестве анти-биотикопрофилактики в хирургии. Цефуроксим и аксетин* успешно назначают при проведении ступенчатой терапии.
Цефаклор уступает аксетину* по активности в отношении респираторных возбудителей (пневмококков и гемофилов), недостаточно хорошо проникает в жидкость среднего уха и не рекомендован для лечения острых средних отитов.
ЦС-III назначают для лечения тяжелых внебольничных и нозоко-миальных инфекций по следующим показаниям.
•Тяжелые инфекции верхних дыхательных путей (острый и хронический синусит - при необходимости парентерального введения).
•Тяжелые инфекции нижних дыхательных путей (внебольничная и нозокомиальная пневмония).
•Абсцесс легкого и эмпиема плевры (в сочетании с антианаэробными препаратами).
•Инфекции желчевыводящих путей.
•Тяжелые внебольничные и нозокомиальные инфекции мочевы-водящих путей.
•Интраабдоминальные и тазовые инфекции (в сочетании с антианаэробными препаратами).
•Кишечные инфекции (шигеллез, сальмонеллез).
•Тяжелые инфекции кожи, мягких тканей, костей и суставов.
•Бактериальный менингит (вызванный гемофилами, пневмококком, энтерококками, менингококками).
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
•Сепсис.
•Гонорея.
Эти препараты можно назначать для лечения некоторых инфекций в амбулаторной практике, например при острой гонорее (цеф-триаксон), а также остром среднем отите у детей (цефтриаксон 1 раз в сутки внутримышечно курсом на 3 сут).
ЦС-III с антисинегнойной активностью (цефоперазон, цеф-тазидим) применяют при инфекциях, вызванных P. aeruginosa. Антисинегнойные ЦС-III обычно становятся одним из обязательных компонентов комбинированной антибиотикотерапии инфекций на фоне нейтропении. Данные препараты обладают более низкой активностью против S. pneumoniae, из-за чего не рекомендованы для лечения пневмококковых инфекций.
Цефоперазон/сульбактам назначают при тех же показаниях, что и цефоперазон, однако он имеет преимущества при лечении абсцессов легких, эмпиемы плевры, интраабдоминальных и тазовых, а также вызванных бактериями рода ацинетобактер инфекций благодаря высокой антианаэробной активности.
Назначение ЦС-III-IV для периоперационной профилактики в хирургии нерационально прежде всего вследствие их недостаточной активности против S. aureus.
Показания к назначению ЦС-III для приема внутрь (цефиксима и цефтибутена) ограничены и включают в себя случаи ступенчатой терапии после применения парентеральных ЦС-III, инфекции мочевыводящих путей (особенно у детей, беременных и кормящих), дыхательных путей (цефтибутен не рекомендован при возможной пневмококковой этиологии).
ЦС-IV применяют для лечения тяжелых, преимущественно нозо-комиальных инфекций, вызванных резистентными возбудителями (энтеробактериями - энтеробактером, цитробактером, серрацией и провиденцией, резистентными к ЦС-II-III из-за гиперпродукции хромосомных AmpC β-лактамаз; а также Р. aeruginosa), в том числе пневмонии, осложненных инфекций мочевыводящих путей, кожи, мягких тканей, костей, суставов, интраабдоминальных и тазо-
вых инфекций (в сочетании с антианаэробными препаратами), при менингите, сепсисе и нейтропенической лихорадке.
Нежелательные лекарственные реакции
В целом цефалоспорины хорошо переносятся. Наиболее частая НЛР цефалоспоринов - аллергия (крапивница, кореподобная сыпь, лекарственная лихорадка, эозинофилия, сывороточная болезнь, анафилактический шок). Возможна перекрестная аллергия между цефа-лоспоринами и пенициллинами.
При приеме цефалоспоринов возможны гематологические реакции (лейкопения, гемолитическая анемия). Цефоперазон может вызывать гипопротромбинемию со склонностью к кровотечениям и дисульфирамоподобный синдром (повышение чувствительности к алкоголю).
Со стороны ЖКТ могут отмечаться боли в животе, тошнота, рвота, диарея, описаны случаи развития псевдомембранозного колита, со стороны печени возможно обратимое повышение активности трансаминаз, возникновение холестаза и псевдохолелитиаза (при применении цефтриаксона).
При назначении цефалоспоринов парентерально могут возникать местные реакции: болезненность и инфильтраты при внутримышечном, флебиты - при внутривенном введении.
Взаимодействие с другими препаратами
Цефалоспорины не рекомендуют смешивать с другими препаратами в одном шприце или инфузионной системе, необходимо четко следовать инструкциям производителя по использованию определенных растворителей. На всасывание цефалоспоринов для приема внутрь в кишечнике может влиять пища; одновременный прием антацидов снижает их всасывание, интервалы между приемом этих препаратов должны быть не менее 2 ч.
При сочетании ЦС с аминогликозидами или петлевыми диуретиками, особенно у пациентов с нарушениями функций почек, возможно повышение риска нефротоксичности.
При сочетании цефоперазона с антикоагулянтами, антиагреган-тами и тромболитиками увеличивается риск развития кровотечений.
Цефоперазон обладает дисульфирамоподобным эффектом, следовательно, недопустимо принимать алкоголь во время приема этого препарата.
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
29.4. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ АЗТРЕОНАМА
Единственный представитель монобактамов (моноциклических β-лактамов), применяемый в клинической практике, - азтреонам.
Фармакокинетика
Азтреонам вводят только парентерально. Он хорошо проникает в различные биологические жидкости, органы и ткани. Не подвергается метаболизму, выводится преимущественно почками (55-74%), Т1/2 составляет 1,5-2 ч, практически не изменяется при циррозе печени, а при почечной недостаточности увеличивается до 6-8 ч.
Азтреонам хорошо переносится. При применении азтреонама не отмечено аллергических реакций у пациентов с гиперчувствительностью немедленного типа к пенициллинам, но описаны редкие случаи перекрестной аллергии с цефтазидимом.
При почечной недостаточности необходима коррекция дозы азтре-онама.
Спектр активности
Азтреонам обладает узким спектром антимикробной активности - действует только на грамотрицательные аэробные бактерии: нейссерии, гемофилы, M. catarrhalis, энтеробактерии (E. coli, энтеробактеры, протей, клебсиеллы, серрации, провиденции и др.) и P. aeruginosa. Азтреонам не действует на грамположительные бактерии и анаэробы.
Показания к применению
Азтреонам применяют для лечения инфекций, вызванных аэробными грамотрицательными бактериями, как альтернативу аминогликозидам. Его можно назначать в сочетании с пеницилли-нами и цефалоспоринами (кроме имипенема), аминогликозидами, фторхинолонами, линкозамидами, ванкомицином, метронидазо-лом.
29.5. КЛИНИЧЕСКАЯ ФАРМАКОЛОГИЯ КАРБАПЕНЕМОВ
Карбапенемы, как пенициллины и цефалоспорины, содержат в своей структуре β-лактамное кольцо и благодаря этому входят в семейство β-лактамов. В России применяют два антибиотика из группы карбапенемов: имипенем и меропенем.
Фармакокинетика
Карбапенемы не всасываются при приеме внутрь. После парентерального введения быстро и в высокой концентрации распределяются в жидкостях и тканях организма, включая ликвор. Выделяются почками путем гломерулярной фильтрации. Одной из особенностей имипенема считают его гидролиз в почках ферментом дегидропепти-дазой I, разрушающей 60-95% введенной дозы препарата. При этом концентрация активного препарата в моче недостаточна для эради-кации возбудителей при инфекциях мочевыводящих путей. Для снижения метаболизма имипенема в почках применяют ингибитор дегидропептидазы I - циластатин, обладающий сходным с имипене-мом фармакокинетическим профилем. В настоящее время имипенем назначают в сочетании с циластатином (1:1) под торговым названием тиенам*. В отличие от имипенема меропенем стабилен к действию дегидропептидазы I.
Спектр активности
Карбапенемы обладают целым рядом микробиологических особенностей, выгодно отличающих их от других β- лактамов: наиболее широким спектром активности из всех β-лактамов; устойчивостью к действию плазмидных и хромосомных β-лактамаз; низкой частотой приобретенной резистентности; отсутствием перекрестной резистентности с пенициллинами и цефалоспоринами.
Имипенем и меропенем обладают самым широким спектром активности из всех известных антибактериальных препаратов, который включает в себя подавляющее большинство клинически значимых аэробных и анаэробных бактериальных возбудителей.
В отношении грамотрицательных микроорганизмов меропенем более активен по сравнению с имипенемом. Однако меропенем менее активен, чем имипенем, в отношении грамположительных микроор-
ганизмов. Карбапенемы высокоактивны в отношении пневмококков, в том числе пенициллинорезистентных штаммов, анаэробов, включая возбудителей интраабдоминальных инфекций.
Показания к применению
Еще больше книг только на канале Telegram "Медицинские книги" https://t.me/medknigi
