
- •Окислительно- восстановительн ые реакции
- •Cтепень окисления:
- •Переменная С.О.
- •акцепторы ē
- •Типичные восстановители (Red) –
- •баланса
- •Стандартный окислительно- восстановительный (red-ох)
- •Применение таблиц φ0
- •pH – зависимые ОВР
- •Метод полуреакций
- •схема ОВР
- •3) направление ОВР по
- •Cамопроизвольно идет ОВР:
- •Механизмы
- •Окислительно-восстановительный потенциал (Red-Оx) φr
- •Причины возникновения φr
- •Измерение φ°r
- •Измерение φ°r
- •ОВ-системы
- •Уравнение Петерса
- •Электродный потенциал φм
- •Электродный потенциал
- •Измерение φ0м по ЭДС
- •для нестандартных условий
- •Гальванический элемент Даниэля-Якоби
- •гальванических
- •Биороль ОВР
- •5.Действие ох на организм

Метод полуреакций
• для ox:
MnO-4 + 8H+ + 5ē Mn+2 + 4H2O 2
• для Red:
H2O2 
 O2 + 2H+ + 2ē 5
O2 + 2H+ + 2ē 5
(справа налево)
2MnO-4 + 16H+ +10ē + 5H2O2


 2Mn+2 + 8H2O + 5O2 +10H+ +10ē
2Mn+2 + 8H2O + 5O2 +10H+ +10ē

схема ОВР
2MnO-4 +6H+ + 5H2O2 2Mn+2 + 8H2O +5O2 ox Red
Mолекулярное уравнен
2КMnO4 + 3H2SO4 + 5H2O2 = 2MnSO4 + 8H2O +5O2 +К2SO4
Пример 3: φ0 MnO-4 Mn+2 =1,52B φ0 I2  2I- =0,53B
2I- =0,53B

3) направление ОВР по
φ0
сильные Oх + Red слабые Oх + Red
Пример: S +2H+ + 2I- 
 H2S+I2
H2S+I2
Red Ox сильные
φ0 S H2S =0,14 B φ0 I2 2I- = 0,53 B

E = φ0Ox - φ0 Red
Величиной ЭДС определяется
1)интенсивность ОВР
2)направление ОВР
Уравнение Нернста
∆G =-Z E F
∆G – свободная энергия Гиббса Z – число ē F – const Фарадея

Cамопроизвольно идет ОВР:
при E>0 |
∆G<0 |
|
|
|
|
|
прямая |
|
|
|
|
|
|||
|
|
|
|
|
|||
E<0 |
∆G>0 |
|
|
|
|
|
обратная |
|
|
|
|
|
|||
|
|
|
|
|
|||
E=0 |
∆G=0 |
|
|
|
|
|
равновесие |
|
|
||||||
|
|
||||||
|
|
|
|
||||
|
|
|
|
Пример:
S +2H+ + 2I- |
|
H2S+I2 |
|
||
|
Oх Red
Е прямой реакции = 0,14 - 0,53 =
 = - 0,39В <0 (обратная реакция)
= - 0,39В <0 (обратная реакция)

Механизмы
возникновения
потенциалов

Окислительно-восстановительный потенциал (Red-Оx) φr 
•Возникает на границе инертного металла (Au, Pt) и раствора содержащий ОВ-систему
•Инертный Ме не участвует в ОВР, служит для переноса электронов и понижает энергию активации (Еакт)

Причины возникновения φr
Причина: 1. С (Oх) ≠ С(Red)
2.Различные акцепторные свойства ох и Red форм (способность присоединять é)
Пример: при C(Fe+3) < C(Fe+2)
Fe+2 - 1e → Fe+3
=>Пластинка(-) =>  ДЭС => φr
ДЭС => φr

Измерение φ°r
в стандартных условиях путём сравнения с водородным электродом 
2H+ +2ē H2 φ°2H+/H2 =0 B
Гальваническая цепь:
- анод |
катод + |
Pt | Fe+3; Fe+2 || H2SO4 |H2,Pt |
|
↓ |
↓ |
граница |
солевой мостик |
раздела фаз |
(граница раздела |
|
ОВ-систем) |
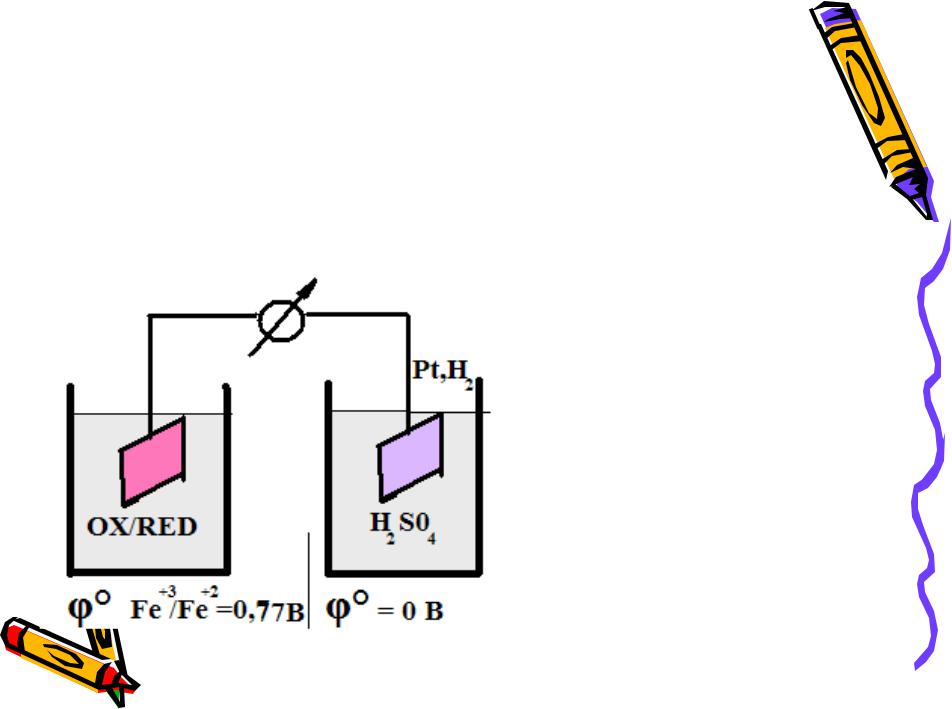
Измерение φ°r
2Fe+2 + 2H+ 2Fe+3 + H2 Red Ox
= φ°r
