
Химия и экология
.docxХимические
реакции в атмосфере.
Процессы окисления в тропосфере могут
протекать:1)
в газовой фазе; 2)
в
ра-ре; 3)
на
поверхности тв частиц.
Имея
по одному неспаренному электрону на
внешней электронной орбите, свободные
радикалы явл. сильными окислителями и
принимают активное участие в процессах
окисления примесей в газовой фазе
тропосферы. Механизм
образования гидроксидных и гидропероксидных
радикалов в атмосфере гидроксидный
радикал ОН (свободный радикал) образуется
в
верхних слоях стратосферы при прямой
фотодиссоциации
воды.
В тропосфере свободные радикалы
образуются, например, при химических
превращениях с участием синглетно
возбужденного атома кислорода O(1D),
который появляется в атмосфере в
результате фотодиссоциации кислорода,
озона и оксидов азота:
![]() Образующийся
по реакциям синглетно возбужденный
атом кислорода может вступать в химические
превращения, в результате которых
образуется гидроксидный радикал.
Наибольшее значение среди таких процессов
имеют превращения с участием молекул
воды, метана и водорода: О(1D)+H2O=2OH;
О(1D)+СН4=СН3+ОН;О(1D)+Н2 =Н+ОН.
Гидроксидный
радикал образуется в тропосфере также
при протекании реакций разложения
азотной и азотистой к-т и перекиси.
Образующийся
по реакциям синглетно возбужденный
атом кислорода может вступать в химические
превращения, в результате которых
образуется гидроксидный радикал.
Наибольшее значение среди таких процессов
имеют превращения с участием молекул
воды, метана и водорода: О(1D)+H2O=2OH;
О(1D)+СН4=СН3+ОН;О(1D)+Н2 =Н+ОН.
Гидроксидный
радикал образуется в тропосфере также
при протекании реакций разложения
азотной и азотистой к-т и перекиси.
Участие ОН-радикала в р-циях: CO+OH=CO2+H;CH4+OH =CH3+H2O;NO+OH+M= HNO2+M*. Образующийся по данной реакции водород может реагировать с О2 с образованием гидропероксидного радикала: H+O2→HO2 Гидропероксидный радикал образуется также при взаимодействии О3 или Н2О2 с гидроксидным радикалом: O3 + OH → HO2 + O2; H2O2 + OH → HO2 + H2O
Хим. превращения орган. соед. в тропосфере. Фотохим. превращение метана в тропосфере протекает по радикальному механизму. На первой стадии при взаимодействии с гидроксидным радикалом происходит образование алкильного радикала: R–CH3 + HO → R–CH2 + H2O. В случае превращения метана образовавшийся на первой стадии метальный радикал при столкновении с молекулой кислорода в присутствии третьего тела дает другую неустойчивую частицу-метилпероксидный радикал: CH3+O2+M→CH3OO+M* Метилпероксидный радикал в атмосфере разлагается с образованием метоксильного радикала по реакции: 2CH3OO→O2+2CH3O. Возможными являются и процессы взаимодействия с оксидом азота или гидропероксидным радикалом: CH3OO+NO→CH3O+NO2;CH3OO+HO2→CH3O+O2+OH. При взаимодействии метоксильного радикала с кислородом происходит образование формальдегида: CH3O+O2→CH2O+HO2. Молекулы формальдегида более устойчивы в атмосфере и являются промежуточными продуктами окисления метана. При окислении гомологов метана образуются соответствующие альдегиды. Формальдегид может подвергаться фотолизу при взаимодействии с ультрафиолетом: CH2O+hν→CHO+H; CH2O+hν→CO+H2. Формильный радикал (НСО) образуется также при взаимодействии формальдегида с гидроксидным радикалом: CH2O+OH→CHO+H2O. Реагируя с ОН-радикалом, формильный радикал образует оксид углерода, который является еще одним устойчивым промежуточным продуктом окисления метана и его гомологов: CHO+OH→CO+H2O. Оксид углерода при взаимодействии с гидроксидным радикалом образует диоксид углерода, который является конечной стадией окисления метана и его гомологов в атмосфере: CO+OH→CO2 +H. В процессе окисления органических соединений в атмосфере, протекающем через ряд последовательных стадий, происходит образование органических радикалов, отличающихся высокой реакционной способностью и малым временем жизни в атмосфере, и достаточно устойчивых промежуточных продуктов окисления, которые часто являются значительно более токсичными соединениями, чем исходные ве-ва.
Фотохимические ре-ции. Образование долгоживущих метастабильных атомов и молекул, в результате поглощения электромагнитного излучения – фотохимические р-ции. Например, процессы, идущие при образовании озонового слоя в стратосфере:
О2+hv=O•+ O•; O•+o2+M=O3,∆H=-100кДж; O•+O3=2O2,∆H=-390кДж; О3+hv=O2+O•; где М-N2 или О2. Выделение тепла обусловлено ростом температуры в стратосфере с высотой. Основными типами фотохимических реакций в атмосфере являются: фотоионизация (NO+ hν→NO++e); фотодиссоциация (О2+ hν→ O·+O·); фотовозбуждение (Н(s2) + hν→H(p2)); флюоресценция или люминесценция (Na(p2) → Na(s2)+ hν); радиативная рекомбинация (О++e→O·+ hν); фотоотлипание (O-+ hν→ O·+e); радиативное прилипание (e+O3→ O-+ hν)
Реакции
атмосферных ионов.
Образующиеся молекулярные ионы обладают
очень большой реакционной способностью,
носят экзотермический характер.
Происходит рекомбинация иона с электроном,
сопровождающаяся диссоциацией:
![]() Такие
ре-ции назыв. реакциями диссоциативной
рекомбинации.
Атомарный азот в верхних слоях атмосферы
образуется исключительно в результате
такой ре-ции. Перенос
заряда.
Когда молекулярный ион сталкивается с
какой-либо нейтральной частицей, между
ними может произойти перенос электрона:
(ре-ция должна быть экзотермическая):
Такие
ре-ции назыв. реакциями диссоциативной
рекомбинации.
Атомарный азот в верхних слоях атмосферы
образуется исключительно в результате
такой ре-ции. Перенос
заряда.
Когда молекулярный ион сталкивается с
какой-либо нейтральной частицей, между
ними может произойти перенос электрона:
(ре-ция должна быть экзотермическая):![]()
Р-ции,
когда частицы обмениваются атомами:
экзотермические
и протекают легко, при этом образуется
молекулярный ион NО+
(г). Энергия ионизац. NO
самая низкая. Таким образом, молекулы
N2,
О2
и NО отфильтровывают большую часть
опасного ультрафиолетового излучения
на высоте около 100 км.Образование
озона: О(г)
+ О2(г) ↔ О3* + 105 кДж/моль.Эта реакция
обратима и если частица О3*
не отдает избыточную энергию при
столкновении с другой (N2
и О2),
то молекула распадется. Молекулы озона
сами могут поглощать излучение, и сильнее
всего озоном поглощаются фотоны с длиной
волны 200 – 310 нм. «Озоновый щит» играет
важную роль в сохранении жизни на
Земле.
Обобщенный
процесс циклического образования и
разложения озона: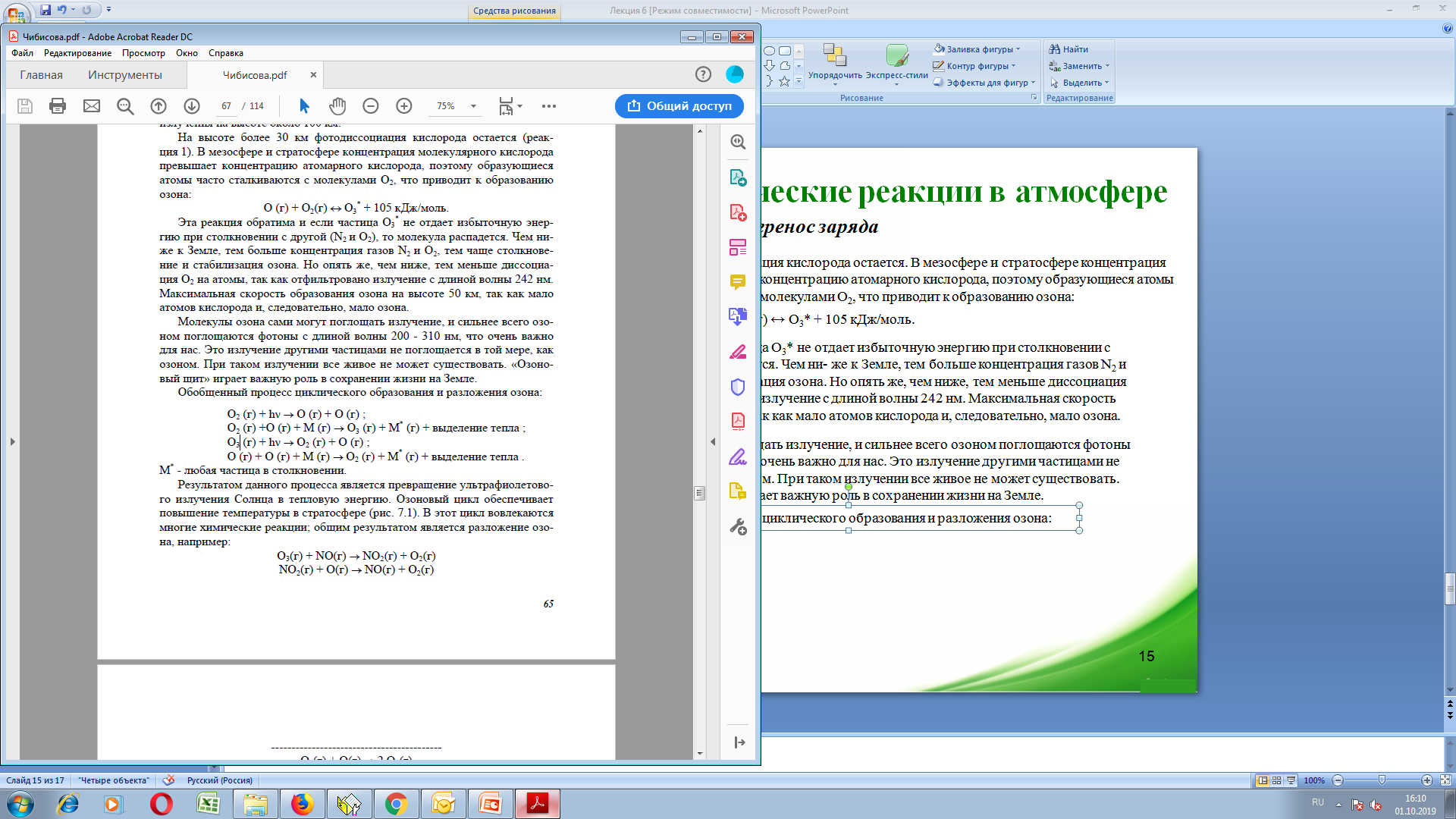 М*
- любая частица в столкновении
М*
- любая частица в столкновении
Озоновый
цикл обеспечивает повышение температуры
в стратосфере. При полете сверхзвуковых
самолетов в двигателях достигается
такая высокая температура, что становится
возможной реакция: N2 (г) +O2 (г) → 2 NО (г),
в результате которой оксид азота
выбрасывается в стратосферу, существенно
снижая концентрацию озона. Разрушение
озона обусловлено также влиянием
фторхлорметанов:![]() За
этим следует разложение CFxCl3–x
и т.д. Расчеты показывают, что скорость
образования атомарного хлора максимальна
на высоте 30 км.
За
этим следует разложение CFxCl3–x
и т.д. Расчеты показывают, что скорость
образования атомарного хлора максимальна
на высоте 30 км.![]() Оксид
хлора, реагируя с атомарным кислородом,
вновь дает атомарный хлор: ClО (г) + О(г) →
Cl (г)+ О2(г);
снова Cl(г) + О3(г)→
ClО(г) + О2
(г)... обрыв цепи может происходить при
взаимодействии хлора с молекулами
водорода, метана, воды, пероксида
водорода. В итоге имеем суммарную
реакцию: О(г) + О3(г) → 2О2(г).
Постоянно
возникающий и разрушающийся слой озона
вызывает явление, названное «озонным
дождем». В атмосфере с увеличением
высоты конц. озона убывает из-за конц.
третьих частиц и кислорода. Разрушение
озона в основном обусловливает азотный
цикл. Антропогенное
загрязнение атмосферы:
1.Ядерные
взрывы. 2.Сверхзвуковые
самолеты 3.Использование
минеральных азотных удобрений.
4.Сжигание
топлива дает до 3 млн тонн оксидов азота
в год.В
химии и фотохимии атмосферы участвуют
пять основных азотсодержащих газов:
N2,
NH3,
NO, NO2,
N2O.
Возможные взаимодействия можно описать
следующей схемой:
Оксид
хлора, реагируя с атомарным кислородом,
вновь дает атомарный хлор: ClО (г) + О(г) →
Cl (г)+ О2(г);
снова Cl(г) + О3(г)→
ClО(г) + О2
(г)... обрыв цепи может происходить при
взаимодействии хлора с молекулами
водорода, метана, воды, пероксида
водорода. В итоге имеем суммарную
реакцию: О(г) + О3(г) → 2О2(г).
Постоянно
возникающий и разрушающийся слой озона
вызывает явление, названное «озонным
дождем». В атмосфере с увеличением
высоты конц. озона убывает из-за конц.
третьих частиц и кислорода. Разрушение
озона в основном обусловливает азотный
цикл. Антропогенное
загрязнение атмосферы:
1.Ядерные
взрывы. 2.Сверхзвуковые
самолеты 3.Использование
минеральных азотных удобрений.
4.Сжигание
топлива дает до 3 млн тонн оксидов азота
в год.В
химии и фотохимии атмосферы участвуют
пять основных азотсодержащих газов:
N2,
NH3,
NO, NO2,
N2O.
Возможные взаимодействия можно описать
следующей схемой:
![]() где
М-третье ве-во, принимающее избыток
энергии. Цикл взаимодействий на основе
соединений N
в тропосфере дополняется образованием
азотной кислоты: 4NO2+
2H2O+O2→4HNO3
или
по р-ии диспропорционирования
3NO2+H2O↔2HNO3+
NO.
где
М-третье ве-во, принимающее избыток
энергии. Цикл взаимодействий на основе
соединений N
в тропосфере дополняется образованием
азотной кислоты: 4NO2+
2H2O+O2→4HNO3
или
по р-ии диспропорционирования
3NO2+H2O↔2HNO3+
NO.
Атмосферные циклы серы и азота. Большую экологическую опасность представляет диоксид серы-SO2, выбрасывается с дымовыми газами топливно-энергетические установки, перерабатывающие угли и мазуты с большим содержанием серы, а также предприятия цветной и черной Меургии (15%) при переработке сульфидных руд. Cu2S+2О2→2CuO+SO2;4FeS2 +11О2→2Fe2O3 + 8SO2. При производстве H2SO4, при травлении Ме, на литейных производствах, вредное влияние SO2 сказывается на нефтеперегонных, кожевенных, суперфосфатных и др. заводах, при добыче нефти, в кузницах и котельных.Воздействие диоксида серы-заболеваемость людей, снижение продуктивности сельскохозяйственных угодий, ускорение коррозии Меоконструкций, разрушение архитектурных сооружений и памятников.Основным окислителем соединений серы являются свободные радикалы. H2S окисляется до SO2. Полученный SO2 окисляется далее. H2S +OH→H2O+HS; HS+O2→SO+OH; SO+ H2O→SO2+OH. Окисление диоксида серы может протекать в газовой фазе-1 путь, в твердой фазе (окислению предшествует адсорбция)-2 путь и в жидкой фазе (окислению предшествует абсорбция)-3 путь. Основной механизм процесса в газовой фазе (первый путь) связывали с образованием диоксида серы в возбужденном состоянии, который, реагируя с молекулярным кислородом, образует SO3. SO2+hv=SO2*, 290нм <v<400нм; SO2*+2О2=SO3+O3. Образующийся SO3 вступает во взаимодействие с молекулой воды: SO3+H2O→H2SO4.
Соединения азота в тропосфере. Азот имеется в почве, растениях и живых организмах, без азота не образуются белковые ве-ва, необходимые для построения протоплазмы клеток. Животные и большинство растений потребляют не свободный, а связанный азот. В природе молекулярный азот связываются в оксиды при грозах, нитрификации почвы, лесных пожарах. В атмосфере каждый год наблюдается до 3 млрд молний. Создаваемые ими высокие температуры в несколько тысяч градусов инициируют процесс взаимодействия молекулярного азота и кислорода по радикально-цепному механизму:O2→ 2O•, N2+O•→ NO+N•, O2+N•→ NO+O•. В свою очередь NO окисляется кислородом воздуха до NO2:2NO+O2→ 2NO2.При взаимодействии с атмосферной влагой происходит образование азотистой и азотной кислот: 2NO2+Н2O→HNO2+HNO3.В почвах и водных экосистемах также происходит довольно быстрая нитрификация: 4NH4++6O2→4NO2-+8H++4H2O ; 4NO2-+2O2→4NO3-
Химические соединения, участвующие в цикле азота, отличающиеся по степени окисления. В природе молекулярный азот может также фиксироваться клубеньковыми бактериями бобовых растений, дрожжевыми и плесневыми грибками, сине-зелеными водорослями. После гибели растений и животных содержащие азот химические соединения подвергаются микробиологическому распаду.
Денитрификация-образование молекулярного азота из органических соединений, нитратов и нитритов в почвах и водных экосистемах в аэробных и анаэробных условиях. Денитрификация не всегда приводит к выделению молекул N2. Она может также завершаться образованием оксидов азота:[CH2O]+2NO3- +6H+ →N2O+CO2+H2O, [CH2O]+4NO2- +4H+ →4NO+CO2+3H2O. В связывании атмосф. азота большую долю составляет его промышленная фиксация в процессе производства аммиака, азотной кислоты и азотных удобрений. Основной источник оксидов азота явл. энергетика и транспорт, хим. промышленность. Оксиды азота обладают общетоксичным и раздражающим действием. При контакте диоксида азота с влажной поверхностью легких происходит образование азотной и азотистой кислот, которые поражают альвеольную ткань, что приводит к отеку лёгких. С другой стороны, в организме может происходить образование солей этих ки-т-нитратов и нитритов, которые вызывают значительные изменения в крови и влияют на сердечно-сосудистую систему. Кроме того, нитраты, поступающие в организм в повышенных дозах, способны повышать частоту инфекционных заболеваний, болезней кожи и подкожной клетчатки, лор-органов, ослабляют иммунитет. Промежуточный продукт окисления азота воздуха и азотсодержащих соединений топлива является такое чрезвычайно ядовитое ве-во, как цианистый водород-HCN. Образование HCN отмечено при пиролизе пиридина и при окислении различных азотсодержащих соединений в смесях с топливом при недостатке кислорода. Азотсодержащие соединения, входящие в состав топлива также являются источниками образования оксидов азота при его сжигании.N2O - газ, усиливающий парниковый эффект. Отличается чрезвычайной устойчивостью и сохраняется в атмосфере до 170 лет. Накапливается за счет сведения лесов, сжигания биомассы и разложения азотных удобрений. NO3- - подвижен в естественных усл., явл. основным загрязнителем грунтовых вод и его конц. часто превышает нормы, установленные Всемирной организацией здравоохранения. Загрязнители атмосферы. Загрязнение атмосферы Земли или Загрязнение воздуха происходит, когда в атмосферу Земли попадают вредные или избыточные кол-ва ве-в, включая газы (такие как диоксид углерода, монооксид углерода, диоксид серы, оксиды азота, метан и хлорфторуглероды), частицы (как органические, так и неорганические) и биологические молекулы. Это может вызвать заболевания, аллергию и даже смерть для людей, это может также нанести вред другим живым организмам, таким как животные и продовольственные культуры, и может нанести ущерб естественной или искусственной экосистеме (среде). Как человеческая деятельность, так и природные процессы могут вызывать загрязнение воздуха:Источники загрязнения атмосферы:1. ЕСТЕСТВЕННЫЕ(*пыльные бури,*вулканизм,*лесные пожары,*выветривание,* разложение живых организмов). 2.ИСКУССТВЕННЫЕ(антропогенные)(*промышленные предприятия,*транспорт,*теплоэнергетика,*отопление жилищ,*сельское хоз.).Парниковый эффект-это естественное явление, которое повышает температуру на нашей планете для комфортного существования. Основные парниковые газы: CO2, CH4, N2O, O3, водяной пар и синтетические химические ве-ва (гидрофторуглероды, галогенированные углеводороды, гексафторид серы и др. синтетические газы).Смог- чрезмерное загрязнение воздуха вредными веществами, выделенными в результате работы промышленных производств, транспортом и теплопроизводящими установками при определённых погодных условиях. Фотохимический смог. Механизмы его образования-загрязнение воздуха газовыми и аэрозольными примесями при химических реакциях оксидов азота с углеводородами, идущих под действием излучения Солнца (типичное проявление в местах интенсивного движения транспорта в жаркие солнечные дни). Лондонский смог-сочетание газообразных загрязнителей (в основном сернистого газа SO2), пылевых частиц и тумана. В смоге лондонского типа практически не образуется каких-либо новых веществ, а его токсичность целиком зависит от исходных загрязнителей, возникающих в результате сжигания больших количеств топлива.
Химия стратосферы и ионосферы. Озон. Хим. и физико-хим. св-ва озона. Озон О3-аллотропная модификация кислорода. Жидкий озон-темно-синяя жидкость. Тв озон-темно-фиолетовые призматические кристаллы. Ра-рим в уксусной и пропионовой кислотах. Озон хорошо адсорбируется силикагелем и алюмогелем. Это свойство исп. для его извлечения из ра-ров или газовых смесей. Химические свойства озона характеризуются двумя основными чертами: нестойкостью и сильным окислительным действием. При высоких конц.х разлагается со взрывом. Озон очень токсичен. Озон поглощает ультрафиолетовое и видимое излучение солнца и даже чуть-чуть инфракрасное. Озон стратосферы выполняет защитную функцию для биосферы. Распределение озона в атмосфере. Максимум конц. озона располагается в стратосфере; в тропосфере-от 0 до 0,1 мг/м3; в мезосфере озона мало, но он играет важную роль в поддержании теплового баланса планеты и формировании нижнего слоя ионосферы. В атмосфере принято выделять три зоны: полярную-максимум озона; тропическую-минимум озона; средние широты-занимают промежуточное положение.
Изменения озонового слоя. Механизм образования и разрушения озона. При взаимодействии с излучением длиной волны менее 240 нм молекула кислорода диссоциирует с образованием двух атомов кислорода-триплетного (От) и синглетного (Ос): O2+hv→Oт+Oc, в реакцию синтеза О3 способен вступать только От: O2+Ot+M→O3+M*
где М*-«третье тело», присутствие которого необходимо для отвода части энергии, выделяющейся в процессе. В результате реакции третье тело, в качестве которого в атмосфере выступают молекулы азота или кислорода, которых значительно больше, чем других газов, переходит в возбужденное состояние (М*). Распад молекулы озона по реакции с участием «нечетного кислорода. Молекула озона может взаимодействовать с атомом кислорода с образованием двух молекул кислорода: О3+О=2О2. Основное количество озона в атмосфере разлагается по реакции с ультрафиолетом: O3+hv→O2+Oc; O3+hv→O2+Oт. Атом кислорода в триплетном состоянии принимает участие в синтезе озона. Ре-ции образования и разложения озона часто называют нулевым циклом озона: O3+hv=O2+Oт;O2+Oт+M=O3+M*. Цепные процессы разрушения озона: водородный цикл; азотный цикл; хлорный и бромный циклы.
Нулевой, Водородный цикл (реакции с участием ОН). Н2О+hν→ОН+Н. Гидроксидные радикалы образуются и при взаимодействии молекул воды или метана с возбужденным атомом кислорода:H2O+Oc→2OH;CH4+Oc→2OH.Образовавшийся в этих процессах ОН может вступить в реакцию с озоном. Продуктами этого взаимодействия являются НО2 и молекула кислорода. Гидропероксидный радикал при взаимодействии с атомарным кислородом в триплетном состоянии образует молекулу кислорода и гидроксидный радикал. Водородный цикл, брутто-уравнение которого идентично реакции, входящей в нулевой цикл, замыкается, но при этом полностью нарушается нулевой цикл ОН+О3→НО2+О2;НО2+От→ОН+О2=О3+От→2О2.Азотный цикл. NO при взаимодействии с озоном окисляется до NO2, но при взаимодействии NО2 с атомарным кислородом в невозбужденном состоянии вновь образуется оксид азота. Азотный цикл замыкается, но при этом нарушается нулевой цикл озона: NО + О3 → NО2 + О2;NО2+От→NО+О2=О3+От→2О2. N2O образующийся в процессах денитрификации в почве, при взаимодействии с возбужденным атомом кислорода превращается в оксид азота, инициирующий азотный цикл гибели озона: N2О+Ос→2NО.Хлорный цикл и фреоны. Cl при взаимодействии с молекулой озона образует ClO и молекулу кислорода. Оксид хлора способен взаимодействовать с атомарным кислородом, находящимся в невозбужденном состоянии, с образованием атомарного хлора и молекулы кислорода. Cl+O3→ClO+O2;ClO+OT→Cl+O2;O3+OT→2O2.Хлорный цикл замыкается, а нулевой цикл озона нарушается: Атомарный хлор появляется в стратосфере при фотохимическом разложении ряда хлорфторуглеводородов. Наибольшую опасность среди хлорфторуглеводородов представляют некоторые фреоны. Эти нетоксичные, пожаровзрывобезопасные соединения, обладающие низкой реакционной способностью, широко использовались в холодильной технике, при производстве пенопластов и каучука, в изготовлении различных бытовых товаров в аэрозольных упаковках. Попадая в стратосферу, эти соединения могут взаимодействовать с излучением с длиной волны менее 240 нм, при этом происходит образование атомарного хлора и может начаться разрушение озонового слоя: СFСl3+hν→СFСl2+Сl. Бромный цикл. Атом брома способен при взаимодействии с озоном образовывать оксид брома и молекулу кислорода. Однако в отличие от оксида хлора ВrО может вступить в реакцию с другой молекулой оксида брома или с оксидом хлора, при этом образуются два атома соответствующего галогена и молекула кислорода: Br+O3→BrO+O2;BrO+ BrO→2Br+O2;ClO+BrO→Cl+Br+O2.Основными источниками брома в стратосфере являются бромсодержащие органические соединения, используемые для тушения пожаров (галлоны). Эти соединения, как и фреоны, устойчивы в тропосфере, имеют большое время жизни и, попадая в стратосферу, разлагаются под действием жесткого ультрафиолетового излучения. Образующ. при этом атом брома может вступить во взаимодействие с молекулой озона. Обрыв цепи в ре-циях распада озона. Возможным представляется и взаимодействие гидроксидного радикала с оксидом азота:ClO+NO2→ClNO2.Этот процесс интенсифицируется при ↑ конц. ClO и NО2 в атмосф. и делает практически невозможным одновременное осуществление азотного и хлорного циклов. При определен. условиях этот временный резервуар для сбора «разрушителей» озонового слоя может представлять серьезную опасность для О3.
Проблема озоновых дыр. Озоновая дыра-уменьшение общего содержания озона во всех областях атмосферы над определенной территорией. Причины образования озоновой дыры над Антарктидой: 1.увеличение поступления хлорфторуглеводородов в атмосферу 2.специфика движения воздушных масс в стратосфере высоких широт (полярный вихрь). Последствия поляр. вихрей: 1.прекращение обмена воздухом с другими областями стратосферы; 2.сток озона в тропосферу; 3.снижение температуры воздуха внутри вихря до –70…–80°С; 4.появление устойчивых аэрозольных образований-серебристых облаков, состоящих из аэрозолей-кристаллов льда и капель переохлажденной жидкости. В состав этих аэрозолей входят димеры оксида хлора (ClO)2, хлористый нитрозил (ClONO2) и другие соединения азота (НNО3, НNО2). Зимой эти соединения, связанные с аэрозолями, не взаимодействуют с озоном. Весной полярный вихрь распадается, и при повышении температуры на поверхности кристаллов льда начинают протекать гетерогенные химические процессы (димерный цикл), приводящий к реакции разложения озона: (ClO)2+hv=Cl+ClOO;СlOO=Cl+O2;суммируя все уравнения р-ий димерного цикла, получим 2O3+hv=3O2;Строение ионосферы. Ионосфера-ионизированная часть верхней атмосферы, представляет собой природное образование разреженной слабоионизированной плазмы, находящейся в магнитном поле Земли и обладающей специфическими свойствами, связанными с высокой электропроводностью. Ионосфера имеет 6- слоистое строение. Обозначаются буквами латинского алфавита A, B, C, D, E, F. Ионосфера Земли создается: корпускулярным и УФ-излучением Солнца; космическими лучами; радиоактивными ве-вами Земли и космоса.
Фотохимические процессы в ионосфере. На высотах от 85 до 200 км наибольшее значение имеет УФ-излучение, вызывающее фотохимические процессы: O2+hv=O2++e, v<102,6нм;Следует отметить, что может происходить и фотодиссоциация молекулы О2:O2+hv=OT+Oc при v<240нм. Ионизация имеет место на всех высотах, т. е. во всех областях ионосферы. Конц. заряженных частиц в ионосфере определяется скоростью ионизации, скоростью рекомбинации и диффузионными процессами. Ионы могут иметь как положительный заряд, т. е. катионы, так и отрицательный заряд. Ионно-молекулярные реакции в этой области протекают между нейтральными атомами или молекулами, отрицательными и положительными ионами, а также электронами.
Основные
химические реакции, в которых участвуют
положительные ионы.
В
условиях фотохимического равновесия
на высотах 85–200 км основными первичными
ионами являются ионы О+,
О 2+
, N2
![]() Первые
3 реакции-основные, происходят на высотах
выше 120– 140 км, последняя -на малых высотах
от 85 до 120 км. Рекомбинация-гибель
свободных электронов и других заряженных
частиц в результате столкновений.
Скорость рекомбинации с высотой
уменьшается. Скорость реакций превращения
ионов зависит от конц. ионов и температуры.
Диффузионные
процессы. Этот
процесс конкурирует с процессами
образования ионов и их рекомбинации и
зависит от магнитного поля. Заряженные
частицы беспрепятственно движутся
вдоль магнитных силовых линий, тогда
как перемещение поперек магнитного
поля затруднено. Если рассматривать
процессы в вертикальном столбе ионосферы,
то на экваторе, где силовые линии
магнитного поля направлены горизонтально,
роль диффузии мала. В высоких широтах,
где силовые линии геомагнитного поля
почти вертикальны, амбиполярная диффузия
в вертикальном направлении протекает
эффективно. Гидросфера.
Физико-хим.
процессы
в гидросфере.
H2O
как хим. соединение.
Существует
150
изотопных разновидностей
H2O, образован. котор. обусловл. комбинациями
изотопов H2
и стабильных изотопов O2
и 200 разновидностей льда. Наиболее
известными яв обычная H2O
и тяжелая H2O;
последняя образована тяжелым изотопом
H2
(дейтерием) и легким изотопом O.
Жидкая
H2O
имеет квазикристаллическую
структуру и
отличается выс. ближним порядком в
размещении частиц,
образующих непрерывно меняющ. кластерные
(групповые) скопления молекул, наход. в
постоянном движ.
Общим
для жидкой H2O
и льда яв. тетраэдрическое распределение
зарядов в молекуле Н2О,
определяющимся Н-связями. Состав
и классиф. природ. вод.
H2O
в своих 3 сост.-ж,
лед
и водяные пары-широко
распростр. на поверхности Земли и
занимает V 1,4 млрд км3. Почти вся эта H2O
(более
97 %) находится
в океанах, бóльшая часть из оставшейся
образует полярные ледяные шапки и
ледники (около
2 %). Континентальные
пресные H2O,
в основном это подземные
H2O (глубинные,
поверхностные;
озера;
почвенная
влага;
реки;
биосфера).
Атм. содержит сравнительно мало H2O (в
виде паров)-0,001 %.
В
р-ренном сост. в хим. составе пресной
H2O преобладают 4 Ме, присутствующие в
виде простых катионов: Са2+,
Na+,
К+
и Мg2+.Ионные
соед. хорошо р-римы в полярных р-рителях
типа H2O.
Находясь в р-ре, различные ионы вступают
в р-ии с H2O
по-разному. Ионы с низким зарядом обычно
р-ряются в виде простых катионов или
анионов. Такие ионы слабо взаимод. с
H2O. Ионы
меньшего размера с более высоким зарядом
вступают в р-ии с H2O,
притягивая ОН–,
и образуют незаряженные и нер-римые
гидроксиды, высвобождая в ходе р-ии ионы
водорода: Fe3+
+3H2O=Fe(OH)3
+ 3H+.
Некоторые
высокозаряженные ионы образуют большие
и устойчивые анионы типа оксианионов.
Ряд оксианионов
присутствуют в H2Oх виде слабых кислот,
и их поведение зависит от рН р-ров.
Классификация
природных вод по значению минерализации:
ультрапресные:менее
0,2; пресные:
0,2-0,5; с
повышенной минерализацией:0,5-1,0;
солоноватые:1-3;
соленые:3-10;
очень
соленые:10-35;
переходные
к рассолам:35-50;
рассолы:50-400.
Классификация
по жесткости.
Жесткостью
H2O называется
свойство H2O, обусловленное содержанием
в ней ионов кальция и магния.
Единицей жесткости H2O явл. моль жесткости
(моль/м3).
Некоторые способы классификации вод:
классификация
Алекина,
согласно которой все H2O делятся на три
класса: карбонатные,
сульфатные и хлоридные;
классификация
Вернадского,
которая включает в себя деление вод на
классы, царства, подцарства, семейства
и виды (считается наиболее сложной,
поскольку включает до 1500 видов); и др.
Классификация
природных вод по величине жесткости (С
солей, моль/м3): очень
мягкая:менее
1,5(дожд. H2O, грунтовые H2O Карелии);
мягкая:1,5-3;
средней
жесткости:3-5,4;
жесткая:5,4-10,7;
очень
жесткая:
более 10,7(грунтовые H2O донбасса, 18-20
моль/м3).
Важнейшие
хим. эл-ты в природных H2Oх.
N
и его соед. в природных H2Oх. В
природных H2O N находится в виде ряда
неорган. и разнообр. орг. соед.. К неорг.
формам относятся аммоний, нитриты и
нитраты-все хорошо р-римые. Орг.
соед.-белковоподобные соед., полипептиды,
гумусовые в-в.а, АК, амины, мочевина-присутствуют
в H2O во взвешенном сост., в виде коллоидных
и истинных р-ров. Между неорг.ми и орг.ми
соед. азота постоянно осуществляются
взаимные переходы. Повышение содержания
нитратов и нитритов в H2O свидетельствует
о загрязнении H2O. В чистых H2Oх нитрит-ионы
аналитически не обнаруживаются.
Р
и его соед. в прир. H2Oх.
Р
встречается
в природных H2Oх в форме орг.х и неорг.х
соедин, мигрируя в виде истинных
коллоидных р-ров и во взвешенном сост.
Неорг.й Р
представлен соед.ми Н3РО4.
Орг. соед. Р представлены нуклеиновыми
кисл., нуклеопротеидами, фосфорилированными
сахарами, фосфолипидами.
Si
и его соед. в прир. H2Oх.
Si-один
из наиболее распространенных элементов.
Формы соед. в природных H2Oх довольно
многообразны и зависят от минерализации,
состава H2O и рН среды. Часть Si
находится в истинно р-ренном сост. в
виде кремниевой и поликремниевых ки-т.
Содержание Si
уменьшается в природных H2Oх при потреблении
его водными организмами, при переходе
кремниевой кислоты при определенных
условиях в гель, при сорбции и дегидратации.
Fe
и его соед. в природных H2Oх.
Fe-непременный
компонент поверхностных вод. Соед.
трехвалентного Fe
наиб. распространены, двухвалентное Fe
обнаруживается в H2Oх с низкими
окислительными потенциалами. Кроме
р-ренного ионного железа (Fе2+,
Fе3+),
в природных H2Oх присутствуют
гидроксокомплексы, коллоидные неорг.
и орг. формы.
Значительная часть Fe
мигрирует в поверхностных H2Oх в форме
взвешенных частиц. В природных H2Oх многие
соед. Fe
малоуст., т.к. подвергаются гидролизу с
последующим осаждением гидроксидов.
Формы
миграции железа в почвенно-грунтовых
H2Oх меняются посезонно:
в период весеннего половодья при большом
кол-ве взвешенного материала преобладают
взвешенные формы, в межень большую роль
в переносе железа играет органическое
в-во. Наиб. важные источники поступления
хим., в том числе биогенных элементов в
природные H2O разделяют на группы: внешние
и внутренние. Внешние
источники обеспеч.
поступление в-в. в водоемы с речным
стоком, атм. осадками, промышленными,
хоз.-бытовыми и сельскохоз. сточными
H2Oми.
Орг.
в-ва в природных H2Oх.
Орг.
в-ва -
орг. ки-ты, фенолы, гумусовые в-в, N-содерж.
соед., углеH2O и т. д., накапливающиеся за
счет внутриводоемных процессов
(автохтонные). Природные
H2O содержат орг.
в-в.а в сравнительно невысоких Сх. В
морских и океанических H2Oх содержание
конц. еще более низкое. К
числу аллохтонных
(поступ.
извне) относятся орг. кис-ы, эфиры, углеH2,
гумусовые в-ва. Содержание
углеводов выше и достигает единиц
миллиграммов в 1 л. Значительную часть
орган. в-ва природных вод сост. гумусовые
в-ва: гуминовые ки-ты и фульвоки-ты.
Особенно богаты гуминовыми в-вами H2O
северных районов страны, где конц. их
часто сост. 1-10 миллиграммов на 1 л. В
морских и океанических H2Oх среднее
содержание гумусовых в-в. ниже и редко
превышает 3 мг/л. По
происхождению орг. в-в.а природных вод
делят на: 1.продукты
биохим. распада остатков организмов,
населяющих водоем-это
в-ва автохтонного происхождения; 2.орг.
в-ва, поступ. в водоемы извне с речным
стоком, атм. осадками, промышленными,
хозяйственно-быт. и с/х сточными H2Oми.
Особое место в этой группе занимают
гумусовые в-ва почв, торфяников, лесных
подстилок. Орг.
в-в.а природных вод могут находиться в
сост. истинных р-ров, коллоидов и
взвешенных грубых частиц. Коллоидная
форма миграции наиб. Хар-на для природных
вод зоны гипергенеза, богатых высокомолекул.
гумусовыми в-вами. Но часть окрашенных
орг. соед.-фульвоки-ты и некоторые формы
гуминовых ки-т-могут быть в сост. истинных
р-ров.
Для
природных вод хар.на миграция органического
в-в.а в виде взвесей.
Особое место среди этих явлений занимает
комплексообразование,
что имеет положительное биологическое
значение, инактивируя избыточные кол-ва
ионов тяжелых Ме; благоприятствует
р-рению труднодоступных, но биологич.
важ. эл-тов.
Основные
факторы, влияющие на состав природных
вод:
*Прямыми
назыв.
факторы, кот. оказывают непосредственное
влияние на хим. состав H2O и связаны с
хим. составом минералов, горных пород
и почв, контактирующих с данной природной
H2O; *Косвенные
факторы-t,
р, влажность, осадки и др; *Главные
факторы определяют содерж. главных
анионов и катионов; *Второстепенные
факторы вызывают
появление некоторых особенностей данной
H2O (цвета, запаха), но не влияют на ее
класс и тип. По
хар-у воздействия на формирование
состава природных вод факторы делят
на:
*физико-географ.
(рельеф, климат и т. д.); *геолог.
(вид горных пород, гидрогеологические
условия и т. п.); *биолог.
(деятельность живых организмов);
*антропогенные
(состав сточных вод, состав тв отходов);
*физико-хим.
(хим. св-ва соед., кислотноосновные и
окисл.-восстанов. условия). Процессы
р-рения газов в природных H2Oх.
Кол-во
газа, которое р-рено в жидкости,
пропорционально парциальному р этого
газа - закон Генри, может быть записано
математически следующим образом: Сi=KГPi
,
Ci-
С i-й
примеси в р-ре, моль/л, Kг-константа
Генри для данной t
р-ра, моль/(лПа) или моль/(л атм),
Pi-парциальное
р i-ой
примеси в газовой фазе, находящейся в
равновесии с р-ром, Па или атм.
При
t
р-ров р-рим в них газов понижается.
Вследствие снижения р-рим. газов при t
происходит уменьш. содержания О2 в
верхнем слое H2O рек и озер в жаркие дни.
Р-рения
тв. в-в. в природных H2Oх.
Показатель
агрессивности природных
вод хар-изует способность данной H2O
перевести тв в-во в р-р. А=lg{K(ПАпрод/ПАреаг)-1}.
А-показатель
агрессивности H2O; К-константа равновесия
данного в-ва; ПАпрод иПАреаг-произведение
активностей продуктов р-ии, содержащихся
в данной H2O, и реагентов, содержащихся
в р-ряемом в-ве. Чем
больше А, тем в большей степени система
неравновесна и более интенсивно протекает
процесс р-рения данного в-ва.
Показатель
неустойчивости I хар-изует степень
удаленности системы от состояния
равновесия. Чем
больше значение показателя неустойчивости,
тем в-во менее уст.:I
= –A.
Показатель
неустойчивости по
численному значению = показателю
агрессивности с обратным знаком.
Показатели
качества природных вод. Факторы,
опред. качество H2O: 1.БПК
2.запахи
(привкусы) 3.окраска
4.р-ренный
О2 5.токсичные
в-ва 6.микробы
и др. возбудители болезней 7.минеральный
состав 8.рН
9.t
10.взвешенные
частицы. Показатели
качества природных вод могут быть
определены при помощи простых хим.
методов:
1.Содержание
взвешенных в-в 2.Содержание
частиц коллоидной степени дисперсности
3.Щелочность-
обусловливается присутствием ОН–,СО23−
; НСО3−
4.
Кислотность 5.
Жесткость-содержание
в H2O солей Ca
и Mg-мг-экв/л.
6.Мутность
и цветность. 7.Хим.
показатели опред. как конц. элементов
-мг-экв/л или мг/л.. 8.Хим.
потребление О2а (ХПК) определяет общее
содержание орг. в-в. в сточной H2O, хар-изует
хим. окисление орг.х и неорг.х в-в. под
действием окислителей. 9.БПК-
определ. кол-вом ок-теля (в пересчете на
О2), пошедшего на окисление биоразлагаемых
орг. в-в., содерж. в единице V пробы -мг
О2/л
Гидрологический
цикл.
Круговорот H2O в прир. (гидрологический
цикл)-процесс
цикл. перемещ. H2O в
земной биосф. Состоит из испарения H2O,
переноса паров воздушными течениями,
их конденсации,
выпад. в виде осадков (дождь, снег) и
переноса H2O реками и другими водоёмами.
H2O испаряется с поверхности суши и
водоёмов (рек, озёр, водохранилищ), но
большая часть H2O испаряется с
поверхности Мирового
океана.
Круговорот
H2O связывает воедино все части гидросферы.
Моря
теряют из-за испарения больше H2O, чем
получают с осадками, на суше-положение
обратное.
Первые
3 реакции-основные, происходят на высотах
выше 120– 140 км, последняя -на малых высотах
от 85 до 120 км. Рекомбинация-гибель
свободных электронов и других заряженных
частиц в результате столкновений.
Скорость рекомбинации с высотой
уменьшается. Скорость реакций превращения
ионов зависит от конц. ионов и температуры.
Диффузионные
процессы. Этот
процесс конкурирует с процессами
образования ионов и их рекомбинации и
зависит от магнитного поля. Заряженные
частицы беспрепятственно движутся
вдоль магнитных силовых линий, тогда
как перемещение поперек магнитного
поля затруднено. Если рассматривать
процессы в вертикальном столбе ионосферы,
то на экваторе, где силовые линии
магнитного поля направлены горизонтально,
роль диффузии мала. В высоких широтах,
где силовые линии геомагнитного поля
почти вертикальны, амбиполярная диффузия
в вертикальном направлении протекает
эффективно. Гидросфера.
Физико-хим.
процессы
в гидросфере.
H2O
как хим. соединение.
Существует
150
изотопных разновидностей
H2O, образован. котор. обусловл. комбинациями
изотопов H2
и стабильных изотопов O2
и 200 разновидностей льда. Наиболее
известными яв обычная H2O
и тяжелая H2O;
последняя образована тяжелым изотопом
H2
(дейтерием) и легким изотопом O.
Жидкая
H2O
имеет квазикристаллическую
структуру и
отличается выс. ближним порядком в
размещении частиц,
образующих непрерывно меняющ. кластерные
(групповые) скопления молекул, наход. в
постоянном движ.
Общим
для жидкой H2O
и льда яв. тетраэдрическое распределение
зарядов в молекуле Н2О,
определяющимся Н-связями. Состав
и классиф. природ. вод.
H2O
в своих 3 сост.-ж,
лед
и водяные пары-широко
распростр. на поверхности Земли и
занимает V 1,4 млрд км3. Почти вся эта H2O
(более
97 %) находится
в океанах, бóльшая часть из оставшейся
образует полярные ледяные шапки и
ледники (около
2 %). Континентальные
пресные H2O,
в основном это подземные
H2O (глубинные,
поверхностные;
озера;
почвенная
влага;
реки;
биосфера).
Атм. содержит сравнительно мало H2O (в
виде паров)-0,001 %.
В
р-ренном сост. в хим. составе пресной
H2O преобладают 4 Ме, присутствующие в
виде простых катионов: Са2+,
Na+,
К+
и Мg2+.Ионные
соед. хорошо р-римы в полярных р-рителях
типа H2O.
Находясь в р-ре, различные ионы вступают
в р-ии с H2O
по-разному. Ионы с низким зарядом обычно
р-ряются в виде простых катионов или
анионов. Такие ионы слабо взаимод. с
H2O. Ионы
меньшего размера с более высоким зарядом
вступают в р-ии с H2O,
притягивая ОН–,
и образуют незаряженные и нер-римые
гидроксиды, высвобождая в ходе р-ии ионы
водорода: Fe3+
+3H2O=Fe(OH)3
+ 3H+.
Некоторые
высокозаряженные ионы образуют большие
и устойчивые анионы типа оксианионов.
Ряд оксианионов
присутствуют в H2Oх виде слабых кислот,
и их поведение зависит от рН р-ров.
Классификация
природных вод по значению минерализации:
ультрапресные:менее
0,2; пресные:
0,2-0,5; с
повышенной минерализацией:0,5-1,0;
солоноватые:1-3;
соленые:3-10;
очень
соленые:10-35;
переходные
к рассолам:35-50;
рассолы:50-400.
Классификация
по жесткости.
Жесткостью
H2O называется
свойство H2O, обусловленное содержанием
в ней ионов кальция и магния.
Единицей жесткости H2O явл. моль жесткости
(моль/м3).
Некоторые способы классификации вод:
классификация
Алекина,
согласно которой все H2O делятся на три
класса: карбонатные,
сульфатные и хлоридные;
классификация
Вернадского,
которая включает в себя деление вод на
классы, царства, подцарства, семейства
и виды (считается наиболее сложной,
поскольку включает до 1500 видов); и др.
Классификация
природных вод по величине жесткости (С
солей, моль/м3): очень
мягкая:менее
1,5(дожд. H2O, грунтовые H2O Карелии);
мягкая:1,5-3;
средней
жесткости:3-5,4;
жесткая:5,4-10,7;
очень
жесткая:
более 10,7(грунтовые H2O донбасса, 18-20
моль/м3).
Важнейшие
хим. эл-ты в природных H2Oх.
N
и его соед. в природных H2Oх. В
природных H2O N находится в виде ряда
неорган. и разнообр. орг. соед.. К неорг.
формам относятся аммоний, нитриты и
нитраты-все хорошо р-римые. Орг.
соед.-белковоподобные соед., полипептиды,
гумусовые в-в.а, АК, амины, мочевина-присутствуют
в H2O во взвешенном сост., в виде коллоидных
и истинных р-ров. Между неорг.ми и орг.ми
соед. азота постоянно осуществляются
взаимные переходы. Повышение содержания
нитратов и нитритов в H2O свидетельствует
о загрязнении H2O. В чистых H2Oх нитрит-ионы
аналитически не обнаруживаются.
Р
и его соед. в прир. H2Oх.
Р
встречается
в природных H2Oх в форме орг.х и неорг.х
соедин, мигрируя в виде истинных
коллоидных р-ров и во взвешенном сост.
Неорг.й Р
представлен соед.ми Н3РО4.
Орг. соед. Р представлены нуклеиновыми
кисл., нуклеопротеидами, фосфорилированными
сахарами, фосфолипидами.
Si
и его соед. в прир. H2Oх.
Si-один
из наиболее распространенных элементов.
Формы соед. в природных H2Oх довольно
многообразны и зависят от минерализации,
состава H2O и рН среды. Часть Si
находится в истинно р-ренном сост. в
виде кремниевой и поликремниевых ки-т.
Содержание Si
уменьшается в природных H2Oх при потреблении
его водными организмами, при переходе
кремниевой кислоты при определенных
условиях в гель, при сорбции и дегидратации.
Fe
и его соед. в природных H2Oх.
Fe-непременный
компонент поверхностных вод. Соед.
трехвалентного Fe
наиб. распространены, двухвалентное Fe
обнаруживается в H2Oх с низкими
окислительными потенциалами. Кроме
р-ренного ионного железа (Fе2+,
Fе3+),
в природных H2Oх присутствуют
гидроксокомплексы, коллоидные неорг.
и орг. формы.
Значительная часть Fe
мигрирует в поверхностных H2Oх в форме
взвешенных частиц. В природных H2Oх многие
соед. Fe
малоуст., т.к. подвергаются гидролизу с
последующим осаждением гидроксидов.
Формы
миграции железа в почвенно-грунтовых
H2Oх меняются посезонно:
в период весеннего половодья при большом
кол-ве взвешенного материала преобладают
взвешенные формы, в межень большую роль
в переносе железа играет органическое
в-во. Наиб. важные источники поступления
хим., в том числе биогенных элементов в
природные H2O разделяют на группы: внешние
и внутренние. Внешние
источники обеспеч.
поступление в-в. в водоемы с речным
стоком, атм. осадками, промышленными,
хоз.-бытовыми и сельскохоз. сточными
H2Oми.
Орг.
в-ва в природных H2Oх.
Орг.
в-ва -
орг. ки-ты, фенолы, гумусовые в-в, N-содерж.
соед., углеH2O и т. д., накапливающиеся за
счет внутриводоемных процессов
(автохтонные). Природные
H2O содержат орг.
в-в.а в сравнительно невысоких Сх. В
морских и океанических H2Oх содержание
конц. еще более низкое. К
числу аллохтонных
(поступ.
извне) относятся орг. кис-ы, эфиры, углеH2,
гумусовые в-ва. Содержание
углеводов выше и достигает единиц
миллиграммов в 1 л. Значительную часть
орган. в-ва природных вод сост. гумусовые
в-ва: гуминовые ки-ты и фульвоки-ты.
Особенно богаты гуминовыми в-вами H2O
северных районов страны, где конц. их
часто сост. 1-10 миллиграммов на 1 л. В
морских и океанических H2Oх среднее
содержание гумусовых в-в. ниже и редко
превышает 3 мг/л. По
происхождению орг. в-в.а природных вод
делят на: 1.продукты
биохим. распада остатков организмов,
населяющих водоем-это
в-ва автохтонного происхождения; 2.орг.
в-ва, поступ. в водоемы извне с речным
стоком, атм. осадками, промышленными,
хозяйственно-быт. и с/х сточными H2Oми.
Особое место в этой группе занимают
гумусовые в-ва почв, торфяников, лесных
подстилок. Орг.
в-в.а природных вод могут находиться в
сост. истинных р-ров, коллоидов и
взвешенных грубых частиц. Коллоидная
форма миграции наиб. Хар-на для природных
вод зоны гипергенеза, богатых высокомолекул.
гумусовыми в-вами. Но часть окрашенных
орг. соед.-фульвоки-ты и некоторые формы
гуминовых ки-т-могут быть в сост. истинных
р-ров.
Для
природных вод хар.на миграция органического
в-в.а в виде взвесей.
Особое место среди этих явлений занимает
комплексообразование,
что имеет положительное биологическое
значение, инактивируя избыточные кол-ва
ионов тяжелых Ме; благоприятствует
р-рению труднодоступных, но биологич.
важ. эл-тов.
Основные
факторы, влияющие на состав природных
вод:
*Прямыми
назыв.
факторы, кот. оказывают непосредственное
влияние на хим. состав H2O и связаны с
хим. составом минералов, горных пород
и почв, контактирующих с данной природной
H2O; *Косвенные
факторы-t,
р, влажность, осадки и др; *Главные
факторы определяют содерж. главных
анионов и катионов; *Второстепенные
факторы вызывают
появление некоторых особенностей данной
H2O (цвета, запаха), но не влияют на ее
класс и тип. По
хар-у воздействия на формирование
состава природных вод факторы делят
на:
*физико-географ.
(рельеф, климат и т. д.); *геолог.
(вид горных пород, гидрогеологические
условия и т. п.); *биолог.
(деятельность живых организмов);
*антропогенные
(состав сточных вод, состав тв отходов);
*физико-хим.
(хим. св-ва соед., кислотноосновные и
окисл.-восстанов. условия). Процессы
р-рения газов в природных H2Oх.
Кол-во
газа, которое р-рено в жидкости,
пропорционально парциальному р этого
газа - закон Генри, может быть записано
математически следующим образом: Сi=KГPi
,
Ci-
С i-й
примеси в р-ре, моль/л, Kг-константа
Генри для данной t
р-ра, моль/(лПа) или моль/(л атм),
Pi-парциальное
р i-ой
примеси в газовой фазе, находящейся в
равновесии с р-ром, Па или атм.
При
t
р-ров р-рим в них газов понижается.
Вследствие снижения р-рим. газов при t
происходит уменьш. содержания О2 в
верхнем слое H2O рек и озер в жаркие дни.
Р-рения
тв. в-в. в природных H2Oх.
Показатель
агрессивности природных
вод хар-изует способность данной H2O
перевести тв в-во в р-р. А=lg{K(ПАпрод/ПАреаг)-1}.
А-показатель
агрессивности H2O; К-константа равновесия
данного в-ва; ПАпрод иПАреаг-произведение
активностей продуктов р-ии, содержащихся
в данной H2O, и реагентов, содержащихся
в р-ряемом в-ве. Чем
больше А, тем в большей степени система
неравновесна и более интенсивно протекает
процесс р-рения данного в-ва.
Показатель
неустойчивости I хар-изует степень
удаленности системы от состояния
равновесия. Чем
больше значение показателя неустойчивости,
тем в-во менее уст.:I
= –A.
Показатель
неустойчивости по
численному значению = показателю
агрессивности с обратным знаком.
Показатели
качества природных вод. Факторы,
опред. качество H2O: 1.БПК
2.запахи
(привкусы) 3.окраска
4.р-ренный
О2 5.токсичные
в-ва 6.микробы
и др. возбудители болезней 7.минеральный
состав 8.рН
9.t
10.взвешенные
частицы. Показатели
качества природных вод могут быть
определены при помощи простых хим.
методов:
1.Содержание
взвешенных в-в 2.Содержание
частиц коллоидной степени дисперсности
3.Щелочность-
обусловливается присутствием ОН–,СО23−
; НСО3−
4.
Кислотность 5.
Жесткость-содержание
в H2O солей Ca
и Mg-мг-экв/л.
6.Мутность
и цветность. 7.Хим.
показатели опред. как конц. элементов
-мг-экв/л или мг/л.. 8.Хим.
потребление О2а (ХПК) определяет общее
содержание орг. в-в. в сточной H2O, хар-изует
хим. окисление орг.х и неорг.х в-в. под
действием окислителей. 9.БПК-
определ. кол-вом ок-теля (в пересчете на
О2), пошедшего на окисление биоразлагаемых
орг. в-в., содерж. в единице V пробы -мг
О2/л
Гидрологический
цикл.
Круговорот H2O в прир. (гидрологический
цикл)-процесс
цикл. перемещ. H2O в
земной биосф. Состоит из испарения H2O,
переноса паров воздушными течениями,
их конденсации,
выпад. в виде осадков (дождь, снег) и
переноса H2O реками и другими водоёмами.
H2O испаряется с поверхности суши и
водоёмов (рек, озёр, водохранилищ), но
большая часть H2O испаряется с
поверхности Мирового
океана.
Круговорот
H2O связывает воедино все части гидросферы.
Моря
теряют из-за испарения больше H2O, чем
получают с осадками, на суше-положение
обратное.
 84 %
общего испарения происходит с поверхности
океанов, а над океанами выпадает
74 %
общего кол-ва осадков. H2O непрерыв.
циркул. на земном шаре, но её общее кол-во
остаётся неизменным. 3/4 поверхности
земли покрыты H2O. Водная оболочка
Земли - гидросфера.
Большую её часть сост. соленая H2O морей
и океанов, а меньшую-пресная
H2O озер, рек, ледников, грунтовые
H2O и водяной
пар.
В круговороте задействовано менее 1 %
всей H2O, а большая часть остальной сохран.
в виде льдов и снега. Гидрологический
цикл:рис1,2
Слева-круговорот
над океаном; справа-круговорот над
сушей; между ними-круговорот между
океаном и сушей(2). Р0,
Е0,
R0-осадки,
испарение и вынос влаги с океана на
сушу; Рк,
Ек, Rк-осадки,
испарение и сток на суше. Стрелки,
оконтуренные штриховой линией, показывают
потенциально возможную величину испар.
на суше, покрытой растительностью,
ЕД-м2.
Постоянный обмен влагой между гидросф.,
атм. и земн. поверх., состоящий из процессов
испарения, передвижения водяного пара
в атм., его конденсации в атм., выпадения
осадков и стока, получил
название круговорота H2O в природе. Атм.
осадки частично испаряются, образуют
временные и постоянные водоемы, просач
в землю и образ. подземные H2O.Круговорот
H2O происходит под влиянием солнечной
радиации и сил тяжести.
Солнце t
воду в океанах и морях, и она испаряется,
преобразуясь в водяной пар. Параллельный
процесс происходит и на суше: H2O испаряется
с нагретой Солнцем поверхности Земли
или испаряется растениями в
результ. транспирации.
В процессе адвекции водяной
пар перемещ. с воздушными массами, пока
не оказывается в зоне с низкой t.
Это
вызывает конденсацию влаги
в облаках. Облака
продолжают перемещаться вместе с
воздухом, в то время как сконденсированные
капельки H2O в них перемешиваются,
слипаются и растут в размерах. В итоге
H2O выпадает в виде осадков над сушей или
океаном; при этом океан испаряет больше
влаги в атм., чем приобретает от осадков,
а суша-наоборот.Некоторые осадки выпадают
в виде снега или града, дождя со снегом,
и могут накапливаться в ледяных шапках
и ледниках, кот. хранят заморож. воду до
десятков тысяч лет. Но даже в таком виде
незначительный обмен льдов с атм.
сохран.: действует сублимация.
В то время, когда t в зоне отложений
повышается, начинается таяние, и H2O
активно исходит из этих источников.
Большая часть H2O в виде дождя. Часть
выпавших осадков перехватывается
листвой растений, не достигнув почвы.
Попав на сушу, H2O перетекает по земле в
виде рек, двигаясь к океанам. Часть этой
H2O впитывается в грунт в р-те инфильтрации,
проникает глубоко в землю и пополняет
водоносные горизонты грунтовых вод,
кот. также аккумулируют в себе пресную
воду в течение длит. врем. Под землёй,
тоже сущ. движение водяных масс, и H2O
движется, меняя своё местоположение.
Грунтов. H2O обмениваются H2O с поверхностью
в виде родников и артезианских скважин.
Эта, и часть впитавшейся в землю, но не
достигшей уровня водоносных горизонтов
H2O, попадает назад в поверхностные водные
объекты и океан. Доля
H2O отводится из почвы растениями.
Со временем H2O возвращается в океан,
чтобы продолжить круговорот. Различают
два вида круговоротов H2O в природе:1.Большой
круговорот-водяной
пар, образовав. над поверхностью океана,
сконденсируется и выпадает в виде
осадков снова в океан и распределяется
по 3 основ. направлениям: на поверхностный
сток; просачивается в грунт (подземный
сток), а 3 часть испаряется в атм.;
2.Малый
(океанический) круговорот-H2O,
кот. испарилась над поверхностью суши
или океана, опять выпадает на сушу в
виде атм. осадков.
Кроме
того, различают местный, или
внутриматериковый, круговорот, при кот.
испарившаяся с поверхности суши H2O
выпадает на сушу в виде атм. осадков.
Для замкнутых межгорных котловин
характерен внутренний круговорот влаги.
После осадки в процессе движения опять
достигают Мирового океана.
Скорость
переноса различных видов H2O, периоды
расходов и периоды обновления измен. в
широких пределах. Атм. влага, кот.
образуется при испарении H2O из океанов,
морей и суши, и сущ. в виде облаков,
обновляется в среднем через 8 дней.
Полное обновление вод Мирового океана
происходит примерно раз в 2 700 лет.
Антропогенное
воздействие на гидрологический цикл:
рис
3.
В
пределах крупных городов изменены все
элементы окр. ср. В связи с тем, что
антропогенный обмен сост. сущ. часть
биосферного круговор. в-в., то своей
разомкнутостью он нарушает необходимую
высокую степень замкнутости глобального
биотического круговор., выработанную
в длит. эволюции и явл. важнейшим услов.
стационарного состояния биосферы. Так,
кол-во осадков в промышленных регионах
увелич. Причиной
этого служит обилие
мельчайших частиц минеральных в-в.,
ускоряющих конденсацию водяных паров.
Орг.
загрязнители гидросферы.
Орг.
соед. прир. происхожд. за искл лигнина
быстро разруш. микроорганизмами. Иначе
ведут многочисленные синтетические
орг. соед.. Для их разрушения микроорганизмам
не хватает многих специфич. ферментов.
Поэтому для устранения некоторых орг.
соед. необходим дифференцированный
подход.
Загрязняющие
гидросферу орг. в-ва можно разделить
на: 1.В-ва,
разрушаемые микроорганизмами, и
изменяющие состояние H2O.
2.Устойчивые
или трудноразрушаемые в-ва.3.
ПАВ. В-ва,
разрушаемые микроорганизмами, изменяющие
состояние H2O. Необходимым
условием микробиолог. очистки H2O
явл. определен. содержание в ней О2. При
его достаточном кол-ве проявл. активность
аэробных микроорганизмов, кот. питаются
орг-ми в-вами. Конечными продуктами их
метаболизма явл. CO2
и Н2О.
Также в р-те целого ряда хим. процессов
образ. нитраты, фосфаты, сульфаты и
О2содержащие соед. др. элементов, кот.
присутствовали в исх. в-вах. Нитраты и
фосфаты в естественных водоемах
содержатся в очень малых кол-вах.
Выделенные же нитраты и фосфаты
стимулируют рост водорослей и высших
растений, что способствует усиленному
росту зоопланктона и размножению высшей
фауны, кот. употребляют О2 для дыхания.
С ростом числа живых организмов в H2O
увеличивается и кол-во отмирающих орг.
остатков, для аэробного разрушения кот.
также необходим О2. При этом резко
возрастает расход О2, и растения уже не
могут восполнять его за счет фотосинтеза.
Р-рение О2 воздуха не идет достаточно
быстро. Если орг. остатки не будут вскоре
переработаны, H2O на длительное время
останется без О2, необходимого для
жизнедеятельности флоры и фауны, вплоть
до того, что аэробные микроорганизмы
уже не смогут более сущ. Их массовая
гибель сопровождается массовым
размножением анаэробных микроорганизмов,
кот. разрушают всю биомассу путем
брожения. Этот переход от аэробного к
анаэробному состоянию H2O назыв.
опрокидыванием.
После
анаэробного распада в р-те целого ряда
взаимосвязанных процессов брожения
образуются СН4, СО2, NH3 и H2S. Распавшиеся
в анаэробных процессах орг. в-ва так
изменяют состояние H2O, что становится
невозможным в обозримое время ее
возвращение к аэробному состоянию, если
не предпринимать искусственные меры.
Постоянно выделяющиеся NН3 и H2S сильно
отравляют H2O. Устойчивые
в-в.а в H2O.
Нефть
в
основном состоит из алифатических
углеводородов, в некоторых случаях
может содержать алициклические и
ароматические углеводороды. В небольших
кол-вах в состав нефти могут входить
также О2содержащие соед., как альдегиды,
кетоны и карбоновые ки-ты. Нефть
может
попадать в окр. среду различными путями:
при бурении скважин на нефтяных
месторождениях, при авариях танкеров
или течи в нефтепроH2Oх, при транспортировке,
при переработке сырой нефти, а также
при очистке отстойников, танкеров и
автоцистерн от старой нефти и НФ. Особо
сильные загрязнения в р-те утечки нефти
происходят при бурении морских скважин
и авариях танкеров. При просачивании
нефти в почву она проникает в грунтовые
H2O, перемещается в направлении их движения
и может распространяться на большие
расстояния. Гидрофобная нефть образует
тонкую пленку на поверхности H2O. H2O
становится непригодной для исп. при
попадании 1 л нефти в 106 л H2O. На открытых
водных поверхностях с течением времени
образуется эмульсионный слой нефть-H2O,
кот. частично препятствует газообмену
между H2O и воздухом. Этот эффект приводит
к постепенному задыханию, живых
организмов, находящиеся под пленкой. В
этих условиях при дыхании в клетках
накапливается CO2,
что ведет к ацидозу, т.е. подкислению
клеточной жидкости.
Фенолы
исп.
для дезинфекции, а также изготовления
клеев и фенолформальдегидных пластмасс.
Кроме того, они входят в состав выхлопных
газов бензиновых и дизельных двигателей,
образуются при сгорании и коксовании
дерева и угля. Скорость распада фенолов
в H2O зависит как от их хим. строения, так
и от окружающих условий. Особую роль
при этом играют ультрафиолетовое
излучение, микроорганизмы и конц. О2 в
H2O. Простые фенолы
в аэробных условиях под действием
соответствующих бактерий, полностью
распадаются в течение 7 дней на 96-97% от
исх. кол-ва. В анаэробных условиях распад
идет медленнее. Столь малые конц. все
же влияют на вкус H2O и мяса рыбы. В сильно
хлорированной H2O образ. хлорфенолы, кот.
ухудшают вкус H2O еще в большей степени,
чем негалогенизированные фенолы.
Нормативы для питьевой H2O устанавливают
ПДК фенолов=0,5
мкг/л.
К устойчивым вредным примесям
в H2O относится и так называемая
лигнинсульфоновая
ки-та.
Этот продукт образуется при обработке
древесины гидросульфитом кальция при
повышенных t
и p.
В р-те этой р-ии высокомолекулярный
лигнин переходит в р-римую в H2O форму и
может быть отделен от целлюлозы. Еще из
древесины выделяют гемицеллюлозу и
сахар. При изготовлении 1 т целлюлозы
84 %
общего испарения происходит с поверхности
океанов, а над океанами выпадает
74 %
общего кол-ва осадков. H2O непрерыв.
циркул. на земном шаре, но её общее кол-во
остаётся неизменным. 3/4 поверхности
земли покрыты H2O. Водная оболочка
Земли - гидросфера.
Большую её часть сост. соленая H2O морей
и океанов, а меньшую-пресная
H2O озер, рек, ледников, грунтовые
H2O и водяной
пар.
В круговороте задействовано менее 1 %
всей H2O, а большая часть остальной сохран.
в виде льдов и снега. Гидрологический
цикл:рис1,2
Слева-круговорот
над океаном; справа-круговорот над
сушей; между ними-круговорот между
океаном и сушей(2). Р0,
Е0,
R0-осадки,
испарение и вынос влаги с океана на
сушу; Рк,
Ек, Rк-осадки,
испарение и сток на суше. Стрелки,
оконтуренные штриховой линией, показывают
потенциально возможную величину испар.
на суше, покрытой растительностью,
ЕД-м2.
Постоянный обмен влагой между гидросф.,
атм. и земн. поверх., состоящий из процессов
испарения, передвижения водяного пара
в атм., его конденсации в атм., выпадения
осадков и стока, получил
название круговорота H2O в природе. Атм.
осадки частично испаряются, образуют
временные и постоянные водоемы, просач
в землю и образ. подземные H2O.Круговорот
H2O происходит под влиянием солнечной
радиации и сил тяжести.
Солнце t
воду в океанах и морях, и она испаряется,
преобразуясь в водяной пар. Параллельный
процесс происходит и на суше: H2O испаряется
с нагретой Солнцем поверхности Земли
или испаряется растениями в
результ. транспирации.
В процессе адвекции водяной
пар перемещ. с воздушными массами, пока
не оказывается в зоне с низкой t.
Это
вызывает конденсацию влаги
в облаках. Облака
продолжают перемещаться вместе с
воздухом, в то время как сконденсированные
капельки H2O в них перемешиваются,
слипаются и растут в размерах. В итоге
H2O выпадает в виде осадков над сушей или
океаном; при этом океан испаряет больше
влаги в атм., чем приобретает от осадков,
а суша-наоборот.Некоторые осадки выпадают
в виде снега или града, дождя со снегом,
и могут накапливаться в ледяных шапках
и ледниках, кот. хранят заморож. воду до
десятков тысяч лет. Но даже в таком виде
незначительный обмен льдов с атм.
сохран.: действует сублимация.
В то время, когда t в зоне отложений
повышается, начинается таяние, и H2O
активно исходит из этих источников.
Большая часть H2O в виде дождя. Часть
выпавших осадков перехватывается
листвой растений, не достигнув почвы.
Попав на сушу, H2O перетекает по земле в
виде рек, двигаясь к океанам. Часть этой
H2O впитывается в грунт в р-те инфильтрации,
проникает глубоко в землю и пополняет
водоносные горизонты грунтовых вод,
кот. также аккумулируют в себе пресную
воду в течение длит. врем. Под землёй,
тоже сущ. движение водяных масс, и H2O
движется, меняя своё местоположение.
Грунтов. H2O обмениваются H2O с поверхностью
в виде родников и артезианских скважин.
Эта, и часть впитавшейся в землю, но не
достигшей уровня водоносных горизонтов
H2O, попадает назад в поверхностные водные
объекты и океан. Доля
H2O отводится из почвы растениями.
Со временем H2O возвращается в океан,
чтобы продолжить круговорот. Различают
два вида круговоротов H2O в природе:1.Большой
круговорот-водяной
пар, образовав. над поверхностью океана,
сконденсируется и выпадает в виде
осадков снова в океан и распределяется
по 3 основ. направлениям: на поверхностный
сток; просачивается в грунт (подземный
сток), а 3 часть испаряется в атм.;
2.Малый
(океанический) круговорот-H2O,
кот. испарилась над поверхностью суши
или океана, опять выпадает на сушу в
виде атм. осадков.
Кроме
того, различают местный, или
внутриматериковый, круговорот, при кот.
испарившаяся с поверхности суши H2O
выпадает на сушу в виде атм. осадков.
Для замкнутых межгорных котловин
характерен внутренний круговорот влаги.
После осадки в процессе движения опять
достигают Мирового океана.
Скорость
переноса различных видов H2O, периоды
расходов и периоды обновления измен. в
широких пределах. Атм. влага, кот.
образуется при испарении H2O из океанов,
морей и суши, и сущ. в виде облаков,
обновляется в среднем через 8 дней.
Полное обновление вод Мирового океана
происходит примерно раз в 2 700 лет.
Антропогенное
воздействие на гидрологический цикл:
рис
3.
В
пределах крупных городов изменены все
элементы окр. ср. В связи с тем, что
антропогенный обмен сост. сущ. часть
биосферного круговор. в-в., то своей
разомкнутостью он нарушает необходимую
высокую степень замкнутости глобального
биотического круговор., выработанную
в длит. эволюции и явл. важнейшим услов.
стационарного состояния биосферы. Так,
кол-во осадков в промышленных регионах
увелич. Причиной
этого служит обилие
мельчайших частиц минеральных в-в.,
ускоряющих конденсацию водяных паров.
Орг.
загрязнители гидросферы.
Орг.
соед. прир. происхожд. за искл лигнина
быстро разруш. микроорганизмами. Иначе
ведут многочисленные синтетические
орг. соед.. Для их разрушения микроорганизмам
не хватает многих специфич. ферментов.
Поэтому для устранения некоторых орг.
соед. необходим дифференцированный
подход.
Загрязняющие
гидросферу орг. в-ва можно разделить
на: 1.В-ва,
разрушаемые микроорганизмами, и
изменяющие состояние H2O.
2.Устойчивые
или трудноразрушаемые в-ва.3.
ПАВ. В-ва,
разрушаемые микроорганизмами, изменяющие
состояние H2O. Необходимым
условием микробиолог. очистки H2O
явл. определен. содержание в ней О2. При
его достаточном кол-ве проявл. активность
аэробных микроорганизмов, кот. питаются
орг-ми в-вами. Конечными продуктами их
метаболизма явл. CO2
и Н2О.
Также в р-те целого ряда хим. процессов
образ. нитраты, фосфаты, сульфаты и
О2содержащие соед. др. элементов, кот.
присутствовали в исх. в-вах. Нитраты и
фосфаты в естественных водоемах
содержатся в очень малых кол-вах.
Выделенные же нитраты и фосфаты
стимулируют рост водорослей и высших
растений, что способствует усиленному
росту зоопланктона и размножению высшей
фауны, кот. употребляют О2 для дыхания.
С ростом числа живых организмов в H2O
увеличивается и кол-во отмирающих орг.
остатков, для аэробного разрушения кот.
также необходим О2. При этом резко
возрастает расход О2, и растения уже не
могут восполнять его за счет фотосинтеза.
Р-рение О2 воздуха не идет достаточно
быстро. Если орг. остатки не будут вскоре
переработаны, H2O на длительное время
останется без О2, необходимого для
жизнедеятельности флоры и фауны, вплоть
до того, что аэробные микроорганизмы
уже не смогут более сущ. Их массовая
гибель сопровождается массовым
размножением анаэробных микроорганизмов,
кот. разрушают всю биомассу путем
брожения. Этот переход от аэробного к
анаэробному состоянию H2O назыв.
опрокидыванием.
После
анаэробного распада в р-те целого ряда
взаимосвязанных процессов брожения
образуются СН4, СО2, NH3 и H2S. Распавшиеся
в анаэробных процессах орг. в-ва так
изменяют состояние H2O, что становится
невозможным в обозримое время ее
возвращение к аэробному состоянию, если
не предпринимать искусственные меры.
Постоянно выделяющиеся NН3 и H2S сильно
отравляют H2O. Устойчивые
в-в.а в H2O.
Нефть
в
основном состоит из алифатических
углеводородов, в некоторых случаях
может содержать алициклические и
ароматические углеводороды. В небольших
кол-вах в состав нефти могут входить
также О2содержащие соед., как альдегиды,
кетоны и карбоновые ки-ты. Нефть
может
попадать в окр. среду различными путями:
при бурении скважин на нефтяных
месторождениях, при авариях танкеров
или течи в нефтепроH2Oх, при транспортировке,
при переработке сырой нефти, а также
при очистке отстойников, танкеров и
автоцистерн от старой нефти и НФ. Особо
сильные загрязнения в р-те утечки нефти
происходят при бурении морских скважин
и авариях танкеров. При просачивании
нефти в почву она проникает в грунтовые
H2O, перемещается в направлении их движения
и может распространяться на большие
расстояния. Гидрофобная нефть образует
тонкую пленку на поверхности H2O. H2O
становится непригодной для исп. при
попадании 1 л нефти в 106 л H2O. На открытых
водных поверхностях с течением времени
образуется эмульсионный слой нефть-H2O,
кот. частично препятствует газообмену
между H2O и воздухом. Этот эффект приводит
к постепенному задыханию, живых
организмов, находящиеся под пленкой. В
этих условиях при дыхании в клетках
накапливается CO2,
что ведет к ацидозу, т.е. подкислению
клеточной жидкости.
Фенолы
исп.
для дезинфекции, а также изготовления
клеев и фенолформальдегидных пластмасс.
Кроме того, они входят в состав выхлопных
газов бензиновых и дизельных двигателей,
образуются при сгорании и коксовании
дерева и угля. Скорость распада фенолов
в H2O зависит как от их хим. строения, так
и от окружающих условий. Особую роль
при этом играют ультрафиолетовое
излучение, микроорганизмы и конц. О2 в
H2O. Простые фенолы
в аэробных условиях под действием
соответствующих бактерий, полностью
распадаются в течение 7 дней на 96-97% от
исх. кол-ва. В анаэробных условиях распад
идет медленнее. Столь малые конц. все
же влияют на вкус H2O и мяса рыбы. В сильно
хлорированной H2O образ. хлорфенолы, кот.
ухудшают вкус H2O еще в большей степени,
чем негалогенизированные фенолы.
Нормативы для питьевой H2O устанавливают
ПДК фенолов=0,5
мкг/л.
К устойчивым вредным примесям
в H2O относится и так называемая
лигнинсульфоновая
ки-та.
Этот продукт образуется при обработке
древесины гидросульфитом кальция при
повышенных t
и p.
В р-те этой р-ии высокомолекулярный
лигнин переходит в р-римую в H2O форму и
может быть отделен от целлюлозы. Еще из
древесины выделяют гемицеллюлозу и
сахар. При изготовлении 1 т целлюлозы
 такое
же кол-во др. составных частей древесины
идет в отходы, остающиеся в р-ре.
К
числу продуктов, распад которых идет с
трудом, относятся также хлорированные
углеводороды,
как орг.
р-рители с
одним-двумя атомами углерода,
полихлорированные бифенилы и хлорорг.
пестициды. Хлоруглеводороды могут
образоваться уже в самой H2O, когда
хлорированная H2O входит в контакт с
продуктами распада гумуса. Таким образом,
в первую очередь образуется трихлорметан.
ПАВ
в H2O. ПАВ-орг.
соед. (ки-ты, спирты, простые и сложные
эфиры, амины), эффективно понижающие
поверхностное натяжение H2O. Они образ.
тонкие пленки на частицах грязи при
стирке, что способствует самопроизвольному
концентрированию этих частиц в
поверхностном слое р-ра. Использование
ПАВ часто сопровождается пенообразованием.
Возросшая потребность в ПАВ на промышленных
предприятиях, а также их использование
в быту, прежде всего при стирке, привели
к большим скоплениям пены в руслах рек
и в водоемах. Эта пена препятствует
судоходству, а токсичность ПАВ приводит
к массовой гибели рыбы. С хим. точки
зрения ПАВ-орг. в-ва с гидрофильными и
гидрофобными участками различного хим.
строения. К наиболее распространенным
ПАВ относятся алкилсульфоновые
ки-ты.3
У полиоксиэтиленов,
соед. неионного хар.а, гидрофильная
часть молекулы создается за счет
спиртовых групп ОН. Алкиламмониевые
соед. содержат в качестве полярного
компонента +заряженную трет. аммониевую
группу. Они носят название инверсионных
мыл и проявляют бактерицидное действие.
[CH3(CH2)n-C6H4-SO3]P+
Согласно
Водному кодексу РФ запрещается ввод в
эксплуатацию: *любых
объектов, кот. не оборудованы очистными
сооружениями;*сбросных
и водосборных сооружений, а также
гидротехнических сооружений без
рыбозащитных устройств;
*
объектов
промышленности, кот. не имеют
санитарно-защитных зон; *оросительных,
обводнительных и осушительных систем,
водохранилищ, плотин, каналов и др. ГТС
до реализации мероприятий, кот.
предотвращают их вредное воздействие
на воду.Схемы
комплексного использования и охраны
вод: генеральные,
бассейновые и территориальные схемы.
Генеральные схемы охраны вод содержат
принципиальные направления развития
водного хоз-ва страны, что позволяет
четко определить технико-экономическую
целесообразность и очередность проведения
наиболее крупных водохозяйственных
мероприятий. На основе генеральной
схемы разрабатываются бассейновые
схемы для бассейнов рек и др. водных
объектов. Территориальные схемы
разрабатываются на основе генеральной
и бассейновой схем и охватывают конкретные
эконом. районы страны и субъекты РФ.Меры
по предотвращению загрязнений
гидросферы
Защита
поверхностных вод.К
поверхностным
относятся H2O
рек, временных водотоков, озер,
водохранилищ, прудов, водоемов, болот,
ледников и снежного покрова. Поверхностные
H2O необходимо охранять от засорения,
истощения и загрязнения. В целях
предупреждения засорения осущ.
мероприятия, кот. исключают попадание
в них мусора, тв отходов и др. предметов,
плохо воздействующих на качество вод
и условия обитания гидробионтов. С целью
контроля предусматривается ряд
мероприятий, в частности: мониторинг
водных объектов; создание водоохранных
зон; развитие безводных технологий, а
также систем оборотного (замкнутого)
водоснабжения; очистка сточных вод или
их закачка в глубокие водоносные
горизонты; очистка и обеззараживание
поверхностных вод, исп. для питьевого
водоснабжения и др. целей; надлежащий
гос. контроль за исп. и охраной водных
объектов
Водоохранные
зоны.
*В
целях поддержания водных объектов в
сост., кот. соответствует экологическим
требованиям, должны быть установлены
водоохранные зоны. Ими явл. территории,
примыкающие к акватории; на них
устанавливается спец. режим использования
и охраны природных ресурсов, а также
осуществления иной деятельности.*Очень
большое значение в деле охраны
поверхностных вод от засорения и
загрязнения имеют водоохранные лесные
насаждения вокруг естественных и
искусственных водоемов и водотоков для
защиты их от разрушительных действий
ветров и поступающей в них с водосбора
H2O, а также для уменьшения потерь H2O на
испарение. Защита
подземных вод.Она
заключ. в предотвращении истощения
запасов подземных вод и предохранении
их от загрязнения.
Мероприятия по защите: 1.рациональное
размещение водозаборов по площади;
2.регулирование
режима водоотбора подземных вод;
3.уточнение
величины эксплуатационных запасов;
4.для
самоизливающихся артезианских скважин
установ. кранового режима эксплуатации.
Иногда для профилактики истощения
подземных вод применяют искусственное
пополнение их посредством переH2O части
поверхностного стока в подземный.
Химия
морской H2O.
Соленость
и ионная сила H2O.
Сущ.
три основных св-ва, которые определяют
специфику хим. процессов морской
H2O:1.высокая
ионная сила морской H2O, связанная с
соленостью; 2.хим.
состав морской H2O с высоким содержанием
ионов Na
и хлора;3.закон
Дитмара, согласно которому кол-венные
соотношения между главными компонентами
основного солевого состава всегда
постоянны.
Соленость
H2O-определяется
как вес в граммах неорг. ионов в 1 кг H2O.
Измеряется по проводимости электрического
тока. H2O открытого океана имеют соленость
порядка 32–37 г/л. P
поверхностной соленой H2O 1,028 г/см3
при 0ºС. На глубине p
выше. Морская H2O, содержащая 3,5 % солей,
не имеет t
максимума плотности, что явл. одним из
ее важных отличий от пресной H2O. Чем
морская H2O холоднее, тем тяжелее
Соленость
морских вод различна. Соленость и ионный
состав морской H2O оставались
постоянными
в течение последних 900 млн лет. Эти данные
были получены при изучении древних
морских отложений-эвапоритов. Эвапориты-это
соли, которые выпали в р-те испарения
H2O в бассейнах, отрезанных от открытого
океана.Ионная
сила.
С ионов солей может быть выражена в виде
ионной силы:
такое
же кол-во др. составных частей древесины
идет в отходы, остающиеся в р-ре.
К
числу продуктов, распад которых идет с
трудом, относятся также хлорированные
углеводороды,
как орг.
р-рители с
одним-двумя атомами углерода,
полихлорированные бифенилы и хлорорг.
пестициды. Хлоруглеводороды могут
образоваться уже в самой H2O, когда
хлорированная H2O входит в контакт с
продуктами распада гумуса. Таким образом,
в первую очередь образуется трихлорметан.
ПАВ
в H2O. ПАВ-орг.
соед. (ки-ты, спирты, простые и сложные
эфиры, амины), эффективно понижающие
поверхностное натяжение H2O. Они образ.
тонкие пленки на частицах грязи при
стирке, что способствует самопроизвольному
концентрированию этих частиц в
поверхностном слое р-ра. Использование
ПАВ часто сопровождается пенообразованием.
Возросшая потребность в ПАВ на промышленных
предприятиях, а также их использование
в быту, прежде всего при стирке, привели
к большим скоплениям пены в руслах рек
и в водоемах. Эта пена препятствует
судоходству, а токсичность ПАВ приводит
к массовой гибели рыбы. С хим. точки
зрения ПАВ-орг. в-ва с гидрофильными и
гидрофобными участками различного хим.
строения. К наиболее распространенным
ПАВ относятся алкилсульфоновые
ки-ты.3
У полиоксиэтиленов,
соед. неионного хар.а, гидрофильная
часть молекулы создается за счет
спиртовых групп ОН. Алкиламмониевые
соед. содержат в качестве полярного
компонента +заряженную трет. аммониевую
группу. Они носят название инверсионных
мыл и проявляют бактерицидное действие.
[CH3(CH2)n-C6H4-SO3]P+
Согласно
Водному кодексу РФ запрещается ввод в
эксплуатацию: *любых
объектов, кот. не оборудованы очистными
сооружениями;*сбросных
и водосборных сооружений, а также
гидротехнических сооружений без
рыбозащитных устройств;
*
объектов
промышленности, кот. не имеют
санитарно-защитных зон; *оросительных,
обводнительных и осушительных систем,
водохранилищ, плотин, каналов и др. ГТС
до реализации мероприятий, кот.
предотвращают их вредное воздействие
на воду.Схемы
комплексного использования и охраны
вод: генеральные,
бассейновые и территориальные схемы.
Генеральные схемы охраны вод содержат
принципиальные направления развития
водного хоз-ва страны, что позволяет
четко определить технико-экономическую
целесообразность и очередность проведения
наиболее крупных водохозяйственных
мероприятий. На основе генеральной
схемы разрабатываются бассейновые
схемы для бассейнов рек и др. водных
объектов. Территориальные схемы
разрабатываются на основе генеральной
и бассейновой схем и охватывают конкретные
эконом. районы страны и субъекты РФ.Меры
по предотвращению загрязнений
гидросферы
Защита
поверхностных вод.К
поверхностным
относятся H2O
рек, временных водотоков, озер,
водохранилищ, прудов, водоемов, болот,
ледников и снежного покрова. Поверхностные
H2O необходимо охранять от засорения,
истощения и загрязнения. В целях
предупреждения засорения осущ.
мероприятия, кот. исключают попадание
в них мусора, тв отходов и др. предметов,
плохо воздействующих на качество вод
и условия обитания гидробионтов. С целью
контроля предусматривается ряд
мероприятий, в частности: мониторинг
водных объектов; создание водоохранных
зон; развитие безводных технологий, а
также систем оборотного (замкнутого)
водоснабжения; очистка сточных вод или
их закачка в глубокие водоносные
горизонты; очистка и обеззараживание
поверхностных вод, исп. для питьевого
водоснабжения и др. целей; надлежащий
гос. контроль за исп. и охраной водных
объектов
Водоохранные
зоны.
*В
целях поддержания водных объектов в
сост., кот. соответствует экологическим
требованиям, должны быть установлены
водоохранные зоны. Ими явл. территории,
примыкающие к акватории; на них
устанавливается спец. режим использования
и охраны природных ресурсов, а также
осуществления иной деятельности.*Очень
большое значение в деле охраны
поверхностных вод от засорения и
загрязнения имеют водоохранные лесные
насаждения вокруг естественных и
искусственных водоемов и водотоков для
защиты их от разрушительных действий
ветров и поступающей в них с водосбора
H2O, а также для уменьшения потерь H2O на
испарение. Защита
подземных вод.Она
заключ. в предотвращении истощения
запасов подземных вод и предохранении
их от загрязнения.
Мероприятия по защите: 1.рациональное
размещение водозаборов по площади;
2.регулирование
режима водоотбора подземных вод;
3.уточнение
величины эксплуатационных запасов;
4.для
самоизливающихся артезианских скважин
установ. кранового режима эксплуатации.
Иногда для профилактики истощения
подземных вод применяют искусственное
пополнение их посредством переH2O части
поверхностного стока в подземный.
Химия
морской H2O.
Соленость
и ионная сила H2O.
Сущ.
три основных св-ва, которые определяют
специфику хим. процессов морской
H2O:1.высокая
ионная сила морской H2O, связанная с
соленостью; 2.хим.
состав морской H2O с высоким содержанием
ионов Na
и хлора;3.закон
Дитмара, согласно которому кол-венные
соотношения между главными компонентами
основного солевого состава всегда
постоянны.
Соленость
H2O-определяется
как вес в граммах неорг. ионов в 1 кг H2O.
Измеряется по проводимости электрического
тока. H2O открытого океана имеют соленость
порядка 32–37 г/л. P
поверхностной соленой H2O 1,028 г/см3
при 0ºС. На глубине p
выше. Морская H2O, содержащая 3,5 % солей,
не имеет t
максимума плотности, что явл. одним из
ее важных отличий от пресной H2O. Чем
морская H2O холоднее, тем тяжелее
Соленость
морских вод различна. Соленость и ионный
состав морской H2O оставались
постоянными
в течение последних 900 млн лет. Эти данные
были получены при изучении древних
морских отложений-эвапоритов. Эвапориты-это
соли, которые выпали в р-те испарения
H2O в бассейнах, отрезанных от открытого
океана.Ионная
сила.
С ионов солей может быть выражена в виде
ионной силы:
![]() где
I-ионная
сила; Сi-С
ионов, моль/л; Zi-заряд
иона. Размерность
ионной силы-моль/л. Морская H2O имеет
очень высокое значение ионной силы,
равное 0,7 моль/л. Речные H2O имеют на 10–3
порядка меньше, моль/л. Св-ва
морской H2O как концентрированной системы
сильно отличаются от св-в идеальных
р-ров. Поэтому в физ.химии морских вод
необходимо учитывать снижение реакционной
способности ионов путем введения
активности. В теории р-ров рассматривают
термодинамическую активность (эффективная
и активная конц.). Активность.
Морская
H2O-слишком сложная система, чтобы измерить
коэффициенты активности всех ионов.
Однако для некоторых они известны.
Например, для Са коэффициент активности
равен 0,26, для карбонат-иона-0,20.Состав
ионов в морской H2O и
закон
Дитмара.Среди
катионов в H2Oх Мирового океана
преобладающими явл. в порядке убывания:
натрий — 0,47, магний — 0,053, калий — 0,01,
кальций — менее 0,01 моль/л; из анионов:
хлор — 0,55, сульфат-анион — 0,028 .
Независимо
от абсолютных конц. ионов кол-венные
соотношения между главными компонентами
остаются постоянными.
Эта
зависимость носит название закона
Дитмара. Благодаря закону Дитмара можно,
определив концентрацию только одного
реперного компонента, рассчитать
содержание остальных ионов. В качестве
такой реперной величины был выбран
параметр-хлорность.Под
хлорностью
H2O
принимают число грамм-ионов хлора,
эквивалентное сумме ионов галогенов,
содержащихся в 1 кг H2O, осаждаемых нитратом
серебра. В качестве единицы измерения
хлорности принято использовать
специальную единицу — промилле
(тысячная
доля). С, выраженная в промилле, равна
кол-ву грамм в-в.а в 1 кг р-ра. Для выражения
С (моль/л) следует значение С (промилле)
разделить на мольную массу компонента
и умножить на плотность H2O.
Хим.
состав неосновных ионов.
В химии морской H2O преобладают 7 ионов.
Наличие
Ме связано с различными источниками:1.ОВР
на океаническом (морском) дне;2.атм.
процессы;3.привнесение
ионов Ме с речной H2O.
Сейчас
эти процессы активизировались в связи
с антропогенной деятельностью (сжигание
угля, плавление Ме). Химизм р-ренных в
H2O Ме подразделяется на три класса,
описывающие поведение их в процессах
хим. круговорота:1.консервативный
класс;2.поведение
по типу питательных в-в.;3.класс
реакций выноса (извлечения).Химический
состав и круговорот ионов.
В
открытом океане происходят глобальные
хим. циклы. Привнос
ионов в
морскую воду определяется тремя
источниками-это реки, атм. осадки и
гидротермальные источники. Для хим.
круговорота главных ионов в морской
H2O важным индикатором процессов явл.
времена пребывания ионов. Эти времена
пребывания продолжительны и сост. 1 000
лет - 100 млн лет. Расчет времени пребывания
основывается на предположении, что
основным источником ионов, кот. привносятся
в океан, явл. реки и второстепенные
источники-это привносы из атм. и
гидротермальные H2O из океанических
горных хребтов.Вынос
ионов.К
основным процессам удаления ионов
относят:*выброс
ионов в атм. (Потоки
«море — воздух»);
*процессы
отложения в виде эвапоритов, хим.
осаждения карбонатов, абиогенного
осаждения CaCO3,
опаловых силикатов, сульфидов;*гидротермальную
циркуляцию морской H2O через срединные
океанические хребты. Потоки
«море — воздух» у
главных ионов вызваны разрывами пузырей
и ударами волн на поверхности моря. В
р-те морские соли выбрасываются в атм.,
основная их часть немедленно падает
обратно в море. Др. часть переносится
на большие расстояния и попадает в
речную воду. Считается, что эти переносимые
по воздуху морские соли имеют такой же
относительный ионный состав, что и
морская H2O. С точки зрения глобальных
запасов переносимые по воздуху морские
соли явл. важным стоком из морской H2O
только для K+
и Сl–.Эвапориты.
Испарение
H2O способствует осаждению составляющих
ее солей, так называемых эвапоритных
минералов. Осаждение начинается с
наименее р-римых солей-заканчивается
наиболее р-римыми. Сначала выпадает
СаСО3,
Затем СаSО4·
2Н2О
(гипс), потом NaСl. Затем начинают
кристаллизоваться некоторые соли Mg.
Если процесс испарения продолжается,
выпадают высокораство-римые соли калия
(K+).
Гидротермальная
циркуляция.
Химия гидротермальных флюидов показывает,
что взаимодействия «базальт — морская
H2O» в районах горячих источников явл.
источником некоторых элементов Са2+
и
силикатов, кот. отрываются от океанической
коры и впрыскиваются в морскую воду.
Кальций выщелачивается, по-видимому,
из кальциевых полевых шпатов (анортита),
тогда как силикаты могут выщелачиваться
из любого разрушающегося силиката,
входящего в состав базальта. Это
обеспечивает 35 % поступления этих ионов
от Vа поступлений с речными H2Oми. Протекают
также гидротермальные р-ии с участием
сульфатов калия.
Анализ
хим. состава континентальных вод
позволяет выделить особенности:1)В
р-ренном сост. в хим. составе пресной
H2O преоб-ладают четыре Ме, присутствующие
в виде простых катионов: Са2+,
Na+,
К+
и Мg2+.2)
С ионов в пресных H2Oх низка.3)
Химический (ионный) состав р-ренных в-в.
в пресной H2O принципиально отличается
от хим. состава континентальной коры,
несмотря на то, что все катионы в речной
H2O, за исключением некоторого кол-ва
натрия и хлора, явл. р-т процессов
выветривания.
Сравнение состава важнейших р-ренных
ионов в четырех крупных реках, дренирующих
разные области земной коры, показывает
преобладание кальция, магния, натрия и
калия. Однако в целом химия рек различна
и большинство различий обусловливается
режимами выветривания.
Состав
р-ренных ионов в пресных H2Oх зависит:•
от состава дождевых осадков;• сухих
атм. выпадений;• варьирующих вкладов
от реакций выветривания и разложения
орган. в-в.а в почвах;• различного
вовлечения в биологические процессы в
почвах.Там,
где присутствуют кристаллические
породы, химия р-ренных в-в. в пресных
H2Oх в основном зависит от природных
поступлений в атм., например морских
брызг и пыли, а также антропогенных
газов, например SО2.
Поступления морской соли, обычно
называемые цикличной солью, хар-ны для
прибрежных областей.
Кислотно-основное
равновесие
в
природных водоемах.
В
соответствии с необходимостью соблюдения
электронейтральности р-ров в природных
поверхностных H2Oх выполняется равенство
где
I-ионная
сила; Сi-С
ионов, моль/л; Zi-заряд
иона. Размерность
ионной силы-моль/л. Морская H2O имеет
очень высокое значение ионной силы,
равное 0,7 моль/л. Речные H2O имеют на 10–3
порядка меньше, моль/л. Св-ва
морской H2O как концентрированной системы
сильно отличаются от св-в идеальных
р-ров. Поэтому в физ.химии морских вод
необходимо учитывать снижение реакционной
способности ионов путем введения
активности. В теории р-ров рассматривают
термодинамическую активность (эффективная
и активная конц.). Активность.
Морская
H2O-слишком сложная система, чтобы измерить
коэффициенты активности всех ионов.
Однако для некоторых они известны.
Например, для Са коэффициент активности
равен 0,26, для карбонат-иона-0,20.Состав
ионов в морской H2O и
закон
Дитмара.Среди
катионов в H2Oх Мирового океана
преобладающими явл. в порядке убывания:
натрий — 0,47, магний — 0,053, калий — 0,01,
кальций — менее 0,01 моль/л; из анионов:
хлор — 0,55, сульфат-анион — 0,028 .
Независимо
от абсолютных конц. ионов кол-венные
соотношения между главными компонентами
остаются постоянными.
Эта
зависимость носит название закона
Дитмара. Благодаря закону Дитмара можно,
определив концентрацию только одного
реперного компонента, рассчитать
содержание остальных ионов. В качестве
такой реперной величины был выбран
параметр-хлорность.Под
хлорностью
H2O
принимают число грамм-ионов хлора,
эквивалентное сумме ионов галогенов,
содержащихся в 1 кг H2O, осаждаемых нитратом
серебра. В качестве единицы измерения
хлорности принято использовать
специальную единицу — промилле
(тысячная
доля). С, выраженная в промилле, равна
кол-ву грамм в-в.а в 1 кг р-ра. Для выражения
С (моль/л) следует значение С (промилле)
разделить на мольную массу компонента
и умножить на плотность H2O.
Хим.
состав неосновных ионов.
В химии морской H2O преобладают 7 ионов.
Наличие
Ме связано с различными источниками:1.ОВР
на океаническом (морском) дне;2.атм.
процессы;3.привнесение
ионов Ме с речной H2O.
Сейчас
эти процессы активизировались в связи
с антропогенной деятельностью (сжигание
угля, плавление Ме). Химизм р-ренных в
H2O Ме подразделяется на три класса,
описывающие поведение их в процессах
хим. круговорота:1.консервативный
класс;2.поведение
по типу питательных в-в.;3.класс
реакций выноса (извлечения).Химический
состав и круговорот ионов.
В
открытом океане происходят глобальные
хим. циклы. Привнос
ионов в
морскую воду определяется тремя
источниками-это реки, атм. осадки и
гидротермальные источники. Для хим.
круговорота главных ионов в морской
H2O важным индикатором процессов явл.
времена пребывания ионов. Эти времена
пребывания продолжительны и сост. 1 000
лет - 100 млн лет. Расчет времени пребывания
основывается на предположении, что
основным источником ионов, кот. привносятся
в океан, явл. реки и второстепенные
источники-это привносы из атм. и
гидротермальные H2O из океанических
горных хребтов.Вынос
ионов.К
основным процессам удаления ионов
относят:*выброс
ионов в атм. (Потоки
«море — воздух»);
*процессы
отложения в виде эвапоритов, хим.
осаждения карбонатов, абиогенного
осаждения CaCO3,
опаловых силикатов, сульфидов;*гидротермальную
циркуляцию морской H2O через срединные
океанические хребты. Потоки
«море — воздух» у
главных ионов вызваны разрывами пузырей
и ударами волн на поверхности моря. В
р-те морские соли выбрасываются в атм.,
основная их часть немедленно падает
обратно в море. Др. часть переносится
на большие расстояния и попадает в
речную воду. Считается, что эти переносимые
по воздуху морские соли имеют такой же
относительный ионный состав, что и
морская H2O. С точки зрения глобальных
запасов переносимые по воздуху морские
соли явл. важным стоком из морской H2O
только для K+
и Сl–.Эвапориты.
Испарение
H2O способствует осаждению составляющих
ее солей, так называемых эвапоритных
минералов. Осаждение начинается с
наименее р-римых солей-заканчивается
наиболее р-римыми. Сначала выпадает
СаСО3,
Затем СаSО4·
2Н2О
(гипс), потом NaСl. Затем начинают
кристаллизоваться некоторые соли Mg.
Если процесс испарения продолжается,
выпадают высокораство-римые соли калия
(K+).
Гидротермальная
циркуляция.
Химия гидротермальных флюидов показывает,
что взаимодействия «базальт — морская
H2O» в районах горячих источников явл.
источником некоторых элементов Са2+
и
силикатов, кот. отрываются от океанической
коры и впрыскиваются в морскую воду.
Кальций выщелачивается, по-видимому,
из кальциевых полевых шпатов (анортита),
тогда как силикаты могут выщелачиваться
из любого разрушающегося силиката,
входящего в состав базальта. Это
обеспечивает 35 % поступления этих ионов
от Vа поступлений с речными H2Oми. Протекают
также гидротермальные р-ии с участием
сульфатов калия.
Анализ
хим. состава континентальных вод
позволяет выделить особенности:1)В
р-ренном сост. в хим. составе пресной
H2O преоб-ладают четыре Ме, присутствующие
в виде простых катионов: Са2+,
Na+,
К+
и Мg2+.2)
С ионов в пресных H2Oх низка.3)
Химический (ионный) состав р-ренных в-в.
в пресной H2O принципиально отличается
от хим. состава континентальной коры,
несмотря на то, что все катионы в речной
H2O, за исключением некоторого кол-ва
натрия и хлора, явл. р-т процессов
выветривания.
Сравнение состава важнейших р-ренных
ионов в четырех крупных реках, дренирующих
разные области земной коры, показывает
преобладание кальция, магния, натрия и
калия. Однако в целом химия рек различна
и большинство различий обусловливается
режимами выветривания.
Состав
р-ренных ионов в пресных H2Oх зависит:•
от состава дождевых осадков;• сухих
атм. выпадений;• варьирующих вкладов
от реакций выветривания и разложения
орган. в-в.а в почвах;• различного
вовлечения в биологические процессы в
почвах.Там,
где присутствуют кристаллические
породы, химия р-ренных в-в. в пресных
H2Oх в основном зависит от природных
поступлений в атм., например морских
брызг и пыли, а также антропогенных
газов, например SО2.
Поступления морской соли, обычно
называемые цикличной солью, хар-ны для
прибрежных областей.
Кислотно-основное
равновесие
в
природных водоемах.
В
соответствии с необходимостью соблюдения
электронейтральности р-ров в природных
поверхностных H2Oх выполняется равенство![]() При
отсутствии процессов р-рения и образования
новых фаз ионы Na+, К+, Са2+, Cl–, SO2– не будут
оказывать влияния на рН образующихся
р-ров. Кислотно-основное равновесие
будет определяться присутствием ионов
НСО3-
и
СО32−.
Поэтому для большинства природных вод
С ионов водорода определяется содержанием
гидрокарбонат- и карбонат-ионов. В этих
р-рах при рН = 7 будет соблюдаться
равенство:
При
отсутствии процессов р-рения и образования
новых фаз ионы Na+, К+, Са2+, Cl–, SO2– не будут
оказывать влияния на рН образующихся
р-ров. Кислотно-основное равновесие
будет определяться присутствием ионов
НСО3-
и
СО32−.
Поэтому для большинства природных вод
С ионов водорода определяется содержанием
гидрокарбонат- и карбонат-ионов. В этих
р-рах при рН = 7 будет соблюдаться
равенство:![]() В
этой связи изучению равновесий,
возникающих в карбонатной системе,
следует уделить особое внимание.
Неорг.
соед. углерода, находящиеся в природных
H2Oх в виде производных угольной ки-ты,
тесно взаимосвязаны друг с другом и
образуют карбонатную систему.
В
контакте с H2O диоксид углерода р-ряется
до наступления равновесия:
В
этой связи изучению равновесий,
возникающих в карбонатной системе,
следует уделить особое внимание.
Неорг.
соед. углерода, находящиеся в природных
H2Oх в виде производных угольной ки-ты,
тесно взаимосвязаны друг с другом и
образуют карбонатную систему.
В
контакте с H2O диоксид углерода р-ряется
до наступления равновесия:![]() ,
,![]() Угольная
ки-та диссоциирует по 1-ой ступени с
образованием ионов водорода и
гидрокарбоната:
Угольная
ки-та диссоциирует по 1-ой ступени с
образованием ионов водорода и
гидрокарбоната:![]() Константа
равновесия этого процесса равна отношению
произведения активности ионов водорода
и гидрокарбоната к активности угольной
ки-ты.
Диссоциация
угольной ки-ты по второй ступени протекает
значительно слабее и приводит
к
появлению карбонат-ионов:
Если
известна суммарная активность карбонатов
и рН р-ра, всегда можно вычислить
активность каждого из компонентов
карбонатной системы. Для ориентировочных
расчетов удобно исп. распределительную
диаграмму, кот. представляет зависимость
содержания в мольных долях компонентов
карбонатной системы от величины рН
р-ра.
Анализ
соотношений, описывающих процесс р-рения
диоксида углерода в H2O, позволяет
установить зависимость конц. ионов
водорода в р-ре от парциального р диоксида
углерода в воздухе. Константа диссоциации
угольной кислоты по второй ступени
примерно на четыре порядка меньше, чем
константа диссоциации по первой ступени.
Поэтому при оценке влияния угольной
кислоты на значение рН атмосферных
осадков процесс диссоциации по второй
ступени можно не принимать во внимание:
Константа
равновесия этого процесса равна отношению
произведения активности ионов водорода
и гидрокарбоната к активности угольной
ки-ты.
Диссоциация
угольной ки-ты по второй ступени протекает
значительно слабее и приводит
к
появлению карбонат-ионов:
Если
известна суммарная активность карбонатов
и рН р-ра, всегда можно вычислить
активность каждого из компонентов
карбонатной системы. Для ориентировочных
расчетов удобно исп. распределительную
диаграмму, кот. представляет зависимость
содержания в мольных долях компонентов
карбонатной системы от величины рН
р-ра.
Анализ
соотношений, описывающих процесс р-рения
диоксида углерода в H2O, позволяет
установить зависимость конц. ионов
водорода в р-ре от парциального р диоксида
углерода в воздухе. Константа диссоциации
угольной кислоты по второй ступени
примерно на четыре порядка меньше, чем
константа диссоциации по первой ступени.
Поэтому при оценке влияния угольной
кислоты на значение рН атмосферных
осадков процесс диссоциации по второй
ступени можно не принимать во внимание:![]() .
В
реальных условиях рН атмосферных осадков
зависит от степени загрязнения
атмосферного воздуха и изменяется как
в меньшую, так и в большую сторону. В
некоторых района Земли в настоящее
время выпадают преимущественно осадки
с рН < 5,7; такие осадки назыв.
кислотными
(«кислотные дожди»).
Литосфера.
Физико-хим. процессы в литосфере.
Строение
литосферы и структура земной коры.
Литосфера-тв
оболочка Земли, которая включает в себя
земную кору и часть верхней мантии.
Толщина литосферы на суше колеблется
от 35-40 км (на равнинных участках) до 70 км
(в горных районах). Под древними горами
толщина земной коры ещё больше. Земная
кора под океанами-это тоже литосфера.
Здесь она самая тонкая-в среднем около
7-10 км. Толщину земной коры можно определить
по скорости распространения сейсмических
волн. Последние также дают некоторые
сведения о св-вах мантии, расположенной
под земной корой и входящей в литосферу.
Литосфера образовалась, в основном, в
р-те высвобождения в-в. из верхней мантии
молодой Земли. Её формирование продолжается
и сейчас-на дне океанов.
Состав
и структура глинистых минералов.
Глинистые минералы специфичны
по хар-у состава, являясь водосодержащими
слоистыми силикатами, состоящими в
основном из атомов О2, Si
и Al.
Глинистые минералы-это
слоистые силикаты, построенные из слоев
атомов в тетраэдрической и октаэдрической
координации, известных как тетраэдрические
и октаэдрические сетки. Тетраэдрические
сетки представляют собой слои тетраэдров
SiО4, которые имеют три общих О2а с соседними
тетраэдрами. Октаэдрическая сетка
построена из катионов, обычно Al,
Fe
или Mg,
расположенных на равных расстояниях
от 6 анионов О2, в связи с чем сетка несет
-заряд. Al
явл. распро-страненным катионом, и
идеальный октаэдрический слой имеет
состав Аl(OН)3-минерала гиббсита. Структура
глинистых минералов 1:1. Простейшим
расположением тетраэдрических и
октаэдрических сеток явл. слои 1:1. В
состав таких 1:1 минералов входит
серпентин-каолинитовая группа глинистых
минералов, из которых каолинит явл.,
вероятно, наиболее известным. В каолините
пакеты 1:1 удерживаются вместе водородными
связями, образующимися между ОН-группами
верхнего слоя октаэдрической сетки и
базальными О2ными атомами вышележащей
тетраэдрической сетки. Водородные связи
достаточно сильны, чтобы удерживать
пакеты 1:1 вместе.
Условия
образования глинистых минералов.
В
обычном гранодиорите верхней коры в
основном выветриваются с образованием
глинистых минералов именно полевые
шпаты.. Поскольку в промежуточной ступени
участвуют ионы почвенных р-ров, на тип
образующегося глинистого минерала
будут влиять рН почвенной влаги и степень
выщелачивания (скорость потока H2O).
Si
и Al
осаждаются
в виде нер-римых оксидов или оксигидроксидов
в пределах обычных для почв значений
рН. Др. почвенные катионы и H2SiO4 достаточно
р-римы и поэтому могут выноситься с
выветривающегося участка. Различие в
поведении катионов кол-венно выражается
химическим показателем изменения (ХПИ),
используя молекулярные соотношения:
ХПИ=(Al2O3/Al2O3+Ca•+Na2O+K2O)100,
CaO•
это CaO
силикатов (те исключается Ca-содержащие
карбонаты и фосфаты).
Значения
хпи для различных материалов коры:
Значения
ХПИ, близкие к 100, типичны для каолинитовых
глин, тогда иллиты и смектиты имеют
значения ХПИ 75–85. В отличие от них,
не-выщелоченные полевые шпаты имеют
значения ХПИ 50.
На
основании ХПИ можно предсказать, что
каолинит будет образовываться в условиях
сильного выщелачивания, что подтверждается
наблюдениями в тропических режимах
выветривания. На устойчивых земных
поверхностях, где выветривание и
выщелачивание продолжительны, на хорошо
дренированных участках формируется
каолинитовый, а в крайних случаях
гиббситовый
минералогический
состав глин.
Такие участки покрыты поверхностными
отложениями, богатыми железом (латерит)
и алюминием (боксит). Интенсивное
выщелачивание
благоприятствует
образованию каолинита, поскольку катионы
и H4SiО4 выносятся и понижается отношение
«кремний : алюминий», что способствует
структурной организации 1:1. При менее
интенсивном выщелачивании отношение
«Si:Al»
выше, что способствует образованию
различных 2:1-минералов в зависимости
от поступающих катионов. Например, при
выветривании базальта образуется много
магния, формируются магниевые смектиты.
В большинстве тропических сред с
интенсивным выветриванием выносится
весь кремний, что способствует образованию
гиббсита, который можно рассматривать
как структуру 0:1, т. е. присутствует
только октаэдрическая сетка.
Использование
глинистых минералов. Сурфактанты.
Большая
емкость катионного обмена смектитов
побудила к исследованиям возможности
использования их как катализаторов, т.
е. в-в., которые изменяют скорость хим.
р-ии, сами при этом не изменяясь. Глинистые
катализаторы имеют возможное применение
как адсорбенты для устранения загрязнения
природных вод или почв. В последнее
время в качестве адсорбентов использовались
тонко растертый активированный уголь
и древесный уголь, но они подвергались
окислению в процессе термического
разрушения загрязнителей. В качестве
альтернативных адсорбентов были
предложены смектитовые глинистые
катализаторы, хотя необходимы некоторые
модификации природного минерала. Соед.
диоксина действуют как нервные яды и
крайне токсичны. Нижнего предела, при
котором диоксины считаются безвредными
для природной среды, не существует.
Разрушение диоксинов биологич., хим.
или термическими способами-дорогостоящий
процесс, поскольку конц очень малы.
Т.О., для разрушения диоксина должны
быть переработаны большие Vы материала.
Использование
глинистых минералов.Сурфактанты.
Сурфактант
(поверхностно активный агент) представляет
собой в-в.о, которое вводится в р-р, чтобы
повлиять (обычно увеличить) на его
способность к растеканию и смачиванию
(т. е. те свойства, которые контролируются
поверхностным натяжением). Примерами
сурфактантов служат мыла и детергенты.
Молекула мыла обладает двумя особенностями,
обусловливающими его очищающее действие:
длинной неполярной углеводородной
цепочкой и полярной группой (карбоксилатной
группой). Ниже приведен пример современного
детергента — лаурилсульфата натрия:
.
В
реальных условиях рН атмосферных осадков
зависит от степени загрязнения
атмосферного воздуха и изменяется как
в меньшую, так и в большую сторону. В
некоторых района Земли в настоящее
время выпадают преимущественно осадки
с рН < 5,7; такие осадки назыв.
кислотными
(«кислотные дожди»).
Литосфера.
Физико-хим. процессы в литосфере.
Строение
литосферы и структура земной коры.
Литосфера-тв
оболочка Земли, которая включает в себя
земную кору и часть верхней мантии.
Толщина литосферы на суше колеблется
от 35-40 км (на равнинных участках) до 70 км
(в горных районах). Под древними горами
толщина земной коры ещё больше. Земная
кора под океанами-это тоже литосфера.
Здесь она самая тонкая-в среднем около
7-10 км. Толщину земной коры можно определить
по скорости распространения сейсмических
волн. Последние также дают некоторые
сведения о св-вах мантии, расположенной
под земной корой и входящей в литосферу.
Литосфера образовалась, в основном, в
р-те высвобождения в-в. из верхней мантии
молодой Земли. Её формирование продолжается
и сейчас-на дне океанов.
Состав
и структура глинистых минералов.
Глинистые минералы специфичны
по хар-у состава, являясь водосодержащими
слоистыми силикатами, состоящими в
основном из атомов О2, Si
и Al.
Глинистые минералы-это
слоистые силикаты, построенные из слоев
атомов в тетраэдрической и октаэдрической
координации, известных как тетраэдрические
и октаэдрические сетки. Тетраэдрические
сетки представляют собой слои тетраэдров
SiО4, которые имеют три общих О2а с соседними
тетраэдрами. Октаэдрическая сетка
построена из катионов, обычно Al,
Fe
или Mg,
расположенных на равных расстояниях
от 6 анионов О2, в связи с чем сетка несет
-заряд. Al
явл. распро-страненным катионом, и
идеальный октаэдрический слой имеет
состав Аl(OН)3-минерала гиббсита. Структура
глинистых минералов 1:1. Простейшим
расположением тетраэдрических и
октаэдрических сеток явл. слои 1:1. В
состав таких 1:1 минералов входит
серпентин-каолинитовая группа глинистых
минералов, из которых каолинит явл.,
вероятно, наиболее известным. В каолините
пакеты 1:1 удерживаются вместе водородными
связями, образующимися между ОН-группами
верхнего слоя октаэдрической сетки и
базальными О2ными атомами вышележащей
тетраэдрической сетки. Водородные связи
достаточно сильны, чтобы удерживать
пакеты 1:1 вместе.
Условия
образования глинистых минералов.
В
обычном гранодиорите верхней коры в
основном выветриваются с образованием
глинистых минералов именно полевые
шпаты.. Поскольку в промежуточной ступени
участвуют ионы почвенных р-ров, на тип
образующегося глинистого минерала
будут влиять рН почвенной влаги и степень
выщелачивания (скорость потока H2O).
Si
и Al
осаждаются
в виде нер-римых оксидов или оксигидроксидов
в пределах обычных для почв значений
рН. Др. почвенные катионы и H2SiO4 достаточно
р-римы и поэтому могут выноситься с
выветривающегося участка. Различие в
поведении катионов кол-венно выражается
химическим показателем изменения (ХПИ),
используя молекулярные соотношения:
ХПИ=(Al2O3/Al2O3+Ca•+Na2O+K2O)100,
CaO•
это CaO
силикатов (те исключается Ca-содержащие
карбонаты и фосфаты).
Значения
хпи для различных материалов коры:
Значения
ХПИ, близкие к 100, типичны для каолинитовых
глин, тогда иллиты и смектиты имеют
значения ХПИ 75–85. В отличие от них,
не-выщелоченные полевые шпаты имеют
значения ХПИ 50.
На
основании ХПИ можно предсказать, что
каолинит будет образовываться в условиях
сильного выщелачивания, что подтверждается
наблюдениями в тропических режимах
выветривания. На устойчивых земных
поверхностях, где выветривание и
выщелачивание продолжительны, на хорошо
дренированных участках формируется
каолинитовый, а в крайних случаях
гиббситовый
минералогический
состав глин.
Такие участки покрыты поверхностными
отложениями, богатыми железом (латерит)
и алюминием (боксит). Интенсивное
выщелачивание
благоприятствует
образованию каолинита, поскольку катионы
и H4SiО4 выносятся и понижается отношение
«кремний : алюминий», что способствует
структурной организации 1:1. При менее
интенсивном выщелачивании отношение
«Si:Al»
выше, что способствует образованию
различных 2:1-минералов в зависимости
от поступающих катионов. Например, при
выветривании базальта образуется много
магния, формируются магниевые смектиты.
В большинстве тропических сред с
интенсивным выветриванием выносится
весь кремний, что способствует образованию
гиббсита, который можно рассматривать
как структуру 0:1, т. е. присутствует
только октаэдрическая сетка.
Использование
глинистых минералов. Сурфактанты.
Большая
емкость катионного обмена смектитов
побудила к исследованиям возможности
использования их как катализаторов, т.
е. в-в., которые изменяют скорость хим.
р-ии, сами при этом не изменяясь. Глинистые
катализаторы имеют возможное применение
как адсорбенты для устранения загрязнения
природных вод или почв. В последнее
время в качестве адсорбентов использовались
тонко растертый активированный уголь
и древесный уголь, но они подвергались
окислению в процессе термического
разрушения загрязнителей. В качестве
альтернативных адсорбентов были
предложены смектитовые глинистые
катализаторы, хотя необходимы некоторые
модификации природного минерала. Соед.
диоксина действуют как нервные яды и
крайне токсичны. Нижнего предела, при
котором диоксины считаются безвредными
для природной среды, не существует.
Разрушение диоксинов биологич., хим.
или термическими способами-дорогостоящий
процесс, поскольку конц очень малы.
Т.О., для разрушения диоксина должны
быть переработаны большие Vы материала.
Использование
глинистых минералов.Сурфактанты.
Сурфактант
(поверхностно активный агент) представляет
собой в-в.о, которое вводится в р-р, чтобы
повлиять (обычно увеличить) на его
способность к растеканию и смачиванию
(т. е. те свойства, которые контролируются
поверхностным натяжением). Примерами
сурфактантов служат мыла и детергенты.
Молекула мыла обладает двумя особенностями,
обусловливающими его очищающее действие:
длинной неполярной углеводородной
цепочкой и полярной группой (карбоксилатной
группой). Ниже приведен пример современного
детергента — лаурилсульфата натрия:
![]() Катализаторы
из модифицированных смектитовых глин.
При
температуре выше 200 °С происходит потеря
H2O из межпакетных пространств, которые
сжимаются до структуры иллита. Поскольку
емкость катионного обмена смектитов
сосредоточена в межпакетных слоях, то
есть необходимость предотвращения
сжатия этих слоев, тем более что для
регенерации смектитов обычно используют
термическую обработку. Одним из способов
удержания межпакетных пространств
открытыми в отсутствие р-рителя явл.
внедрение термически стабильных
катионов, действующих как молекулярные
«подставки»/«подпорки». Установка
«подпорки» имеет еще два преимущества.
Во-первых, увеличивается внутренняя
поверхность межпакетного пространства,
что делает его более эффективным в
качестве адсорбента. Во-вторых, при
введении катионных «подпорок» различных
размеров и площади становится возможным
варьировать величину пространства
между ними. Таким образом, можно
изготавливать высокоспецифичные
молекулярные сита, пригодные для того,
чтобы захватывать большие ионы или
молекулы и в то же время просеивать
небольшие безвредные молекулы. Смектитовые
глины не
обладают большим сродством к р-римым
орг.м загрязнителям. Гипергенез
и почвообразование.
В
настоящее время под выветриванием
или
гипергенезом
понимают
сумму
процессов преобразования твердого
в-в.а земной коры на поверхности суши
под влиянием H2O, воздуха, колебаний
температуры и жизнедеятельности
организмов.
Сущность этих процессов заключается в
перегруппировке атомов и образовании
новых устойчивых к условиям земной
поверхности соед.. Различают два типа
выветривания: 1)
физическое,
или механическое
2)
хим.
Физическое
выветривание приводит к чисто механическому
разрушению пород.
Частые изменения температуры, морозное
выветривание с образованием морозоустойчивых
трещин и солевое растрескивание пород
(возникновение трещин
под рм кристаллов образующихся солей)
обусловливают разрыхление структуры
и распад пород на минеральные зерна.
Хим.
выветривание-разрыхление
коренных пород под действием О2а воздуха,
диоксида углерода, H2O, орг.х кислот,
сопровождающееся изменением их состава.
Хим.
выветривание
в основном вызывается H2O (особенно кислой
H2O) и газами, например О2ом, диоксидом
углерода, который разрушает минералы.
Некоторые ионы и соед. исх. минерала
удаляются с р-ром, просачивающимся через
обломки минерала и питающим грунтовые
H2O и реки. Тонкозернистые тв в-в.а могут
вымываться из выветриваемого участка,
оставляя химически измененные остатки,
которые формируют основу почв. Выделяют
еще третий тип выветривания-биологическое
(или органогенное).
Но
этот процесс связан либо с физическим
действием (например, ростомм корней
растений), либо с хим. действием (например,
воздействием орг.х ки-т, выдел. корнями
растений). Особенности
гипергенеза некоторых минералов.
Магматические
минералы, попадая на поверхность Земли,
оказываются в неустойчивом сост. Наименее
устойчивы силикаты, структуру которых
образуют изолированные кремнеО2ные
тетраэдры, соединяющиеся катионами Fe
и Mg.
Железомагниевые слюды (биотиты)
менее устойчивы, чем алюминиевые
(мусковиты).
Устойчивость
полевых шпатов, обладающих каркасной
структурой, зависит от размера катиона
(Са2+,
K+, Na+). Наиболее
устойчив кварц, структура которого
полностью состоит из кремнеО2ных
тетраэдров. В целом устойчивость главных
породообразующих минералов магматических
пород возрастает в соответствии с
последовательностью их кристаллизации.
В процессе гипергенеза наблюдается
значительное изменение в структурах
силикатных пород, происходит образование
глинистых минералов. В зависимости от
климатической зоны, времени года и
местных условий процессы выветривания
различных типов протекают с различной
интенсивностью. Почвообразованием
называется сложный природный процесс
перехода горной породы в качественно
новое состояние. Этот процесс протекает
при взаимодействии минерального в-в.а
земной коры с живыми организмами и
продуктами их жизнедеятельности.
Факторы,
влияющие на скорость гипергенеза.
Наиболее
важные факторы-рельеф местности, климат
(осадки, t), состав H2O, тип материнской
породы, кинетика ре-ций отдельных
минералов, а также биотические факторы,
в том числе повышение кислотности вод
за счет орг. ки-т растительного
происхождения. t
и водный режим.
Нагрев повышает скорость ре-ций, поэтому
скорость выветривания (гипергенеза) за
счет t
в тропиках (среднегодовая 20 °С) будет
примерно в 4–6 раз выше, чем в
умеренно-северных широтах. Во
влажном тропическом климате ускорение
гипергенеза происходит не только за
счет t,
но и за счет интенсивности водного
режима, поскольку сильные постоянные
ливни способствуют быстрому вымыванию
и сносу минералов, в том числе и
труднор-римых соед. типа оксида алюминия
и железа. Факторы,
влияющие на скорость гипергенеза. Тип
горной породы.
Минералы,
образовавшиеся при высоких tх и имеющие
большее кол-во ионных связей, более
подвержены выветриванию. Если рассмотреть
так называемую железомагнезиальную
серию (минералы, содержащие много Fe
и Mg),
то окажется, что скорость выветривания
будет расти в ряду «кварц (каркасный
силикат) → слюда мусковит (слоистый
силикат) → слюда биотит (слоистый
силикат) → амфибол (силикат с двойной
цепочкой → пироксен (цепочечный силикат)
→ оливин (мономерный силикат)». В так
называемой кислой серии (породы,
содержащие полевые шпа-ты) скорость
выветривания существенно зависит от
разновидности породы и возрастает в
ряду «калиевый полевой шпат → натриевый
полевой шпат → кальциевый полевой
шпат». Кинетика
реакций минералов. Скорость
гипергенеза минералов зависит от
интенсивности водных потоков (дождей).
Это действительно правильный вывод, но
только в том случае, когда конц. минералов
близка к насыщению.Для нер-римых и
малор-римых минералов (р-римость менее
10–4 моль/л), включая силикаты и многие
карбонаты, скорость гипергенеза
практически зависит не от интенсивности
водных потоков, а от скорости диффузии
ионов с поверхности кристаллов Биотические
факторы.
Присутствие
почвенного органического в-ва и его
разложение микроорганизмами сильно
увеличивает концентрацию СО2, придавая
кислотность и усиливая скорость
гипергенеза. Наличие почвы как таковой
также влияет на скорость выветривания.
Элементный
состав почв.
Под
почвой
понимается
естественно-историческое
органоминеральное природное тело,
возникшее на поверхности Земли в р-те
длительного воздействия биотических,
абиотических и антропогенных факторов,
состоящее из твердых минеральных и орг.
частиц, H2O и воздуха, имеющее специфические
генетико-морфологические признаки и
свойства, обусловливающие рост и развитие
растений.
Почва состоит из тв частиц (тв фаза
почвы), H2O (почвенного р-ра) и почвенного
воздуха. На долю твердой фазы приходится
40–65 % Vа почвенной массы. V почвенного
р-ра может изменяться в широком диапазоне.
До 35 % Vа почвы обычно занимает почвенный
воздух. Почвенный
р-р-это
ж фаза почвы, сущ. в природных условиях.
Состав почвенных р-ров меняется в очень
широких пределах. Наиболее
типичными компонентами почвенных р-ров,
С которых значительно превосходят С
других ионов, явл. катионы Са2+,
Mg2+, K+, NH4+, Na+ и
анионы НСО-,
SO42-, NO3– и
Сl–. При
изменении влажности почвы С от-дельных
ионов изменяется по различным законам.
Так, С ионов Na+,
Сl–, NO3– возрастает
пропорционально влажности почвы, а С
фосфат-иона, обусловленная произведением
р-римости фосфатов, почти не изменяется.
Гуминовые
ки-ты-группа
темно-окрашенных
гумусовых кислот, р-римых в щелочах и
не р-римых в кислотах. Гиматомелановые
ки-ты-группа
гумусовых ки-т, р-римых в этаноле.
Фульвоки-ты-группа
гумусовых ки-т, р-римых в H2O, щелочах и
ки-тах.
При
проведении анализов гумусовые ки-ты
экстрагируют из почвы р-рами щелочей
(0,1–0,5 н NaOH). При подкислении щелочной
вытяжки до рН (1-2) гумусовые и гиматомелановые
ки-ты выпадают в осадок. В р-ре остаются
только фульвоки-ты. При обработке
образовавшегося осадка этанолом
гиматомелановые ки-ты переходят в
спиртовой р-р, окрашивая его в
вишнево-красный цвет. Группу гуминовых
ки-т разделяют на две
подгруппы: черные
(серые) и
бурые
гуминовые кислоты. Гуминовые ки-ты,
обогащенные углеродом (преимущественно
в черноземных почвах), называют черными,
а в зарубежной литер.-серыми. Черные и
бурые гуминовые ки-ты могут быть разделены
методом высаливания: при обработке 2 н
р-ром NaCl черные гуминовые ки-ты коагулируют
и выпадают в осадок. Неспецифические
орг. соед. в почвах.
Основное
кол-во неспецифических орг. в-в. поступает
в почву с растительным опадом и остатками
корневой системы растений. Среди
неспецифических орг. в-в., поступающих
в почву с остатками растительного
происхождения, преобладают
углеH2,
лигнин, белки и липиды.
УглеH2.
УглеH2
входят в состав гумусовых ки-т и гумина.
Свободные углеH2 (не связанные с гумусовыми
ки-тами) активно участвуют в хим.
превращениях. Они образуют комплексные
соед. с ионами тяжелых Ме, вступают во
взаимод с глинистыми минералами или
подвергаются процессам минерализации.
В почвах встречаются представители
всех классов углеводов: моносахариды,
олигосахариды и полисахариды. Последние
сост. главную массу углеводов во всех
орг. остатках и наиболее устойчивы в
почвах. Среди важнейших полисахаридов,
встречающихся целлюлозу,
крахмал, хитин. Лигнин.
В
общей массе орг. соед., поступ. в почву,
доля лигнина сост. 15–30 %. Лигнин-один из
наиболее устойчивых к разложению
компонентов растительных тканей. В
основе строения макромолекулы лигнина
лежит фенилпропановое звено. В древесине
хвойных растений преобладают конифериловые
структуры, в лиственных-синаповые
(сиреневые), в травянистых
растениях-п-кумаровые. Белки.
Важнейшими
неспецифическими Nсодержащими в-в.ами,
которые обнаруживаются в почвах в
свободном сост., явл. белки. Помимо них,
следует назвать аминоки-ты, аминосахара,
нуклеиновые ки-ты, хлорофилл, амины. Под
влиянием ферментативной деятельности
микроорганизмов белки расщепляются на
менее сложные компоненты, легко
гумифицируются и минерализуются. Липиды.
В
группу липидов включают все в-ва,
извлекаемые из почвы орг. р-рителями.
Главными компонентами спиртобензольного
экстракта, извлекаемого из почв, обычно
явл. воск и смолы. Доля липидов в составе
орг. в-в.а минеральных горизонтов почв
колеблется от 2–14 до 10–12 % от его общего
содержания. В органогенных горизонтах
и торфах липиды накапливаются в больших
кол-вах (до 15–20 %).
Специфические
гумусовые в-в.а почв. появл.
в почве в р-те протекания процессов
гумификации орг.х остатков. Под
гумификацией
понимают
совокупность
процессов превращения исх. орг.х в-в в
гуминовые ки-ты и фульвоки-ты.
Гуминовые ки-ты представляют собой
более устойчивые соед., чем орг. соед.,
попадающие в почву с растительными
остатками. Поэтому неспецифические
орг. соед. почвы сущ. относительно
короткие промежутки времени, и непрерывная
цепь превращений растительных остатков
и продуктов их трансформации задерживается
на стадии образов. гуминовых ки-т.
Гуминовые ки-ты подвергаются минерализации
с образованием СО2 и Н2О или образуют
фрагменты, участвующие в синтезе новых
молекул гумусовых ки-т. Этот процесс
протекает очень медленно, поэтому время
жизни гуминовых ки-т сост. сотни и тысячи
лет. Гуминовые ки-ты представляют собой
группу в-в., извлекаемых из почвы щелочами
в виде темно-окрашенного р-ра (гуматов
Na,
NH3
или K)
и осаждаемых минеральными ки-тами в
виде аморфного осадка-геля.
Гуминовые
ки-ты имеют следующий элементный состав:
50–60 % углерода, 2–6 % водорода, 31–40 % О2 и
2–6 % Nа. Колебания в элементном составе
гуминовых кислот объясняются тем, что
они не явл. химически индивидуальными
кислотами определенного строения, а
представляют собой группу высокомолекулярных
соед., сходных по составу и свойствам.
Неспецифические
орг. соед. в почвах. До
настоящего времени формулы гуминовых
кислот установлены лишь гипотетически.
Светлоокрашенные гумусовые в-в.а,
остающиеся в р-ре после подкисления
щелочной вытяжки и отделения гуминовых
ки-т, определяют как фульвокислоты.
Элементный состав фульвоки-т хар-изуется
меньшим содержанием О2 и углерода.Несмотря
на то, что фульвокислоты, по сравнению
с гуминовыми кислотами, имеют более
высокую р-римость и меньшую молекулярную
массу, об их строении известно еще очень
мало. Кол-венно
и кач. установлено присутствие в составе
молекул гуминовых ки-т и фульвоки-т
различных функциональных групп:
аминогрупп, амидных, альдегидных,
карбоксильных, карбоксилатных, кетонных,
меток-сильных, фенольных, хинонных,
гидроксихинонных, пептидных групп,
спиртовых и фенольных ОН-групп.
Содержание
элементов в фульвоки-тах сост.: 44–49 % С,
44–49 % О2 а, 3–5 %Н2 и 2–4 % Nа. Общую
кислотность гумусовых соед. обусловливает
присутствие в молекулах карбоксильных
и фенольных ОН-групп. В фульвоки-тах
кислотность преимущественно связана
с карбоксильными группами. В гуминовых
ки-тах кол-во фенольных и карбоксильных
ОН-групп практически одинаково.
Органоминеральные
соед. в почвах.Все
виды продуктов взаимодействия
неспецифических в-в. почвы или специфических
гумусовых в-в. с минеральными компонентами
(катионами Ме, гидроксидами, неорг.
анионами, силикатами) объединяют в
понятие органоминеральных
соед.. Органоминеральные
соед. почв делят на три группы: 1)
гетерополярные соли; 2)
комплексно-гетерополярные соли; 3)
сорбционные комплексы. Гетерополярные,
или простые, соли гумусовых ки-т образ.
в р-те протекания реакций нейтрализации
гумусовых ки-т: ГК-(COOH)n+nNaOH→ГК-(COONa)n+nH2O.
Гуматы
щелочных Ме и аммония хорошо р-римы в
H2O и встречаются только в некоторых
солонцах и содовых солончаках. Гуматы
Са плохо р-римы в H2O при любых встречающихся
в почвах значениях рН и склонны к
образованию на поверхности минеральных
компонентов пленок, которые прочно
удерживаются силами адгезии. Гуматы Мg
р-ряются лучше, чем гуматы кальция. Они
могут переходить в р-р и мигрировать в
пределах почвенного профиля. Индивид.
гуматы или фульваты различных Ме редко
встречаются в почве. Чаще формируются
более сложные органоминеральные
производные, в которых катионы Ме входят
в анионную часть молекулы. В случае
дополнительного вовлечения
фенольных групп гумусовых кисл. происходит
образование хелатных комплексных соед.
Свободные карбоксильные и фенольные
ОН-группы комплекс. солей Ме гумусовых
кислот могут вступать в дальнейшее
взаимодействие с катионами Ме с
образованием комплексно-гетерополярных
солей:
Катализаторы
из модифицированных смектитовых глин.
При
температуре выше 200 °С происходит потеря
H2O из межпакетных пространств, которые
сжимаются до структуры иллита. Поскольку
емкость катионного обмена смектитов
сосредоточена в межпакетных слоях, то
есть необходимость предотвращения
сжатия этих слоев, тем более что для
регенерации смектитов обычно используют
термическую обработку. Одним из способов
удержания межпакетных пространств
открытыми в отсутствие р-рителя явл.
внедрение термически стабильных
катионов, действующих как молекулярные
«подставки»/«подпорки». Установка
«подпорки» имеет еще два преимущества.
Во-первых, увеличивается внутренняя
поверхность межпакетного пространства,
что делает его более эффективным в
качестве адсорбента. Во-вторых, при
введении катионных «подпорок» различных
размеров и площади становится возможным
варьировать величину пространства
между ними. Таким образом, можно
изготавливать высокоспецифичные
молекулярные сита, пригодные для того,
чтобы захватывать большие ионы или
молекулы и в то же время просеивать
небольшие безвредные молекулы. Смектитовые
глины не
обладают большим сродством к р-римым
орг.м загрязнителям. Гипергенез
и почвообразование.
В
настоящее время под выветриванием
или
гипергенезом
понимают
сумму
процессов преобразования твердого
в-в.а земной коры на поверхности суши
под влиянием H2O, воздуха, колебаний
температуры и жизнедеятельности
организмов.
Сущность этих процессов заключается в
перегруппировке атомов и образовании
новых устойчивых к условиям земной
поверхности соед.. Различают два типа
выветривания: 1)
физическое,
или механическое
2)
хим.
Физическое
выветривание приводит к чисто механическому
разрушению пород.
Частые изменения температуры, морозное
выветривание с образованием морозоустойчивых
трещин и солевое растрескивание пород
(возникновение трещин
под рм кристаллов образующихся солей)
обусловливают разрыхление структуры
и распад пород на минеральные зерна.
Хим.
выветривание-разрыхление
коренных пород под действием О2а воздуха,
диоксида углерода, H2O, орг.х кислот,
сопровождающееся изменением их состава.
Хим.
выветривание
в основном вызывается H2O (особенно кислой
H2O) и газами, например О2ом, диоксидом
углерода, который разрушает минералы.
Некоторые ионы и соед. исх. минерала
удаляются с р-ром, просачивающимся через
обломки минерала и питающим грунтовые
H2O и реки. Тонкозернистые тв в-в.а могут
вымываться из выветриваемого участка,
оставляя химически измененные остатки,
которые формируют основу почв. Выделяют
еще третий тип выветривания-биологическое
(или органогенное).
Но
этот процесс связан либо с физическим
действием (например, ростомм корней
растений), либо с хим. действием (например,
воздействием орг.х ки-т, выдел. корнями
растений). Особенности
гипергенеза некоторых минералов.
Магматические
минералы, попадая на поверхность Земли,
оказываются в неустойчивом сост. Наименее
устойчивы силикаты, структуру которых
образуют изолированные кремнеО2ные
тетраэдры, соединяющиеся катионами Fe
и Mg.
Железомагниевые слюды (биотиты)
менее устойчивы, чем алюминиевые
(мусковиты).
Устойчивость
полевых шпатов, обладающих каркасной
структурой, зависит от размера катиона
(Са2+,
K+, Na+). Наиболее
устойчив кварц, структура которого
полностью состоит из кремнеО2ных
тетраэдров. В целом устойчивость главных
породообразующих минералов магматических
пород возрастает в соответствии с
последовательностью их кристаллизации.
В процессе гипергенеза наблюдается
значительное изменение в структурах
силикатных пород, происходит образование
глинистых минералов. В зависимости от
климатической зоны, времени года и
местных условий процессы выветривания
различных типов протекают с различной
интенсивностью. Почвообразованием
называется сложный природный процесс
перехода горной породы в качественно
новое состояние. Этот процесс протекает
при взаимодействии минерального в-в.а
земной коры с живыми организмами и
продуктами их жизнедеятельности.
Факторы,
влияющие на скорость гипергенеза.
Наиболее
важные факторы-рельеф местности, климат
(осадки, t), состав H2O, тип материнской
породы, кинетика ре-ций отдельных
минералов, а также биотические факторы,
в том числе повышение кислотности вод
за счет орг. ки-т растительного
происхождения. t
и водный режим.
Нагрев повышает скорость ре-ций, поэтому
скорость выветривания (гипергенеза) за
счет t
в тропиках (среднегодовая 20 °С) будет
примерно в 4–6 раз выше, чем в
умеренно-северных широтах. Во
влажном тропическом климате ускорение
гипергенеза происходит не только за
счет t,
но и за счет интенсивности водного
режима, поскольку сильные постоянные
ливни способствуют быстрому вымыванию
и сносу минералов, в том числе и
труднор-римых соед. типа оксида алюминия
и железа. Факторы,
влияющие на скорость гипергенеза. Тип
горной породы.
Минералы,
образовавшиеся при высоких tх и имеющие
большее кол-во ионных связей, более
подвержены выветриванию. Если рассмотреть
так называемую железомагнезиальную
серию (минералы, содержащие много Fe
и Mg),
то окажется, что скорость выветривания
будет расти в ряду «кварц (каркасный
силикат) → слюда мусковит (слоистый
силикат) → слюда биотит (слоистый
силикат) → амфибол (силикат с двойной
цепочкой → пироксен (цепочечный силикат)
→ оливин (мономерный силикат)». В так
называемой кислой серии (породы,
содержащие полевые шпа-ты) скорость
выветривания существенно зависит от
разновидности породы и возрастает в
ряду «калиевый полевой шпат → натриевый
полевой шпат → кальциевый полевой
шпат». Кинетика
реакций минералов. Скорость
гипергенеза минералов зависит от
интенсивности водных потоков (дождей).
Это действительно правильный вывод, но
только в том случае, когда конц. минералов
близка к насыщению.Для нер-римых и
малор-римых минералов (р-римость менее
10–4 моль/л), включая силикаты и многие
карбонаты, скорость гипергенеза
практически зависит не от интенсивности
водных потоков, а от скорости диффузии
ионов с поверхности кристаллов Биотические
факторы.
Присутствие
почвенного органического в-ва и его
разложение микроорганизмами сильно
увеличивает концентрацию СО2, придавая
кислотность и усиливая скорость
гипергенеза. Наличие почвы как таковой
также влияет на скорость выветривания.
Элементный
состав почв.
Под
почвой
понимается
естественно-историческое
органоминеральное природное тело,
возникшее на поверхности Земли в р-те
длительного воздействия биотических,
абиотических и антропогенных факторов,
состоящее из твердых минеральных и орг.
частиц, H2O и воздуха, имеющее специфические
генетико-морфологические признаки и
свойства, обусловливающие рост и развитие
растений.
Почва состоит из тв частиц (тв фаза
почвы), H2O (почвенного р-ра) и почвенного
воздуха. На долю твердой фазы приходится
40–65 % Vа почвенной массы. V почвенного
р-ра может изменяться в широком диапазоне.
До 35 % Vа почвы обычно занимает почвенный
воздух. Почвенный
р-р-это
ж фаза почвы, сущ. в природных условиях.
Состав почвенных р-ров меняется в очень
широких пределах. Наиболее
типичными компонентами почвенных р-ров,
С которых значительно превосходят С
других ионов, явл. катионы Са2+,
Mg2+, K+, NH4+, Na+ и
анионы НСО-,
SO42-, NO3– и
Сl–. При
изменении влажности почвы С от-дельных
ионов изменяется по различным законам.
Так, С ионов Na+,
Сl–, NO3– возрастает
пропорционально влажности почвы, а С
фосфат-иона, обусловленная произведением
р-римости фосфатов, почти не изменяется.
Гуминовые
ки-ты-группа
темно-окрашенных
гумусовых кислот, р-римых в щелочах и
не р-римых в кислотах. Гиматомелановые
ки-ты-группа
гумусовых ки-т, р-римых в этаноле.
Фульвоки-ты-группа
гумусовых ки-т, р-римых в H2O, щелочах и
ки-тах.
При
проведении анализов гумусовые ки-ты
экстрагируют из почвы р-рами щелочей
(0,1–0,5 н NaOH). При подкислении щелочной
вытяжки до рН (1-2) гумусовые и гиматомелановые
ки-ты выпадают в осадок. В р-ре остаются
только фульвоки-ты. При обработке
образовавшегося осадка этанолом
гиматомелановые ки-ты переходят в
спиртовой р-р, окрашивая его в
вишнево-красный цвет. Группу гуминовых
ки-т разделяют на две
подгруппы: черные
(серые) и
бурые
гуминовые кислоты. Гуминовые ки-ты,
обогащенные углеродом (преимущественно
в черноземных почвах), называют черными,
а в зарубежной литер.-серыми. Черные и
бурые гуминовые ки-ты могут быть разделены
методом высаливания: при обработке 2 н
р-ром NaCl черные гуминовые ки-ты коагулируют
и выпадают в осадок. Неспецифические
орг. соед. в почвах.
Основное
кол-во неспецифических орг. в-в. поступает
в почву с растительным опадом и остатками
корневой системы растений. Среди
неспецифических орг. в-в., поступающих
в почву с остатками растительного
происхождения, преобладают
углеH2,
лигнин, белки и липиды.
УглеH2.
УглеH2
входят в состав гумусовых ки-т и гумина.
Свободные углеH2 (не связанные с гумусовыми
ки-тами) активно участвуют в хим.
превращениях. Они образуют комплексные
соед. с ионами тяжелых Ме, вступают во
взаимод с глинистыми минералами или
подвергаются процессам минерализации.
В почвах встречаются представители
всех классов углеводов: моносахариды,
олигосахариды и полисахариды. Последние
сост. главную массу углеводов во всех
орг. остатках и наиболее устойчивы в
почвах. Среди важнейших полисахаридов,
встречающихся целлюлозу,
крахмал, хитин. Лигнин.
В
общей массе орг. соед., поступ. в почву,
доля лигнина сост. 15–30 %. Лигнин-один из
наиболее устойчивых к разложению
компонентов растительных тканей. В
основе строения макромолекулы лигнина
лежит фенилпропановое звено. В древесине
хвойных растений преобладают конифериловые
структуры, в лиственных-синаповые
(сиреневые), в травянистых
растениях-п-кумаровые. Белки.
Важнейшими
неспецифическими Nсодержащими в-в.ами,
которые обнаруживаются в почвах в
свободном сост., явл. белки. Помимо них,
следует назвать аминоки-ты, аминосахара,
нуклеиновые ки-ты, хлорофилл, амины. Под
влиянием ферментативной деятельности
микроорганизмов белки расщепляются на
менее сложные компоненты, легко
гумифицируются и минерализуются. Липиды.
В
группу липидов включают все в-ва,
извлекаемые из почвы орг. р-рителями.
Главными компонентами спиртобензольного
экстракта, извлекаемого из почв, обычно
явл. воск и смолы. Доля липидов в составе
орг. в-в.а минеральных горизонтов почв
колеблется от 2–14 до 10–12 % от его общего
содержания. В органогенных горизонтах
и торфах липиды накапливаются в больших
кол-вах (до 15–20 %).
Специфические
гумусовые в-в.а почв. появл.
в почве в р-те протекания процессов
гумификации орг.х остатков. Под
гумификацией
понимают
совокупность
процессов превращения исх. орг.х в-в в
гуминовые ки-ты и фульвоки-ты.
Гуминовые ки-ты представляют собой
более устойчивые соед., чем орг. соед.,
попадающие в почву с растительными
остатками. Поэтому неспецифические
орг. соед. почвы сущ. относительно
короткие промежутки времени, и непрерывная
цепь превращений растительных остатков
и продуктов их трансформации задерживается
на стадии образов. гуминовых ки-т.
Гуминовые ки-ты подвергаются минерализации
с образованием СО2 и Н2О или образуют
фрагменты, участвующие в синтезе новых
молекул гумусовых ки-т. Этот процесс
протекает очень медленно, поэтому время
жизни гуминовых ки-т сост. сотни и тысячи
лет. Гуминовые ки-ты представляют собой
группу в-в., извлекаемых из почвы щелочами
в виде темно-окрашенного р-ра (гуматов
Na,
NH3
или K)
и осаждаемых минеральными ки-тами в
виде аморфного осадка-геля.
Гуминовые
ки-ты имеют следующий элементный состав:
50–60 % углерода, 2–6 % водорода, 31–40 % О2 и
2–6 % Nа. Колебания в элементном составе
гуминовых кислот объясняются тем, что
они не явл. химически индивидуальными
кислотами определенного строения, а
представляют собой группу высокомолекулярных
соед., сходных по составу и свойствам.
Неспецифические
орг. соед. в почвах. До
настоящего времени формулы гуминовых
кислот установлены лишь гипотетически.
Светлоокрашенные гумусовые в-в.а,
остающиеся в р-ре после подкисления
щелочной вытяжки и отделения гуминовых
ки-т, определяют как фульвокислоты.
Элементный состав фульвоки-т хар-изуется
меньшим содержанием О2 и углерода.Несмотря
на то, что фульвокислоты, по сравнению
с гуминовыми кислотами, имеют более
высокую р-римость и меньшую молекулярную
массу, об их строении известно еще очень
мало. Кол-венно
и кач. установлено присутствие в составе
молекул гуминовых ки-т и фульвоки-т
различных функциональных групп:
аминогрупп, амидных, альдегидных,
карбоксильных, карбоксилатных, кетонных,
меток-сильных, фенольных, хинонных,
гидроксихинонных, пептидных групп,
спиртовых и фенольных ОН-групп.
Содержание
элементов в фульвоки-тах сост.: 44–49 % С,
44–49 % О2 а, 3–5 %Н2 и 2–4 % Nа. Общую
кислотность гумусовых соед. обусловливает
присутствие в молекулах карбоксильных
и фенольных ОН-групп. В фульвоки-тах
кислотность преимущественно связана
с карбоксильными группами. В гуминовых
ки-тах кол-во фенольных и карбоксильных
ОН-групп практически одинаково.
Органоминеральные
соед. в почвах.Все
виды продуктов взаимодействия
неспецифических в-в. почвы или специфических
гумусовых в-в. с минеральными компонентами
(катионами Ме, гидроксидами, неорг.
анионами, силикатами) объединяют в
понятие органоминеральных
соед.. Органоминеральные
соед. почв делят на три группы: 1)
гетерополярные соли; 2)
комплексно-гетерополярные соли; 3)
сорбционные комплексы. Гетерополярные,
или простые, соли гумусовых ки-т образ.
в р-те протекания реакций нейтрализации
гумусовых ки-т: ГК-(COOH)n+nNaOH→ГК-(COONa)n+nH2O.
Гуматы
щелочных Ме и аммония хорошо р-римы в
H2O и встречаются только в некоторых
солонцах и содовых солончаках. Гуматы
Са плохо р-римы в H2O при любых встречающихся
в почвах значениях рН и склонны к
образованию на поверхности минеральных
компонентов пленок, которые прочно
удерживаются силами адгезии. Гуматы Мg
р-ряются лучше, чем гуматы кальция. Они
могут переходить в р-р и мигрировать в
пределах почвенного профиля. Индивид.
гуматы или фульваты различных Ме редко
встречаются в почве. Чаще формируются
более сложные органоминеральные
производные, в которых катионы Ме входят
в анионную часть молекулы. В случае
дополнительного вовлечения
фенольных групп гумусовых кисл. происходит
образование хелатных комплексных соед.
Свободные карбоксильные и фенольные
ОН-группы комплекс. солей Ме гумусовых
кислот могут вступать в дальнейшее
взаимодействие с катионами Ме с
образованием комплексно-гетерополярных
солей:
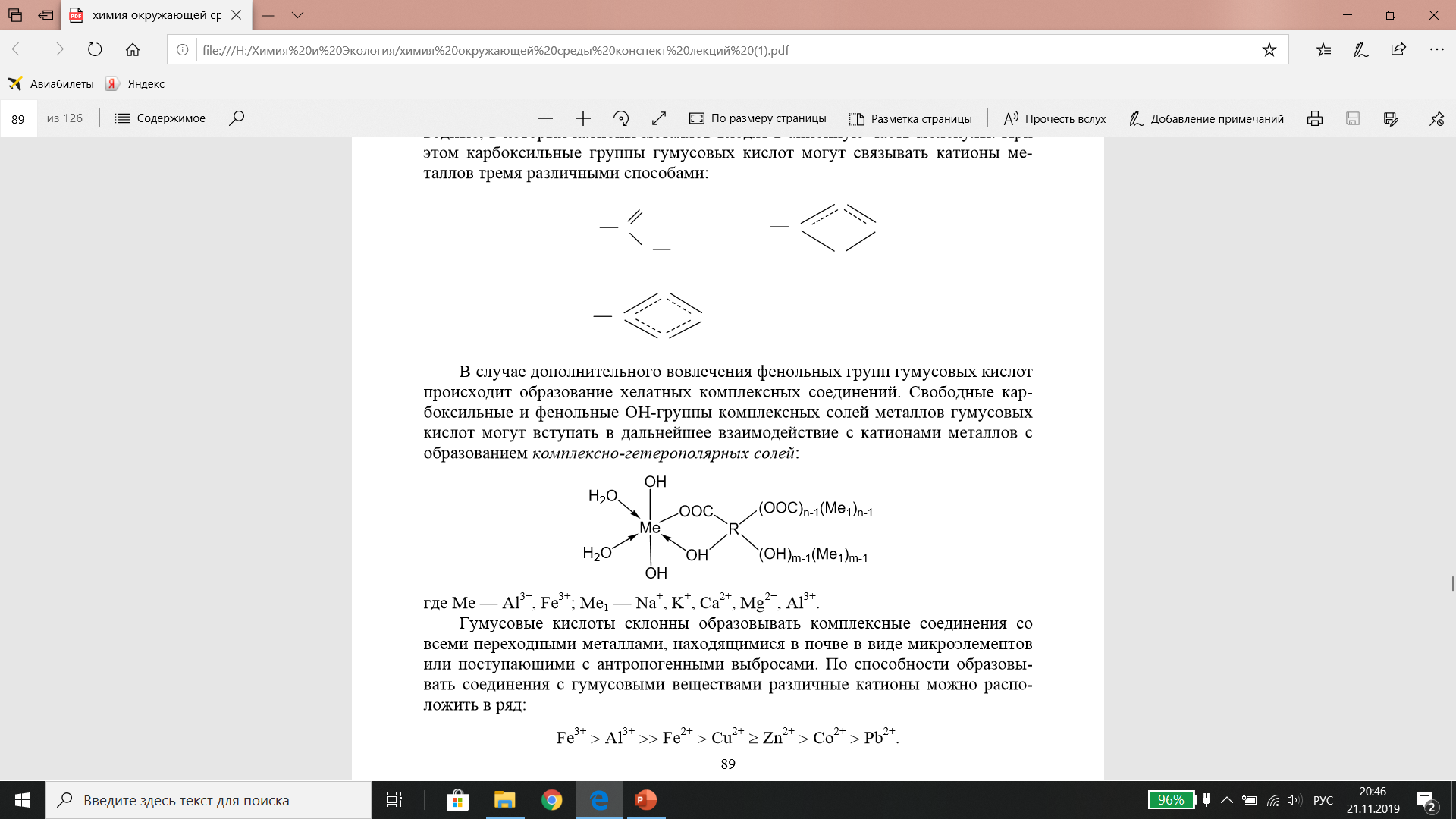 Me-Al3+,
Fe3+,
Me1-Na+,
K+,
Ca2+,
Mg2+,
Al3+.
Гумусовые
ки-ты
склонны образовывать комплексные соед.
со всеми переходными Ме, находящимися
в почве в виде микроэлементов или
поступающими с антропогенными выбросами.
По способности образовывать соед. с
гумусовыми в-вами различные катионы
можно расположить в
ряд:Fe3+>Al3+>>Fe2+>Cu2+>=Zn2+>Co2+>
Pb2+.
Положение Ме в ряду может меняться в
зависимости от природы гумусовых ки-т
и рН среды. Образование комплексных
соед. и гетерополярных солей гумусовых
ки-т играет важную роль в процессах
миграции и трансформации минеральных
компонентов почвы. Эти процессы частично
снижают опасность загрязнения почв,
т.к. при достаточном кол-ве орг. в-в. в
почве происходит связывание токсичных
Ме. Еще один вид органоминеральных
соед., образующихся в почве в процессе
взаимодействия гумусовых в-в. с
кристаллическими или аморфными минералами
почв, называют глино-гумусными, или
сорбционными, комплексами.
Закисление
почв.Щелочность
и кислотность почв.По
формам проявления кислотных и щелочных
св-в почв принято различ. актуальную
и потенциальную кислотность и щелочность.
Актуальные
кислотность и щелочность хар-изуются
конц.
ионов водорода и гидроксила в почвенном
р-ре. На практике чаще измеряют рН водной
вытяжки или водной суспензии, а не рН
почвенных р-ров. Кислотность почвенных
р-ров связана с присутствием в почвах
свободных орг. (главным образом гумусовых)
и неорг. (преимущественно угольной)
кислот и других орг. и минеральных соед.,
способных оказывать влияние на
кисл.-основное равновесие в почвенных
р-рах. Среди таких орг.х компонентов
почв следует назвать соед., содержащие
фенольные ОН- группы, а среди минеральных
компонентов-соед., содержащие катионы
Аl3+ и Fe3+, кислотные св-ва кот. соизмеримы
с кислотными св-вами угольной и уксусной
ки-т. В водных р-рах произведение констант
основности и кислотности соответствующих
кислотно-основных пар равно ионному
произведению H2O. Ионное произведение
чистой H2O при атм. р и около 25 °С имеет
значение 1,008*10–14. Сравнение значений
констант основности соответствующих
кислотноосновных пар показывает, что
наиболее сильными основными св-вами в
почвах обладают ионы S2– и СО32- . В
большинстве почв щелочность определяется
присутствием карбонат-ионов.В случае,
когда почвенные H2O находятся в равновесии
с атмосферным воздухом и кальцитом, рН
р-ра составит около 8,3. Присутствие
магнезита MgCO3 может увеличить рН до
10,0–11,0. В случае отсутствия карбонатов
кальция и магния в почве и увеличения
С диоксида углерода в почвенном воздухе
рН р-ра снижается и при содержании СО2,
равном 5–10 % (об.), может упасть примерно
до 4. Потенциальные кислотность и
щелочность почв проявл. в р-те различных
воздействий на почву. Потенциальную
кислотность почв
принято определять при воздействии на
почву р-ров хлорида калия (обычно 1 н р-р
KCl)-обменная кислотность-или р-ров
гидролитически щелочной соли (обычно
1 н р-р CH3COONa)-гидролитическая кислотность.
Обменную
кислотность оценивают
по величине рН солевой вытяжки. Для
кол-венного определения кислотности
солевую вытяжку титруют р-ром щелочи.
В случае обработки почвы р-ром KCl возможны
следующие р-ии обмена катионов
почвенно-поглощающего
комплекса (ППК):
HCl+NaOH=NaCl+H2O,
AlClO3+3NaOH=3NaCl+Al(OH)3.В
дальнейшем при титровании солевой
вытяжки р-ром NaOH в реакцию вступают HCl
и AlCl3. Ионы Al3+,
выделенные из почвенно-поглощающегокомплекса
в р-р, оказывают влияние на степень
кислотности, посколько в водных фазах
образуются ионы Al(OH)2+
и Al(OH)2+.
Процесс ионного обмена при обработке
почвы р-ром CH3COONa
можно представить ур.:ППК-H+
+ CH3COONa
=ППК-Na+
+ CH3COOH.
Для
почв хар-ен самопроизвольный переход
от насыщения катионами Н+ к насыщению
Аl3+. Так, любые почвы можно насытить
катионами Н+ и перевести их в состояние,
когда в составе обменных катионов будут
преобладать катионы водорода. Со временем
в такой почве в составе обменных катионов
появятся катионы Аl3+, кол-во которых
постепенно будет увеличиваться.
Поглотительная
способность почвы (ПС)-это
св-во поглощать (задерживать в себе)
газы, жидкости, солевые р-ры и тв частицы.
Различают 5 видов поглотительной
способности почв: механическую,
физическую, хим., биологическую и
физикo-хим.
Механич.
ПС-св-во
задерживать взвешенные частицы в
процессе фильтрации H2O через почву. В
р-те процесса механического поглощения
в пойменных и орошаемых почвах образуется
наилок, происходит очистка сточных вод
от грубых примесей на полях фильтрации
при миграции по профилю глинистых и
коллоидных частиц, образуется иллювиальный
горизонт. Физич.
ПС.-изменение
С р-ренного в-ва в слое р-ра, пограничном
с тв фазой почвы, обусловленное действием
физических сил. Почвенные коллоиды
способны адсорбировать на своей
поверхности анионы и катионы почвенного
р-ра и диполи H2O. В почвах наиболее часто
происходит увелич. конц. р-ренных
компонентов в поверхностном слое. Однако
возможно и уменьшение конц. компонентов,
например анионов, вблизи коллоидных
частиц и увеличение их содержания в
фильтрующемся р-ре. В р-те протекания
этого процесса возможна потеря питательных
компонентов почвы. Хим.
ПС.-образование
нер-римых или малор-римых солей в
почвенных р-рах. Очень часто эта
способность почв проявл. в карбонатном
горизонте при образовании кальцита-СаСО3.
При внесении в почву фосфорных удобрений
возможно образование нер-римых солей
Fe
или Ca.
Биолог.
ПС.-поглощение
различных в-в. из почвенного р-ра живыми
организмами. Существенной особенностью
этого процесса явл. избирательное
поглощение определенных, наиболее
важных для жизнедеятельности организмов
в-в. Благодаря этой избирательной
биологической способности растений в
верхних горизонтах почвы вместе с
гумусом аккумулируются многие биогенные
элементы. Физико-хим.
(или обменная) ПС-св-во
почвы эквивалентно обменивать ионы
почвенного р-ра и тв фазы почв. На
поверхности частиц тв фазы почв
присутствуют активные центры, имеющие
положительный или отрицательный заряд.
Поэтому по хар-ру ионообменной способности
почвы отнят к амфиболитам. Но практич.
во всех видах почв кол-во активных
центров, имеющих отрицательный заряд,
значительно больше, чем заряженных
положительно, поэтому для почв хар.на
преимущественно катионообменная
способность.
Me-Al3+,
Fe3+,
Me1-Na+,
K+,
Ca2+,
Mg2+,
Al3+.
Гумусовые
ки-ты
склонны образовывать комплексные соед.
со всеми переходными Ме, находящимися
в почве в виде микроэлементов или
поступающими с антропогенными выбросами.
По способности образовывать соед. с
гумусовыми в-вами различные катионы
можно расположить в
ряд:Fe3+>Al3+>>Fe2+>Cu2+>=Zn2+>Co2+>
Pb2+.
Положение Ме в ряду может меняться в
зависимости от природы гумусовых ки-т
и рН среды. Образование комплексных
соед. и гетерополярных солей гумусовых
ки-т играет важную роль в процессах
миграции и трансформации минеральных
компонентов почвы. Эти процессы частично
снижают опасность загрязнения почв,
т.к. при достаточном кол-ве орг. в-в. в
почве происходит связывание токсичных
Ме. Еще один вид органоминеральных
соед., образующихся в почве в процессе
взаимодействия гумусовых в-в. с
кристаллическими или аморфными минералами
почв, называют глино-гумусными, или
сорбционными, комплексами.
Закисление
почв.Щелочность
и кислотность почв.По
формам проявления кислотных и щелочных
св-в почв принято различ. актуальную
и потенциальную кислотность и щелочность.
Актуальные
кислотность и щелочность хар-изуются
конц.
ионов водорода и гидроксила в почвенном
р-ре. На практике чаще измеряют рН водной
вытяжки или водной суспензии, а не рН
почвенных р-ров. Кислотность почвенных
р-ров связана с присутствием в почвах
свободных орг. (главным образом гумусовых)
и неорг. (преимущественно угольной)
кислот и других орг. и минеральных соед.,
способных оказывать влияние на
кисл.-основное равновесие в почвенных
р-рах. Среди таких орг.х компонентов
почв следует назвать соед., содержащие
фенольные ОН- группы, а среди минеральных
компонентов-соед., содержащие катионы
Аl3+ и Fe3+, кислотные св-ва кот. соизмеримы
с кислотными св-вами угольной и уксусной
ки-т. В водных р-рах произведение констант
основности и кислотности соответствующих
кислотно-основных пар равно ионному
произведению H2O. Ионное произведение
чистой H2O при атм. р и около 25 °С имеет
значение 1,008*10–14. Сравнение значений
констант основности соответствующих
кислотноосновных пар показывает, что
наиболее сильными основными св-вами в
почвах обладают ионы S2– и СО32- . В
большинстве почв щелочность определяется
присутствием карбонат-ионов.В случае,
когда почвенные H2O находятся в равновесии
с атмосферным воздухом и кальцитом, рН
р-ра составит около 8,3. Присутствие
магнезита MgCO3 может увеличить рН до
10,0–11,0. В случае отсутствия карбонатов
кальция и магния в почве и увеличения
С диоксида углерода в почвенном воздухе
рН р-ра снижается и при содержании СО2,
равном 5–10 % (об.), может упасть примерно
до 4. Потенциальные кислотность и
щелочность почв проявл. в р-те различных
воздействий на почву. Потенциальную
кислотность почв
принято определять при воздействии на
почву р-ров хлорида калия (обычно 1 н р-р
KCl)-обменная кислотность-или р-ров
гидролитически щелочной соли (обычно
1 н р-р CH3COONa)-гидролитическая кислотность.
Обменную
кислотность оценивают
по величине рН солевой вытяжки. Для
кол-венного определения кислотности
солевую вытяжку титруют р-ром щелочи.
В случае обработки почвы р-ром KCl возможны
следующие р-ии обмена катионов
почвенно-поглощающего
комплекса (ППК):
HCl+NaOH=NaCl+H2O,
AlClO3+3NaOH=3NaCl+Al(OH)3.В
дальнейшем при титровании солевой
вытяжки р-ром NaOH в реакцию вступают HCl
и AlCl3. Ионы Al3+,
выделенные из почвенно-поглощающегокомплекса
в р-р, оказывают влияние на степень
кислотности, посколько в водных фазах
образуются ионы Al(OH)2+
и Al(OH)2+.
Процесс ионного обмена при обработке
почвы р-ром CH3COONa
можно представить ур.:ППК-H+
+ CH3COONa
=ППК-Na+
+ CH3COOH.
Для
почв хар-ен самопроизвольный переход
от насыщения катионами Н+ к насыщению
Аl3+. Так, любые почвы можно насытить
катионами Н+ и перевести их в состояние,
когда в составе обменных катионов будут
преобладать катионы водорода. Со временем
в такой почве в составе обменных катионов
появятся катионы Аl3+, кол-во которых
постепенно будет увеличиваться.
Поглотительная
способность почвы (ПС)-это
св-во поглощать (задерживать в себе)
газы, жидкости, солевые р-ры и тв частицы.
Различают 5 видов поглотительной
способности почв: механическую,
физическую, хим., биологическую и
физикo-хим.
Механич.
ПС-св-во
задерживать взвешенные частицы в
процессе фильтрации H2O через почву. В
р-те процесса механического поглощения
в пойменных и орошаемых почвах образуется
наилок, происходит очистка сточных вод
от грубых примесей на полях фильтрации
при миграции по профилю глинистых и
коллоидных частиц, образуется иллювиальный
горизонт. Физич.
ПС.-изменение
С р-ренного в-ва в слое р-ра, пограничном
с тв фазой почвы, обусловленное действием
физических сил. Почвенные коллоиды
способны адсорбировать на своей
поверхности анионы и катионы почвенного
р-ра и диполи H2O. В почвах наиболее часто
происходит увелич. конц. р-ренных
компонентов в поверхностном слое. Однако
возможно и уменьшение конц. компонентов,
например анионов, вблизи коллоидных
частиц и увеличение их содержания в
фильтрующемся р-ре. В р-те протекания
этого процесса возможна потеря питательных
компонентов почвы. Хим.
ПС.-образование
нер-римых или малор-римых солей в
почвенных р-рах. Очень часто эта
способность почв проявл. в карбонатном
горизонте при образовании кальцита-СаСО3.
При внесении в почву фосфорных удобрений
возможно образование нер-римых солей
Fe
или Ca.
Биолог.
ПС.-поглощение
различных в-в. из почвенного р-ра живыми
организмами. Существенной особенностью
этого процесса явл. избирательное
поглощение определенных, наиболее
важных для жизнедеятельности организмов
в-в. Благодаря этой избирательной
биологической способности растений в
верхних горизонтах почвы вместе с
гумусом аккумулируются многие биогенные
элементы. Физико-хим.
(или обменная) ПС-св-во
почвы эквивалентно обменивать ионы
почвенного р-ра и тв фазы почв. На
поверхности частиц тв фазы почв
присутствуют активные центры, имеющие
положительный или отрицательный заряд.
Поэтому по хар-ру ионообменной способности
почвы отнят к амфиболитам. Но практич.
во всех видах почв кол-во активных
центров, имеющих отрицательный заряд,
значительно больше, чем заряженных
положительно, поэтому для почв хар.на
преимущественно катионообменная
способность.
