
Лекция №8. Неметаллы ivа и iiia групп
План лекции:
8.1. Общая характеристика углерода, кремния, германия
8.2. Углерод и его соединения
8.3. Применение углерода и его соединений
8.4. Кремний – важнейший элемент литосферы
8.5. Соединения кремния
8.6. Силикаты и их применение
8.7. Бор, нахождение в природе, физические и химические свойства.
8.8. Соединения бора.
8.9. Применение бора и его соединений.
Общая характеристика углерода, кремния, германия
В состав элементов IVА группы входят неметаллы углерод, кремний и германий, который считается полуметаллом. Углерод и кремний – типические элементы малых периодов. Германий – элемент большого периода, на предвнешнем энергетическом уровне которого находится 10 d-электронов, следствием их влияния на валентные электроны является большее, чем у кремния значение электроотрицательности. От углерода к германию энергия ионизации уменьшается, атомный радиус увеличивается, усиливаются металлические свойства. Эти элементы проявляют степени окисления -4, +2, +4 (см. табл. 1).
Таблица 1.
Свойства неметаллов IVA группы
Неметаллы: |
C |
Si |
Ge |
Валентная электронная структура |
2s22p2 |
3s23p2 |
4s24p2 |
Радиус атома, нм |
0,077 |
0,133 |
0,139 |
Энергия ионизации (I1), эВ |
11,26 |
8,15 |
7,899 |
Электроотрицательность (ОЭО) |
2,6 |
1,8 |
2,0 |
Степени окисления в соединениях |
-4, +2, +4 |
-4, +2, +4 |
-4, +2, +4 |
Плотность, г/см3 |
3,51 (алмаз) |
2,33 |
5,72 |
Температура плавления, оС |
3247 |
1415 |
937 |
Температура кипения, оС |
3927 |
3249 |
2847 |
9.2. Углерод и его соединения
Углерод в природе встречается в свободном (алмаз, графит) и в связанном виде (карбонаты, нефть, горючие сланцы, янтарь, природный газ, углекислый газ атмосферы и др.). Содержание углерода в земной коре составляет 1% по массе.
Известно несколько аллотропных модификаций углерода. Они отличаются строением кристаллической решетки вследствие разной гибридизации валентных орбиталей атома углерода.
Алмаз – бесцветное прозрачное кристаллическое вещество с очень высоким показателем преломления света и самой высокой твердостью. Структура алмаза определяется sp3-гибридизацией орбиталей атомов углерода. Четыре гибридные орбитали направлены в пространстве к вершинам тетраэдра под углом 109о28'. Перекрыванием гибридных облаков соседних атомов углерода образуются σ-связи. Каждый атом углерода образует четыре σ-связи с четырьмя соседними атомами (рис.1). Будучи термодинамически неустойчивым алмаз при высокой температуре в инертной атмосфере без плавления превращается в графит.
Лансдейлит – модификация, кристаллическая решетка которой образована атомами углерода, находящимися также в состоянии sp3-гибридизации. Отличие от алмаза состоит в строении кристаллической решетки лансдейлита. Лансдейлит найден в метеоритах, и получен искуственно при высоких давлениях и температуре 900оС.
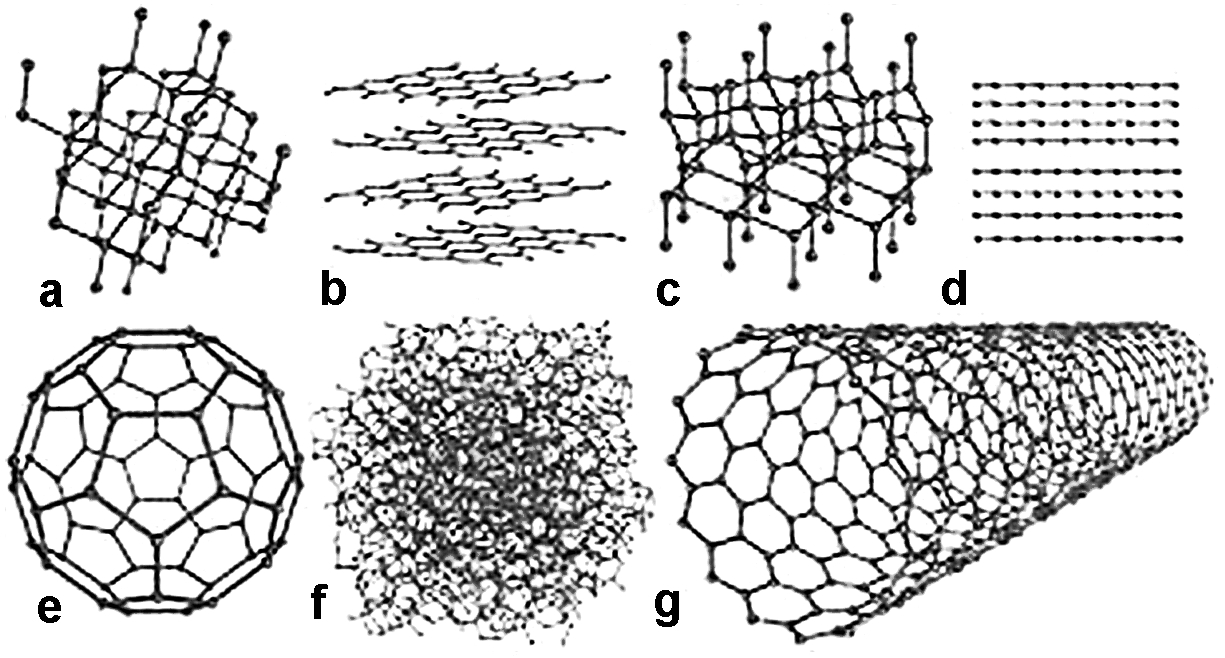
Рис. 1. Кристаллические решетки: а- алмаза, b-графита, c-лансдейлита, d-карбина, e-фуллерена, f-аморфного углерода, g-углеродной нанотрубки.
Графит – черное либо серое с металлическим блеском, очень мягкое, жирное на ощупь кристаллическое вещество, проводящее электрический ток. Атомы углерода в состоянии sp2-гибридизации образуют слои правильных шестиугольников, которые определяют слоистую структуру углерода. Кроме σ-связей между атомами углерода имеются делокализованные по всему слою π-связи, образованные негибридными p-орбиталями, что повышает прочность связей между атомами. Слои графита между собой связаны слабыми Ван-дер-Ваальсовыми силами, это объясняет способность графита расслаиваться на чешуйки. Переход термодинамически устойчивого графита в алмаз осуществляется при температуре около 1800 - 2700оС и давлении 6 - 12 ГПа на расплавленном металле в качестве катализатора.
Отдельные слои атомов углерода − графен. Идеальная кристаллическая структура графена представляет собой гексагональную кристаллическую решётку (рис.2). Это первый известный двумерный кристалл обладает рядом уникальных свойств, требуемых для развития нанотехнологий: высокой проводимостью, теплопроводностью, прочностью. За получение графена Андрей Гейм и Константин Новоселов получили нобелевскую премию в 2010 году.

Рис.2. Строение кристаллической решетки графена
При сворачивании в трубку графеновых плоскостей получаются углеродные нанотрубки – протяженные цилиндрические структуры диаметром от одного до нескольких десятков нанометров, заканчивающиеся полусферической головкой, которую можно рассматривать как половину молекулы фуллерена.
Фуллерены – вещества черного цвета с металлическим блеском и полупроводниковыми свойствами. Кристаллические решетки фуллеренов − молекулярные, в отличие от атомных у остальных модификаций углерода. Молекулы имеют форму полой сферы, образованной 60, 70, 540 и др. четным числом атомов углерода, находящихся в sp2-гибридизации. Важным фактором является отсутствие у этих молекул концевых атомов, которые у других модификаций обычно связаны, например, с кислородом или водородом. В природе фуллерены встречаются в минерале шунгите. Искусственно их получают испарением графита под действием лазера в атмосфере гелия.
Аморфный углерод (каменный уголь, активированный уголь, кокс, сажа и т.д.) состоит из мелких кристаллов, имеющих строение графита.
Карбин – кристаллы белого цвета или черный порошок, с полупроводниковыми свойствами. Образованы линейными молекулами, состоящими из атомов углерода, орбитали которых находятся в состоянии sp-гибридизации. В молекулах чередуются одинарные и тройные связи (α-карбин) или все связи между атомами углерода двойные (β-карбин). Карбин получен искусственно путем каталитического окисления ацетилена, в природе встречается в виде минерала чаоита.
Аллотропные модификации углерода несколько отличаются друг от друга по химическим свойствам, однако всем им присуща инертность при обычных условиях и восстановительная активность при повышенных температурах. Остановимся на свойствах самой распространенной формы углерода – аморфной.
Окислительные свойства углерода проявляются в реакциях с а) водородом (600оС, p, кат.-Pt); б) металлами:
а) C+ 2H2 = CH4
(метан)
б) 3C + Fe = Fe3C,
(карбид железа)
2C + Ca = CaC2,
(карбид кальция)
4Al + 3C = Al4C3 .
(карбид алюминия)
Более характерны для угля восстановительные свойства, проявляемые при высоких температурах в реакциях с неметаллами:
С + О2 = СО2;
C + 2S = CS2.
Некоторые соединения углерода и их свойства рассмотрены ниже.
Сероуглерод CS2 - летучая жидкость, почти не растворяется в воде, является прекрасным растворителем для жиров, смол, серы, фосфора и йода.
При температуре электрической дуги углерод соединяется с азотом, образуя циан C2N2 – бесцветный ядовитый газ с резким запахом миндаля, хорошо растворим в воде. При взаимодействии с водородом циан образует циановодород HCN:
C2N2 + H2 = 2HCN.
Циановодород смешивается с водой в любых соотношениях, образуя слабую ядовитую циановодородную (синильную) кислоту.
Углерод взаимодействует с фтором, образуя четырехфтористый углерод - CF4. Соединения с остальными галогенами получают косвенным путем, например:
CS2 + 2Cl2 = CCl4 + 2S.
Четыреххлористый углерод CCl4 – инертная жидкость, почти не растворимая в воде, прекрасный растворитель жиров, масел, смол, красок.
Углерод взаимодействует со сложными веществами: оксидами металлов (Fe, Zn, Cu, Pb), водой, кислотами-окислителями, например:
C + 2PbO = 2Pb + CO2,
С + Н2О D СО + Н2
(водяной газ)
C + 4HNO3 = CO2 + 2H2O + 4NO2.
Оксид углерода (II) СО – бесцветный газ, тяжелее воздуха, мало растворим в воде, ядовит. С гемоглобином крови образует более прочное соединение, чем кислород, поэтому препятствует переносу O2 в организме.
В молекуле СО тройная химическая связь, поэтому при обычных условиях он инертен. Оксид углерода (II) является несолеобразующим оксидом, он не вступает в реакции обмена с водой, кислотами и щелочами. В окислительно-восстановительных реакциях проявляет восстановительные свойства. При высоких температурах (а) восстанавливает металлы из их оксидов, что используется при выплавке металлов из руд; (б) горит в кислороде; (в) присоединяет серу, (г) галогены, (д) с аммиаком образует мочевину:
а) CuO + CO = Cu + CO2;
б) 2CO + O2 = 2CO2;
в)CO + S = COS;
г) CO + Cl2 = COCl2 (фосген – боевое отравляющее вещество).
д) CO + 2NH3 =Pt H2 + CO(NH2)2 .
(мочевина)
Большое практическое значение имеет синтез органической веществ (спиртов, альдегидов, кетонов, органических кислот) на основе оксида углерода и водорода, например:
CO + 2H2 = CH2OH
(метиловый спирт)
Неподелённые электронные пары углерода и кислорода делают СО лигандом, способным образовывать прочные карбонильные комплексы с переходными металлами, например: [Ni(CO)4], [Fe(CO)5], [Co2(CO)9]. Карбонилы образуются при повышенных температурах и давлениях. Они находят свое применение в качестве активных катализаторов, при их термическом разложении получают чистые металлы.
Образуется оксид углерода в процессе горения угля при недостатке кислорода:
2C + O2 = 2CO.
В промышленности его получают, пропуская углекислый газ над раскаленным углем:
CO2 + C = 2CO.
Эта же реакция имеет место при неполном сгорании автомобильного топлива, в бытовых печах при преждевременном перекрывании дымохода, отсюда бытовое название СО – «угарный газ».
В лаборатории оксид углерода получают реакцией дегидратации муравьиной или щавелевой кислоты в присутствии концентрированной серной кислоты в качестве водоотнимающего средства:
H2SO4
H COOH
CO
+ H2O,
COOH
CO
+ H2O,
H2C2O4 → CO + CO2 + H2O.
Оксид углерода (IV) или углекислый газ CO2 – бесцветный газ, тяжелее воздуха, не поддерживает дыхания и горения (ОС № 9.1). Может скапливаться в опасных количествах в шахтах и колодцах. При 20оС и давлении 5,7 МПа сжижается, и транспортируется жидким в стальных баллонах. При понижении температуры кристаллизуется, образуя твердый «сухой лед», который сублимируется при -78оС.
Линейная молекула углекислого газа неполярна, так как дипольные моменты двух связей С=О, направленные навстречу друг другу, взаимно компенсируются. Неполярные молекулы плохо растворимы в полярных растворителях, так в 1 л воды при 20оС растворяется 0,9 л CO2.
В природе углекислый газ образуется при дыхании живых организмов, разложении гниющих остатков, спиртовом брожении:
C6H12O6 = 2C2H5OH + 2CO2.
В лаборатории углекислый газ получают в аппарате Кипа действием соляной кислотой на мрамор:
CaCO3 + 2HCl = CO2↑ + CaCl2.
В промышленности углекислый газ получается при сжигании угля (а), углеводородов (б), обжиге известняка (в):
а) C + O2 = CO2,
б) CH4 + 2O2 = CO2 + 2H2O,
в) CaCO3 =t CaO + CO2.
Углерод в молекуле CO2 находится в высшей положительной степени окисления, поэтому углекислый газ в реакциях с сильными восстановителями проявляет окислительные свойства, например, активный металл магний горит в атмосфере углекислого газа:
CO2 + Mg = MgO + C.
Углекислый газ – кислотный оксид. Он взаимодействует с основными оксидами и сильными основаниями:
CO2 + CaO = CaCO3 ;
(карбонат кальция)
CO2 + NaOH = NaHCO3.
(гидрокарбонат натрия)
С водой оксид углерода (IV) образует непрочную угольную кислоту:
CO2 + H2O D H2CO3.
Равновесие этой реакции сильно смещено влево. Большая часть растворенных молекул CO2 остается в молекулярном состоянии.
Угольная кислота H2CO3 − слабая двухосновная кислота, диссоциирующая ступенчато:
H2CO3 D H+ + HCO3-; K1 = 4,2·10-7;
HCO3- D H+ + CO32-; K2 = 4,8·10-11.
Угольная кислота при нагревании разлагается на углекислый газ и воду.
Карбонаты (Na2CO3, CaCO3) и гидрокарбонаты (NaHCO3, CaHCO3) − два ряда солей, которые образует угольная кислота. В отличие от самой кислоты её соли устойчивы. Хорошо растворимы карбонаты щелочных металлов, аммония и талия (I). Карбонаты других металлов малорастворимы. Все гидрокарбонаты достаточно хорошо растворимы. Карбонаты щелочных металлов в растворе гидролизуются по аниону, поэтому реакция среды в их растворах щелочная (pH>7):
CO32- + H2O D HCO3- + OH-.
Растворы гидрокарбонатов имеют меньшее значение pH, поскольку гидролиз протекает в незначительной степени. Получить гидрокарбонат можно действием избытка углекислого газа на осадок карбоната:
CaCO3 + CO2 + H2O = Ca(HCO3)2.
Гидрокарбонаты при нагревании разлагаются с выделением углекислого газа:
2NaHCO3 =t Na2CO3 + CO2 + H2O
Карбонаты щелочно-земельных и d-металлов разлагаются на оксиды при достаточно высоких температурах:
CaCO3 =t CaO + CO2.
В природе встречаются карбонаты: CaCO3 – кальцит (мел, мрамор, известняк), MgCO3 – магнезит, MgCO3·CaCO3 – доломит, CuCO3·Cu(OH)2 – малахит.
