
- •Раздел 1. Введение в курс.
- •Раздел 2. Разработка химической концепции метода.
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Зависимость константы скорости элементарной реакции от температуры
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Катализаторы синтеза аммиака.
Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
Приравняв значения ΔG° из уравнений Гиббса-Гельмгольца и Вант-Гоффа получаем: ΔН° – ТΔS° = – RT lnK.
Считаем,
что значения ΔH0
и ΔS0
химической реакции не зависят от
температуры (первое
приближение):
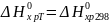 ;
;
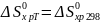
Выразив
из уравнения lnKp,
получаем функцию линейного вида
относительно 1/T:
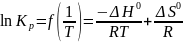
Уравнение аналогично функции y = ax + b,
где
у = lnKp,
а =
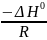 ,
х =
,
х =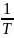 ,
в =
,
в =
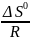
Найдем точки пересечения графика функции lnKp = f ( ) с осями координат:
а)
с осью абсцисс: lnKp
= 0 →
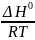 =
→
T =
=
→
T =
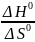
б) с осью ординат: = 0 → lnKp =
в) тангенс угла наклона прямой и оси абсцисс: tgα =
Рассмотрим различные варианты зависимости .
Отметим, что в рассматриваемых ниже графических зависимостях физический смысл имеет только правая часть графика - при положительных значениях абсолютной температуры.
2.3. Принцип Ле-Шателье. Качественная оценка условий проведения процесса. Влияние температуры, давления, соотношения исходных реагентов, наличия инертных примесей на смещение химического равновесия.
Качественная оценка условий проведения процесса.
В целом, термодинамический анализ позволяет выбрать условия проведения процесса, определить те ограничения, которые накладываются на условия проведения процесса термодинамикой.
П риёмы
смещения равновесия.
риёмы
смещения равновесия.
1) Влияние температуры
2) Влияние соотношения реагентов на их степень превращения (выход продукта)
2.1) Один из реагентов в избытке
3) Влияние величины давления а) Понижение давления б) Повышение давления в) Введение инертного компонента
4) Вывод продукта из зоны реакции

При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = – RTlnK (2)
2.4. Использование законов химической кинетики при разработке ХТП. Понятие элементарных реакций, простых по механизму и стехиометрии реакции. Закон действия масс. Кинетические уравнения. Влияние температуры и концентрации реагирующих веществ на скорость процесса. Кинетика сложных гомогенных процессов. Влияние температуры и концентраций исходных веществ на дифференциальную селективность. Кинетика гомогенного окисления оксида азота(II) в оксид азота(IV). Особенности кинетики обратимых эндо- и экзотермических реакций.
Кинетика – раздел физической химии, который посвящён изучению закономерностей протекания реакции во времени или влияния разных факторов на скорость химического превращения. Кинетика является мощным инструментом изучения механизмов реакции. Кинетическая модель – совокупность уравнений, описывающих поведение системы во времени или зависимости скоростей образования или превращения веществ от состава смеси, давления, температуры. Наличие кинетической модели необходимо для: 1) Оптимизации процесса 2) Расчёта оборудования 3) Разработки системы управления Модели бывают: эмпирические и структурные.
Понятие элементарной реакции
Э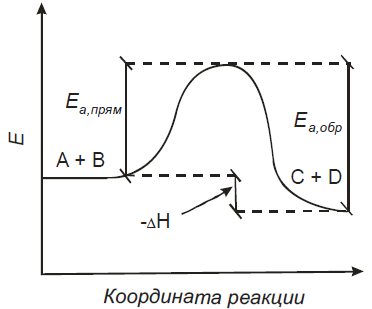 лементарной
реакцией
(элементарной стадией) называют
совокупность одинаковых элементарных
актов химического взаимодействия.
лементарной
реакцией
(элементарной стадией) называют
совокупность одинаковых элементарных
актов химического взаимодействия.
Под элементарным актом химического взаимодействия понимают превращение одной или нескольких молекул, в ходе которого система преодолевает один энергетический барьер в одном направлении. Промежуточных продуктов при этом не образуется. Высшая точка на энергетической кривой соответствует переходному состоянию от исходных веществ к конечным веществам. Это состояние называют также активированным комплексом.
Отметим, что ΔНх.р. = Еакт. прям. - Еакт. обр.
Для данного случая (рис. 3.2) ΔНх.р.˂ 0, реакция экзотермическая.
Простые по механизму и стехиометрически простые реакции
Простая
по механизму реакция
состоит из двух
элементарных реакций,
протекающих в противоположных
н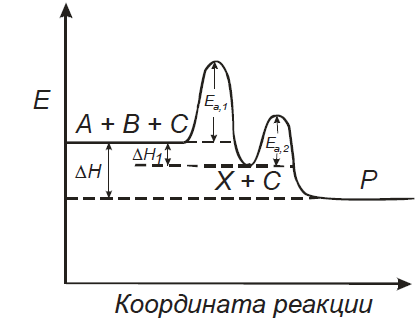 аправлениях,
и, так же как элементарная стадия, не
имеет промежуточных соединений.
Превращение в прямом и обратном
направлении в простой реакции происходит
через одно переходное состояние.
Элементарные и простые по механизму
реакции в «чистом виде» встречаются
редко.
аправлениях,
и, так же как элементарная стадия, не
имеет промежуточных соединений.
Превращение в прямом и обратном
направлении в простой реакции происходит
через одно переходное состояние.
Элементарные и простые по механизму
реакции в «чистом виде» встречаются
редко.
Если превращения в системе можно описать одним уравнением, то говорят о стехиометрически простой реакции. По существу, реакция может проходить через какие-то промежуточные стадии, но если в условиях данного процесса концентрации промежуточных продуктов малы, и они не учитываются в материальном балансе, то реакция будет считаться стехиометрически простой (все превращения в системе описываются одним уравнением).
Энергетическая диаграмма подобной стехиометрически простой, но сложной по механизму реакции может выглядеть следующим образом. Стехиометрическое уравнение этой реакции: А + В + С = Р
С корость
химической
реакции по i –тому веществу (ri)
в гомогенной системе определяется как
количество
вещества,
реагирующее или образующееся в
единицу времени в единице объема фазы
V,
в которой происходит химическое
превращение (при V = const):
корость
химической
реакции по i –тому веществу (ri)
в гомогенной системе определяется как
количество
вещества,
реагирующее или образующееся в
единицу времени в единице объема фазы
V,
в которой происходит химическое
превращение (при V = const):
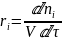
Для реагентов производная - отрицательна, а для продуктов – положительная, ni - количество молей вещества, τ - время.
Для
процессов, протекающих при постоянном
объеме в закрытой
системе:
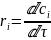 ,
где сi
– молярная концентрация вещества,
моль/л.
,
где сi
– молярная концентрация вещества,
моль/л.
Скорость реакции является функцией параметров системы: давления, концентраций реагентов, продуктов, катализатора, если он есть, и температуры. Для систем при постоянном объеме эти параметры связаны между собой так, что давление является вполне определенным, если заданы температура и концентрации компонентов.
Элементарную реакцию от сложной (по механизму) отличает отсутствие промежуточных продуктов. Скорость элементарной реакции может быть описана законом действия масс. Для реакции (аА + вВ → сС + dD) уравнение:
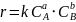
Скорость элементарной реакции пропорциональна концентрациям реагентов в степенях, равных их стехиометрическим коэффициентам в уравнении реакции. Для газофазных реакций вместо концентраций используют парциальные давления веществ. Коэффициент пропорциональности – константа скорости элементарной реакции.
Зависимость константы скорости элементарной реакции от температуры описывают уравнением Аррениуса.
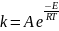
где А – предэкспоненциальный член, Е – энергия активации, R – газовая постоянная, Т – абсолютная температура.
Э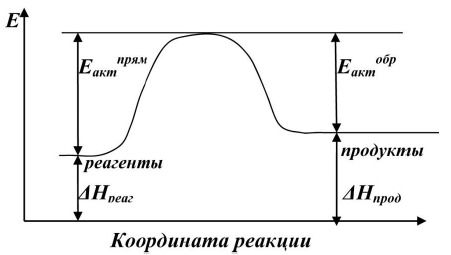 нергия
активации равна
той избыточной
энергии,
которой должны обладать
молекулы,
чтобы они могли прореагировать
друг с другом. Величина энергии активации
соответствует энергетическому барьеру
как для прямой – Епрям,
так и для обратной реакции – Еобр.
нергия
активации равна
той избыточной
энергии,
которой должны обладать
молекулы,
чтобы они могли прореагировать
друг с другом. Величина энергии активации
соответствует энергетическому барьеру
как для прямой – Епрям,
так и для обратной реакции – Еобр.
В случае экзотермической реакции Епрям. < Еобр. Для эндотермической реакции соответственно наоборот.
Эндотермическая
