
- •Раздел 1. Введение в курс.
- •Раздел 2. Разработка химической концепции метода.
- •Анализ зависимостей изменения константы равновесия от температуры при различных знаках ∆н и ∆s реакции.
- •Качественная оценка условий проведения процесса.
- •Зависимость константы скорости элементарной реакции от температуры
- •Раздел 3. Химическое производство как химико-технологическая система (хтс).
- •Раздел 4. Основные принципы разработки хтс и способы их реализации.
- •Избыток реагентов ускоряет как химическую, так и диффузионную стадии процессов.
- •Подавление побочных реакций.
- •Раздел 5. Реализация основных принципов разработки и организации хтс на примерах конкретных производств.
- •Катализаторы синтеза аммиака.
Раздел 1. Введение в курс.
Химическая технология как наука о промышленных способах переработки сырья в продукты потребления и средства производства. Краткие сведения об истории развития химической промышленности и химической технологии России.
Технология – это совокупность методов, приёмов, устройств, аппаратов, используемых для превращения, обработки веществ и материалов с целью получения веществ и материалов, обладающих полезными свойствами.
Химическая технология – это наука о способах переработки сырьевых и техногенных материалов в целевые продукты, реализуемых с использованием химических превращений.
История химико-технологического образования
Слово «технология» было предложено немецким ученым, профессором Геттингенского университета Иоганном Бекманом в 1772 г.
Первый учебник по химической технологии – Иоганн Фридрих Гмелин 1795 г. «Руководство по технической химии»
В 1803г. перевод этого учебника на русский язык - Василий Михайлович Севергин- «Химические основания ремёсел и заводов».
Первый российский учебник (1807-1808 гг) – профессор Московского университета Иван Алексеевич Двигубский «Начальные основания технологии или краткое показание работ, на заводах и фабриках производимых».
1828 г. Фёдор Алексеевич Денисов «Пространное руководство к общей технологии или к работам, на заводах и фабриках производимых». В этом учебнике впервые были обобщены приемы и процессы, применяемые в химической технологии.
С начала XIX века химическая технология стала обязательным предметом, преподававшимся в высших как технических, так и в экономических учебных заведениях, и неотъемлемым элементом высшего технического образования. До научного этапа химической технологии способы получения различных веществ разрабатывались только эмпирическим путем.
История производства серной кислоты
Первое упоминание о серной кислоте: арабский ученый Джабир ибн Хайям использовал серную кислоту в качестве катализатора дегидратации этилового спирта (VIII в. н.э):
2С2Н5ОН → (С2Н5)2О + Н2О
В «донаучную эпоху» (до начала XVI в.) серную кислоту получали термическим разложением железного купороса в присутствии воздуха при нагревании:
FeSO4 ·7H2O + О2 → Fe(OH)SO4 + Fe2(SO4)3 + Fe2O3 + H2O + SO3
Пары серного ангидрида и воды конденсировали на выходе из реакционного сосуда с получением концентрированной серной кислоты. К плюсам данного метода можно отнести то, что железный купорос присутствует в природе в виде минерала мелантерита, но этот способ чрезвычайно неэффективный и годится для получения только небольших количеств серной кислоты.
В 1666 г. европейские ученые Никола Лемери и Николя Лефевр заложили основы камерного способа получения серной кислоты. По этому методу брали самородную серу, добавляли селитру и нагревали в присутствии воздуха и воды.
Процесс был реализован в Бирмингеме (Англия) в 1746 г. Дж. Робеком. Сначала сера окислялась до сернистого ангидрида, а затем до серного ангидрида, который и поглощался водой.
S + 1,5O2 + H2O = H2SO4
Долгое время не была понятна роль селитры в этом процессе. Эмпирически было уставлено сильное влияние присутствия селитры в реакционной смеси на скорость процесса. Только в начале XIX века ученые Николя Клеман и Шарль-Бернар Дезорм поняли механизм действия селитры в этом процессе. Суть в том, что при нагревании в присутствии серной кислоты селитра разлагается с образованием кислого сульфата натрия, оксидов азота и кислорода:
NaNO3 + Н2SO4 → NaHSO4 + HNO3
2HNO3 → NO2 + O2 + H2O + NO
SO2 + NO2 = SO3 + NО
2NO + O2 = 2NO2
В 1831 г. английский исследователь Филлипс получил патент на получение серного ангидрида окислением сернистого ангидрида кислородом воздуха в присутствии платины и последующим получением собственно серной кислоты. Платина очень эффективный катализатор этого процесса, который позволяет проводить процесс при сравнительно невысоких температурах (примерно 250 - 3000С), но этот катализатор легко отравляется примесями, содержащимися в исходном газе, полученном обжигом пирита (серного колчедана). Именно нестабильность, неустойчивость платинового катализатора была препятствием к использованию этого способа. Однако платину в качестве промышленного катализатора использовали сравнительно недолго, так как в начале XX века одновременно в нескольких странах было установлено, что хорошим катализатором для данного процесса является смешанный оксидный катализатор на основе V2O5 . Существует много вариантов этого катализатора, который оказался значительно стабильнее по отношению к каталитическим ядам, чем платина, и существенно дешевле. До настоящего времени именно катализаторы такого типа широко применяются в производстве серной кислоты. Таким образом, процесс развивался более 400 лет и будет развиваться в дальнейшем.
Перспективы и основные направления развития химической промышленности на современном этапе: безотходные (малоотходные) производства, технологическое комбинирование, энергосберегающие технологии, агрегаты большой единичной мощности, новые методы интенсификации химикотехнологических производств.
Понятие химико-технологического процесса (ХТП) В основе химической технологии всегда лежит ХТП. ХТП – это совокупность химических, физических и физико-химических процессов, направленных на превращение сырья или техногенных материалов в так называемые целевые продукты, т.е. продукты, обладающие определёнными потребительскими свойствами. ХТП состоит из трёх главных составляющих, обычно изображаемых в виде триады.
Основные принципы организации химических производств
1.Принцип наилучшего использования сырья
2.Принцип максимальной интенсивности процесса
3.Принцип наилучшего использования энергии
4.Принцип экологической безопасности
5.Принцип технологической соразмерности
Современные тенденции развития химической промышленности
Сокращение количества отходов и создание безотходных (малоотходных) производств;
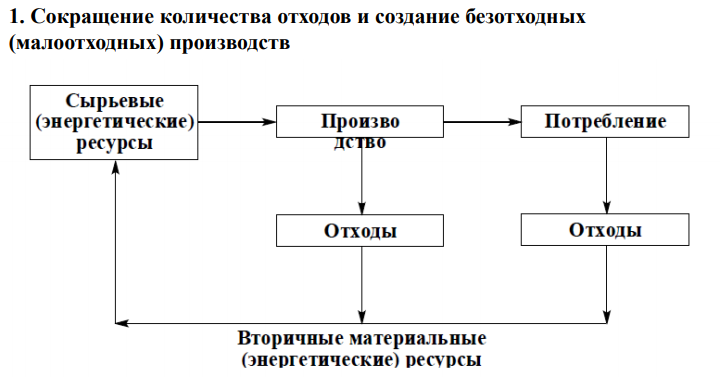
В химической технологии основными причинами образования отходов производства являются: - наличие примесей в сырье; - неполнота превращения реагентов в целевые продукты; - протекание побочных реакций; - образование побочных продуктов в основных реакциях. Следовательно, для сокращения количества отходов и создания малоотходных производств необходимо максимальное совершенствование химико- технологических процессов. Одним из наиболее эффективных приемов уменьшения количества отходов является повышение эффективности каталитических процессов за счет повышения качества катализаторов.
Комплексное использование сырья;
Например, практически все фракции нефти, включая попутные газы, бензин, керосин, лигроин, мазут и т.д., а также твердый остаток, находят свое применение. Рудные полезные ископаемые тоже необходимо использовать в максимальной степени. Например, свинцово-цинковые руды содержат 25 элементов, и на их основе производится около 40 товарных продуктов. В медно-никелевых рудах содержатся 18 компонентов, и они тоже в основном используются.
Совершенствование методов выделения целевых продуктов и очистки всех потоков;
Современное экологическое законодательство достаточно жесткое, и требования к чистоте газообразных, жидких и твердых отходов все время возрастают. Если мы более полно выделяем из отходящих газов ценные компоненты, одновременно улучшается экономика процесса и уменьшается давление на окружающую среду.
Комбинирование производств;
Первый случай комбинирования - на основе комплексного использования сырья, то есть когда сырье имеет сложный состав и необходимо выделить и использовать максимальное количество его компонентов. В этом случае параллельно на одной производственной площадке должно быть развернуто производство целого ряда продуктов. Второй случай комбинирования – последовательное комбинирование, когда при производстве какого-либо продукта на данном производстве из него производятся другие продукты (товары). Обычно на одном комбинате соединяют производства нескольких продуктов. Третий случай комбинирования – переработка побочных продуктов.
Повышение степени энергосбережения.
Проблема использования энергетических ресурсов в химической промышленности имеет ресурсосберегающий, экономический и экологический аспекты. Основными видами энергоресурсов, используемых в химической промышленности, являются тепловая энергия (48%), электроэнергия (44%), топливо прямого использования (8%) . Проблема энергосбережения связана с увеличивающимся количеством народонаселения и опережающим возрастанием потребления энергоресурсов:. В основном используют невозобновляемые горючие ископаемые – нефть, газ, уголь. Экономический аспект проблемы связан с тем, что доля стоимости энергии в себестоимости химической продукции достигает в некоторых производствах 60%. Поскольку стоимость энергоносителей ежегодно возрастает, без энергосбережения химические производства становятся нерентабельными. И, наконец, экологический аспект проблемы связан с низким коэффициентом использования энергии (менее 40 %), что приводит к попаданию в окружающую среду ≈ 60 % потребляемой энергии (к тепловым выбросам). Прежде всего, это тепло дымовых газов; тепло, выделяемое оборотной водой и воздушным охлаждением; потери тепла в окружающую среду через теплоизоляцию помещений, аппаратов, коммуникаций.
Создание агрегатов большой единичной мощности
Один большой реактор, в котором непрерывно, в стационарном режиме производится большое количество продукции, более экономичен, чем например десяток меньших, вследствие снижения, в первую очередь, доли условнопостоянных затрат. И большой, и маленький агрегат обслуживается соизмеримым количеством работников, одинаковы затраты на содержание административного аппарата и т.п., поэтому себестоимость продукции, получаемой в агрегатах большой единичной мощности, оказывается существенно ниже. В принципе такие аппараты дают самый дешевый продукт. Дополнительный выигрыш получается также в результате концентрирования энергии. Многие из этих процессов являются экзотермическими и использование выделяющегося тепла дает дополнительный выигрыш. Доля потерь тепла в окружающую среду для большого агрегата существенно меньше, чем для маленького, энергия меньше рассеивается и может быть более эффективно использована.
Интенсификация ХТП
Интенсификация ХТП может реализоваться за счет использования традиционных и нетрадиционных методов технологии (традиционные методы интенсификации ХТП обсуждаются в последующих лекциях).
Нетрадиционные методы
1)Плазмохимические методы (проведение реакции в плазме в ионизированном газе)
2)Механохимия (механическое воздействие на реагенты при протекании химической реакции)
3)Сонохимия (применение ультразвука для интенсификации химических реакций)
4)Процессы с использованием УФ-облучения
Возможность реализации химического процесса в промышленном масштабе определяется следующими требованиями:
- принципиальная осуществимость процесса, определяемая термодинамическим анализом;
- возможность получения высокого выхода продукта, что дает анализ равновесного состояния химической системы и стехиометрические расчеты;
- высокая интенсивность процесса: получение большого количества продукта в единицу времени, т.е. большая скорость процесса или возможность его ускорения, определяемая кинетическими исследова-ниями;
- достаточно высокая селективность процесса, определяющая рациональное использование сырья;
- предельный минимальный расход энергии, устанавливаемый термохимическими расчетами.
