
12
.docxПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ

МИНИСТЕРСТВО НАУКИ и высшего образования РОССИЙСКОЙ ФЕДЕРАЦИИ
федеральное государственное бюджетное образовательное учреждение
высшего образования
«САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»
Кафедра общей технической физики
Отчет по лабораторной работе №12
По дисциплине Физика
(наименование учебной дисциплины согласно учебному плану)
Тема: исследование эффекта Джоуля-Томсона при адиабатическом истечении газа
Автор: студент гр. СПС-18 ______________ Спиридонова М.А.
(подпись) (Ф.И.О.)
ОЦЕНКА: _____________
Дата:
ПРОВЕРИЛ _доцент _____________ / Ломакина Е.С. /
(должность) (подпись) (Ф.И.О.)
Санкт-Петербург
2019
Цель работы: определить изменение температуры углекислого газа при протекании через малопроницаемую перегородку при разных начальных значениях давления и температуры; вычислить коэффициенты Ван-дер-Ваальса a и b по результатам эксперимента.
Явление изучаемый в работе – эффект Джоуля-Томсона
Определения:
Адиабатическое расширение – процесс расширения газа, при котором не происходит теплообмен с окружающей средой.
Теплообмен – процесс передачи тепла от более горячего тела к более холодному.
Реальный газ – газ, между молекулами которого действуют силы межмолекулярного взаимодействия, состоящие из сил притяжения и сил отталкивания.
Фазовые переходы – термодинамические процессы, приводящие к изменению агрегатного состояния вещества.
Законы и соотношения:
Уравнение
Менделеева-Клайперона –
формула зависимости между давлением,
молярным объёмом и абсолютной температурой
идеального газа.
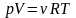
Уравнение
Ван-дер-Ваальса
– формула зависимости между давлением,
молярным объёмом и абсолютной температурой
реального газа
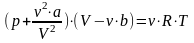
Схема установки

Рисунок 1 – Схема установки
1-трубка
2-пористая перегородка
8-термостатический объём
9-змеевик
5-термопара
7а-индикатор пульта 7
4-дифференциальная термопара
6-индикатор
13-баллон
12-редуктор
10-кран
11-манометр
Основные расчетные формулы
Формула температуры инверсии
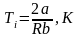 ,
где
,
где
R-молярная
газовая постоянная [R]=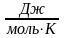
а
и b
– постоянные Ван-дер-Ваальса [a]=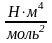 ,
[b]=
,
[b]=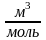
Формула критической температуры
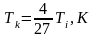 ,
где
,
где
Ti-температура инверсии [Ti]= К
Формула коэффициента Джоуля-Томсона
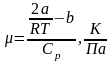 ,
где
,
где
Cp – молярная теплоемкость при постоянном давлении [Cp]= ;
R – молярная газовая постоянная [R]=
Погрешность прямых измерений
ΔΔp=0,05Мпа
ΔT=1оС
ΔΔT=0,01oC
Исходные данные
Углекислый газ
Таблица 1 – Результаты измерений и вычислений
|
|
|

20оС=293 К
50оС=323 К
80оС=353 К
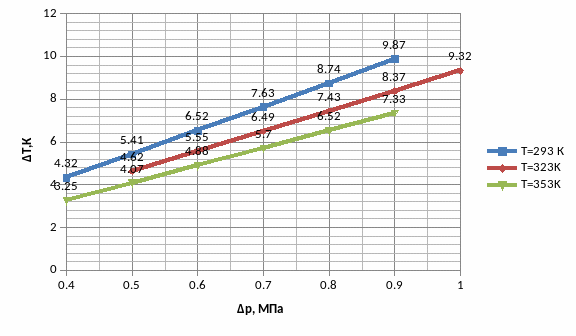
Зависимость прямая. Знак эффекта положительный, так как разность температур до и после пористой перегородки ниже нуля.
По углу наклона прямой
-при
T=293K,
µ=tg(a)=1,110⸱10-5
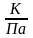
-при Т=323К, µ=0,94⸱10-5
-при Т=353К, µ=0,816⸱10-5
Пример вычисления:
µ=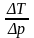
например,
µ1=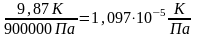
Используя
формулу
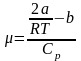 и экспериментальные данные, полученные
при трех значениях температуры, определяем
постоянные a
и b
для углекислого газа по двум парам
температур: Т1,
ΔТ1
и Т2,
ΔТ2.
и экспериментальные данные, полученные
при трех значениях температуры, определяем
постоянные a
и b
для углекислого газа по двум парам
температур: Т1,
ΔТ1
и Т2,
ΔТ2.
T1=293 K, T2=323 K, ΔT1=9,87 K, ΔT2=8,37 K, R=8,31 , Cp=41 , Δp=8⸱105Па.
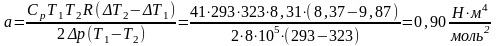
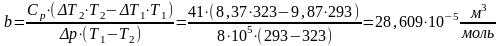
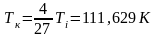
Погрешность косвенных измерений:
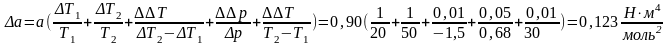
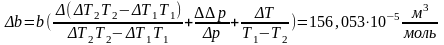
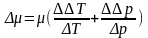
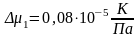
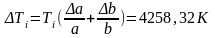
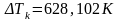

Окончательные результаты:
a=0,90±0,123
b=28,609⸱10-5±156,053⸱10-5
Ti=753,495±4258,320 K
Tk=111,629±628,102 K
Вывод:
Выполнив лабораторную работу на исследование эффекта Джоуля-Томсона при адиабатическом истечении углекичлового газа, эксперементально определил коэффициенты Ван-дер-Ваальса.
Сравнив полученные результаты с табличными видно, что:
-
коэффициент a
отличается от табличного значения на
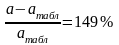
-коэффициент b – на 568%
-Ti
на 63% меньше Тi
=
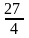 Тк
табл
Тк
табл
-Tk на 63% меньше табличного значения
Из этого следует, что в данной лабораторной работе нельзя точно определить данные величины. Причина этому-погрешность измерительных приборов.
