
Лекции по биохимии РостГМУ / 5. Лекция. Метаболизм ТАГ и ФЛ
.pdf
МЕТАБОЛИЗМ ТАГ И ФЛ
Катаболизм ТАГ
Основным местом накопления ТАГ является жировая ткань (адипоциты).
Жировые клетки выполняют три функции:
1)Синтезируют ТАГ;
2)Хранят ТАГ;
3)ВЖК, находящиеся в составе ТАГ, используются для получения энергии.
Катаболизм ТАГ осуществляется под действием ТАГ-липазы. Конечным продуктом ферментативного гидролиза ТАГ являются: жирные кислоты и глицерол.
Катаболизм ТАГ в адипоцитах и судьба продуктов гидролиза
Судьба жирных кислот
Освободившиеся ЖК поступают в плазму, связываются с альбуминами крови и доставляются в периферические ткани, где они либо окисляются, либо идут вновь для синтеза липидов.
Судьба глицерола
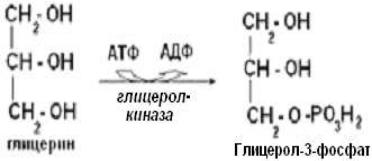
Глицерол, образовавшийся при липолизе, поступает из жировой ткани в кровь и активно утилизируется тканями, в которых активна глицеролкиназа (печень,
почки, кишечник, лактирующая молочная железа). Там глицерол фосфорилируется под действием глицеролкиназы, образуется α-глицерофосфата
(глицерол-3-фосфата), который окисляется в фосфодигидроксиацетон (ДГАФ)
под действием НАД-зависимой глицерол-3-фосфатдегидрогеназы (реакция обратимая).
Далее ДГАФ изомеризуется под действием триозофосфатизомеразы в 3-
фосфоглицероловый альдегид (3-ФГА). 3-ФГА – это промежуточный продукт и гликолиза, и глюконеогенеза. Следовательно, из него может образовываться и ПВК, и глюкоза.
Н2С – ОН |
|
|
Н2С – ОН |
|
|
│ |
АТФ |
АДФ |
│ |
НАД+ |
НАДН+Н+ |
СН – ОН |
|
СН – ОН |
|
ДГАФ |
|
│ |
глицеролкиназа |
│ |
глицерол-фосфат-ДГ |
||
Н2С – ОН |
|
|
Н2С – О – РО32- |
|
|
|
|
|
глюкоза |
|
|
Триозофосфатизомераза |
3 ФГА |
|
ПВК |
||
|
|
|
Схема изомеризации ДГАФ |
||
Возможен также и обратный процесс - образование из глюкозы ДГАФ, его дальнейшее восстановление в α-глицерофосфат (Е – глицерол-3-фосфат ДГ,
реакция обратима), а затем гидролиз α-ГФ под действием глицеролфосфатазы с образованием глицерола.
|
НАД+Н+ |
НАД+ |
|
|
Глюкоза → |
3 ФГА → ДГ АФ |
|
α-ГФ |
глицерол |
|
|
α-ГФ-ДГ |
фосфатаза |
|
|
|
Н2О |
Фн |
|
|
Схема синтеза глицерола |
|
||
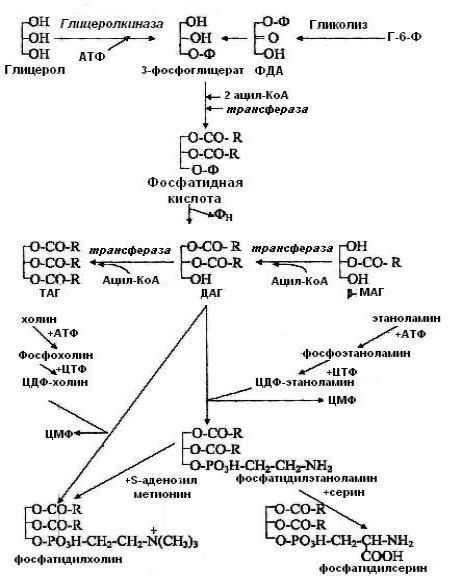
Синтез ТАГ
В животных тканях для биосинтеза ТАГ необходимы ацил-KoA и α-ГФ.
α-ГФ может быть образован из:
2
1) глицерола при участии глицеролкиназы и АТФ, этот глицеролкиназный путь синтеза α-ГФ активен в тех тканях, где высока активность глицеролкиназы
(печень, почки, кишечник, молочная железа); 2) ДГАФ – метаболита гликолиза, который затем в ходе обратимых реакций
превращается в α-ГФ. Такой путь характерен для мышц и жировой ткани, так как в них отсутствует глицеролкиназа или активность фермента очень низка. АцилKoA образуется из ацетил-KoA.
Синтез α-ГФ из глицерола
В биосинтезе ТАГ выделяют три этапа
1.Этерификация (ацилирование) свободных НО-групп α-ГФ двумя молекулами ацил-KoA с образованием фосфатидной кислоты (фермент – ацилтрансфераза или трансацилаза)
2.Гидролиз фосфатидной кислоты с образованием 1,2-ДАГ (фермент –
фосфатаза).
3. Ацилирование 1,2-ДАГ и образование ТАГ (фермент – ацилтрансфераза).
Для энтероцитов более характерен ресинтез ТАГ из β-МАГ (фермент – β-МАГ-
ацилтрансфераза).
Таким образом, субстратами для синтеза ТАГ являются:
1.α-ГФ (из глюкозы или глицерола);
2.Ацил-КоА;
3.В клетках кишечника – β-МАГ.
3
Биосинтез ТАГ (липогенез)
Катаболизм ФЛ в клетке (Не путать с полостным перевариванием в кишечнике!). При полном распаде ФЛ под действием клеточных фосфолипаз А1,
А2, С, D, локализованных в мембранах или лизосомах, образуются: 1) ВЖК; 2)
глицерол; 3) Н3РО4; 4) аминоспирт.
Синтез мембранных липидов (ФЛ)
Основные липиды клеточных мембран – это фосфатидилэтаноламин (ФЭА) и
фосфатидилхолин (ФХ). Они образуются, так же как и ТАГ, из общего промежуточного соединения – 1,2-ДАГ. Для того, чтобы 1,2-ДАГ превратились в ФЛ, им необходимо приобрести группы, образующие "полярные головки": Н3РО4
4
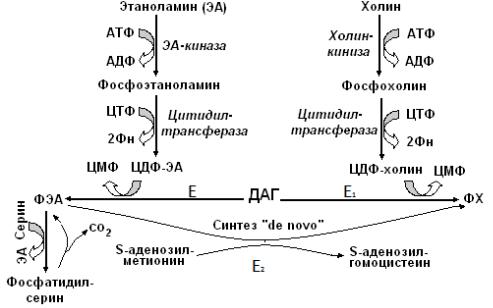
и аминоспирт. Процесс образования ФЛ связан с образованием активных форм аминоспиртов. Для этого используются два макроэрга – АТФ и ЦТФ.
ФХ в организме человека может быть синтезирован двумя путями: 1)
основной путь синтезом «de novo» из фосфатидилэтаноламина, и 2) утилизацией экзогенного холина из пищи.
В первом случае экзогенный холин не требуется. Он образуется в процессе трёхкратного метилирования ФЭА. Донор метильных групп – активная форма метионина – S-аденозилметионин (SАМ), переходящий в S-аденозилгомоцис-
теин. Этот путь может быть блокировании или ограничен при недостатке метионина.
Фосфатидилсерин (ФС) синтезируется путём прямого взаимодействия ФЭА и серина. ФС может декарбоксилироваться с образованием ФЭА.
Путь синтеза ФХ de novo не может покрыть все потребности в нем организма, поэтому необходим экзогенный источник холина и других азотсодержащих компонентов фосфолипидов. В этом случае в синтезе ФЛ используются
активные формы этаноламина – фосфоэтаноламин, холина – фосфохолин.
Схема синтеза ФЛ
Сначала этаноламин фосфорилируется в реакции с АТФ и образуется фосфоэтаноламин (фермент – этаноламинкиназа). Холин аналогичным образом
5
переходит в фосфохолин (фермент – холинкиназа). Затем в реакции с ЦТФ образуется цитидилдифосфоэтаноламин (ЦДФ-ЭА) и, соответственно,
цитидилдифосфохолин (ЦДФ-ФХ) – это активные формы аминоспиртов.
Катализирует их синтез регуляторный фермент – цитидилтрансфераза.
Образовавшиеся активные формы переносят остатки фосфоэтаноламина и фосфохолина на ДАГ (т.е. происходит перенос полярной «головы» -
фосфоэтаноламина (ФЭА) и фосфохолина (ФХ) на 1,2-ДАГ) с образованием ФЭА
иФХ. Катализируют перенос регуляторные ферменты –
фосфоэтаноламинтрансфераза и фосфохолинтрансфераза.
Рассмотренный путь синтеза ФЛ называется "спасательным или резервным", так как в нём используется готовый холин. Таким образом, холин сохраняется от разрушения путём реутилизации.
Регуляция синтеза ФЛ
Регуляторными ферментами являются:
1. Цитидилтрансфераза – фермент локализован в цитозоле, активность увеличивается при высоких концентрациях холина и этаноламина и, наоборот,
снижается при низких концентрациях этих субстратов.
2. Фосфоэтаноламин- и фосфохолинтрансфераза. Эти ферменты локализованы в цитозоле. Их активность увеличивается в присутствии ДАГ и снижается в их отсутствии. Это саморегулирующаяся система.
Симпатическая нервная система активирует синтез ФХ, поставляя в систему синтеза фосфолипидов ацетилхолин.
Регуляция синтеза и распада ТАГ в печени и жировой ткани
В период приёма пищи в печени и жировой ткани под действием инсулина происходит липогенез (синтез ТАГ). Для осуществления липогенеза необходим ацетил-KoA. Инсулин стимулирует утилизацию глюкозы печенью за счет индукции глюкокинды. В печень поступает много глюкозы, в результате чего активируется гликолиз и ЦТК. В результате накапливающийся цитрат переходит в цитозоль, расщепляется на исходные компоненты: ацетил-КоА и
6
ОАА, и активирует регуляторный фермент ацетил-КоА-карбоксилазу,
активирующую синтез малонил-КоА. Малонил-КоА блокирует активность регуляторного фермента β-окисления жирных кислот (ЖК) –
карнитинацилтрансферазу I, а сам активно включается в биосинтез жирных кислот (ЖК).
В результате действия инсулина увеличивается синтез ТАГ и секреция их в кровь в составе ЛПОНП. ЛПОНП доставляют жиры (ТАГ) из печени в капилляры жировой ткани. В жировой ткани инсулин индуцирует синтез липопротеид-липазы. ЛП-липаза переносится на поверхность эндотелия капилляров жировой ткани, где она осуществляет гидролиз ТАГ, находящихся в составе ЛПОНП. Следовательно, увеличивается поступление жирных кислот в адипоциты (ТАГ распадается до 1,2-ДАГ + ВЖК (высшие жирные кислоты), т.к.
ЛП-липаза действует в 1 или 3 положениях).
Одновременно инсулин активирует белок-переносчик глюкозы глют-4 в
адипоцитах. Поступление глюкозы в адипоциты усиливается и активируется гликолиз. В процессе гликолиза образуются все необходимые компоненты для синтеза ТАГ: α-ГФ, активные формы жирных кислот (ацил-КоА).
1.Между приёмами пищи, при голодании и физической нагрузке активируется липолиз (распад жиров), который стимулируется глюкагоном и адреналином и, в меньшей степени, кортизолом и соматотропным гормоном.
2.Гормоны адреналин и глюкагон, действуя на адипоциты через аденилатциклазную сисему, активируют протеинкиназу А. Протеинкиназа А фосфорилирует ТАГ-липазу (активна в фосфорилированной форме). ТАГ-липаза расщепляет ТАГ на глицерол и ВЖК, которые выделяются в кровь и доставляются альбуминами в мышцы, сердце, печень и почки. Печень перерабатывает часть ЖК в кетоновые тела, используемые мозгом, сердцем,
мышцами, корковым слоем почек как источники энергии.
3.Во время приёма пищи инсулин активирует специфическую фосфатазу,
которая дефосфорилирует ТАГ-липазу и распад жиров останавливается, так как
ТАГ-липаза в дефосфорилированном виде неактивна.
7
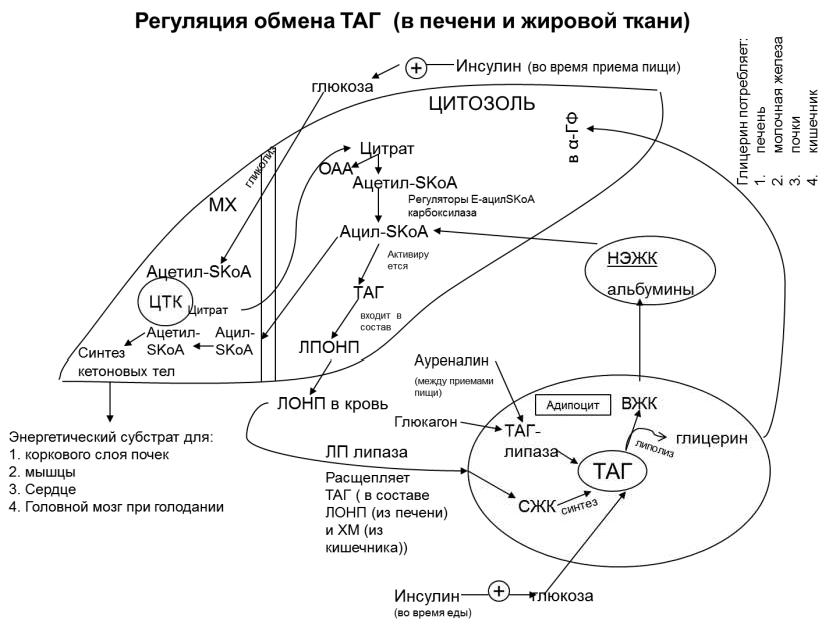
Регуляция обмена ТАГ в печени и жировой ткани
Клинические аспекты обмена мембранных липидов
Полярные липиды не запасаются в жировых клетках подобно ТАГ, а
встраиваются в различные типы клеточных мембран.
1. Дипальмитоилфосфатидилхолин (лецитин) – (ФХ, содержащий два остатка С16:0) – основной компонент сурфактанта лёгких.
Сурфактант – внеклеточный липидный слой с небольшим количеством гидрофобных белков, выстилающий поверхность легочных альвеол и предотвращающий слипание стенок альвеол во время выдоха и перерастяжение их во время вдоха. На долю дипальмитоилфосфатидилхолина приходится 80% от всех фосфолипиды,
входящих в состав сурфактанта. Кроме того, компонентами сурфактанта являются гидрофобные белки, доля которых составляет 10-20% от общей массы сурфактанта.
Синтез дипальмитоилфосфатидилхолина происходит в пневмоцитах II типа в период с 32 по 36 недели беременности. Показателем нормального формирования сурфактанта служит величина соотношения фосфатидилхолин/сфингомиелин более 4. Снижение этого коэффициента до значений менее 2 указывает на высокий риск развития респираторного дистресс-синдрома, который наблюдается у недоношенных детей. В случае необходимости беременных лечат кортикостероидными препаратами,
которые стимулируют синтез сурфактанта.
2. Недостаток полярных липидов может быть причиной другого патологического состояния – рассеянного склероза. При этом заболевании наблюдается снижение содержания фосфолипидов и сфинголипидов в белом веществе мозга. В большом количестве присутствуют эфиры ХСа,
отсутствующие в норме, а спинномозговая жидкость обогащается фосфолипидами.
9
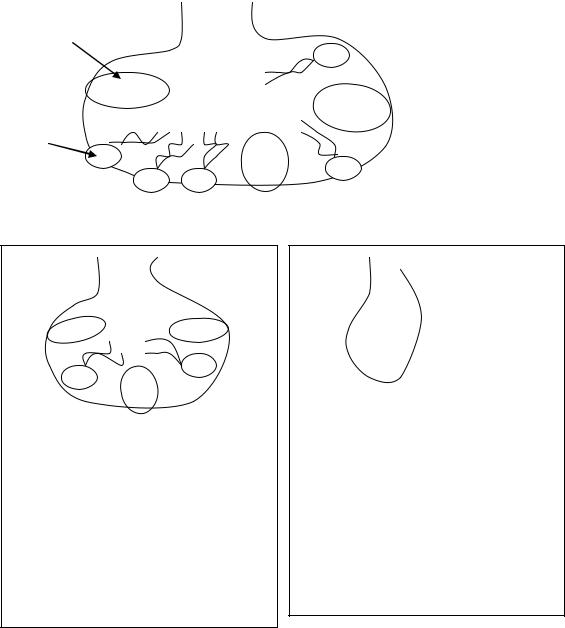
альвеола в момент вдоха
гидрофобные белки
лецитин
Альвеола в момент выдоха
Сурфактант уменьшает поверхностное натяжение жидкости, выстилающей поверхность альвеол и предотвращающей слипание стенок альвеол во время выдоха. Меньшее давление воздуха необходимо, чтобы
наполнить альвеолы воздухом.
Альвеолы в момент выдоха при недостатке сурфактанта.
Отсутствие или недостаток сурфактанта (у недоношенных детей) приводит к тому, что стенки альвеол во время выдоха спадаются и требуют давление воздуха в 10 раз больше, чтобы наполнить альвеолы.
3. Полярные липиды в мембранах постоянно обновляются. Их
расщепление происходит в лизосомах под действием соответствующих
гидролаз. Известны генетические заболевания, связанные с дефектами
ферментов, участвующих в деградации липидов, под общим названием
лизосомные болезни. Продукты неполного расщепления липидов
накапливаются в лизосомах, которые сильно разбухают, что приводит к
нарушению функций клеток.
Болезнь Тея-Сакса связана с дефектом гексозаминидазы, которая
гидролизует связь между галактозамином и галактозой в полярной головке
10
