
Скотаренко_9492_ЛР3_Растворы_В12
.docx1. Какая масса сульфата алюминия потребуется для приготовления 2 л 0.1 М раствора? Чему будет равна молярная концентрация эквивалентов Al2(SO4)3 в этом растворе?
1) Воспользуемся формулой молярной концентрации:
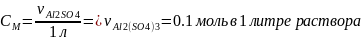
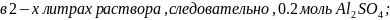
молярная
масса
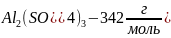 ,
следовательно, в 2 л раствора будет
содержаться 342*0.2=68.4 г
,
следовательно, в 2 л раствора будет
содержаться 342*0.2=68.4 г
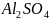 .
.
Молярная концентрация эквивалентов будет равна:
Молярная
масса эквивалента
:
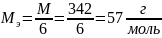 ;
;
Молярная
концентрация эквивалентов:
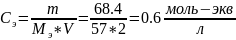
Ответ:
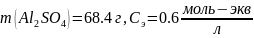
2. Рассчитать, какой объем 0.4 М раствора Fe2(SO4)3 (ρ(р-ра) = 1.22 г/см3) необходимо взять для приготовления 4 л 0.2 н. раствора.
Для начала рассчитаем массу соли во втором растворе:
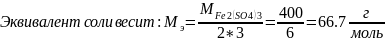
Следовательно, в четырёх литрах нового раствора должно быть 4*0.2*66.7=53,36 г кислоты.
Теперь найдём, в каком объёме исходного раствора содержится такое же количество кислоты:
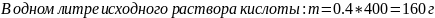
1л – 160г
Xл – 53.36 г
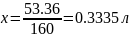
Следовательно, нужно взять 0,3335 л исходного раствора.
Ответ: 0,3335 л.
3. Какой объем 2 М раствора H2SO4 потребуется для реакции с 650 мл 20 %-го раствора карбоната калия (ρ(р-ра) = 1.189 г/см3), какой газ выделится при этом и чему будет равен его объем при н. у.?
1) Составим уравнение реакции:
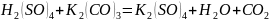
Количество вещества серной кислоты равно количеству вещества карбоната калия – найдём же его:
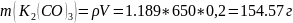
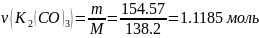
Теперь найдём массу серной кислоты:
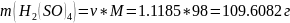
Найдём объём раствора, содержащего необходимую массу:
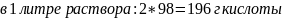
1л – 196 г
xл – 109.6082 г

Следовательно, для реакции с 650 мл 20%-го раствора карбоната калия необходимо 0,5592 литра серной кислоты, или, примерно 560 мл.
У нас в процессе реакции выделился углекислый газ.
Найдём объём выделившегося углекислого газа при н.у.:
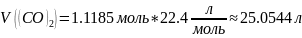
Ответ: 0,5592 литра или примерно 560 мл раствора серной кислоты необходимо; выделился углекислый газ объёмом при н.у. 25.0544 л.
