
1_Lektsia_Obmen_uglevodov_chast_1
.pdf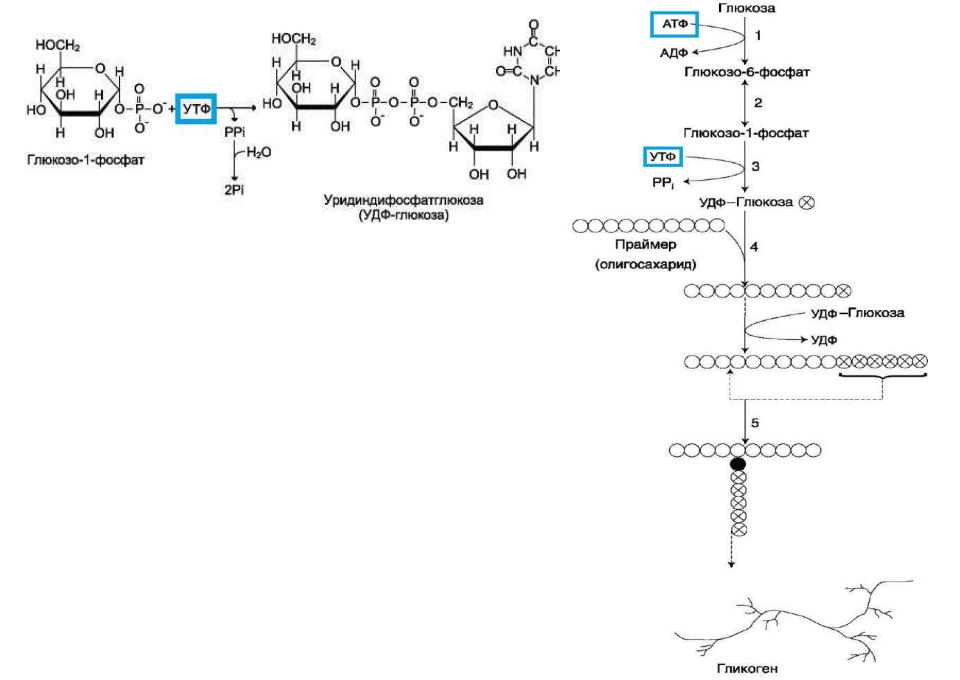

Разветвлѐнная структура гликогена образуется при участии амило- 1,4→1,6-глюкозилтрансферазы, называемой ферментом «ветвления» (англ. branching enzyme). Как только гликоген-синтаза удлиняет линейный участок примерно до 11 глюкозных остатков, фермент ветвления переносит еѐ концевой блок, содержащий 6- 7 остатков, на внутренний остаток глюкозы этой или другой цепи. В точке ветвления концевой остаток глюкозы олигосахарида соединяется с гидроксильной группой в С6-положении с образованием α-1,6-гликозидной связи. Новая точка ветвления может быть образована на расстоянии не менее 4 остатков от любой уже существующей. Таким образом, по мере синтеза гликогена многократно возрастает число ветвлений. Концы цепей служат точками роста молекулы при еѐ синтезе и началом при еѐ распаде.

РАСПАД ГЛИКОГЕНА (ГЛИКОГЕНОЛИЗ)
Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приѐмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы.
Распад гликогена происходит путѐм последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликоген-фосфорилазой.
Так же как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахаридной цепи. При этом наличие разветвлѐнной структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно.
Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаѐтся 4 мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением еѐ активного центра.
Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвления глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя еѐ и таким образом создавая условия для действия фосфорилазы.
Гликогенфосфорилаза расщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаѐтся 4 мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением еѐ активного центра.
Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвления глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя еѐ и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью а-1,6- глюко-зидазы в виде свободной глюкозы (реакция 3), после чего неразветвлѐнный участок гликогена может вновь атаковаться фосфорилазой.
Считают, что перенос трѐх остатков глюкозы и удаление мономера из точки ветвления (реакции 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют «деветвящим» ферментом (англ. debranching enzyme).
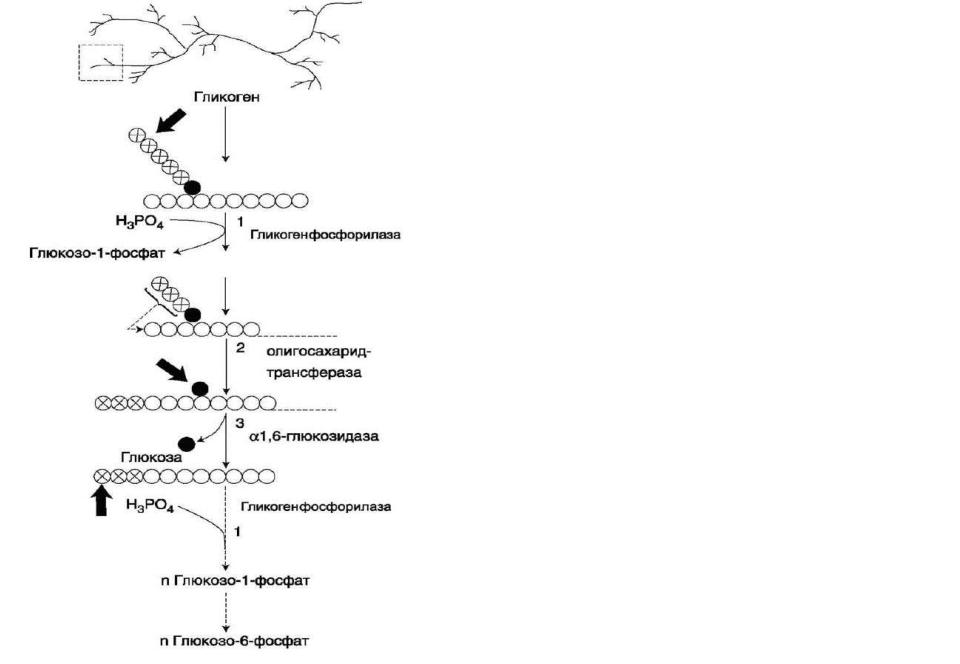
*Продукт действия гликогенфосфорилазы – глюкозо-1-фосфат – затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс
катаболизма или другие метаболические пути.
В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-
фосфатаза (см. об этом выше). Реакция
протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо- 6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр
обращѐн в просвет ЭР. Продукты гидролиза
(глюкоза и Н3РО4) возвращаются в цитоплазму также с помощью транспортных систем.

Регуляция метаболизма гликогена
Процессы накопления глюкозы в виде гликогена и его распада должны быть согласованы с потребностями организма в глюкозе как источнике энергии. Одновременное протекание этих метаболических путей невозможно, так как в этом случае образуется «холостой» цикл, существование которого приводит только к бесполезной трате АТФ.
Изменение направления процессов в метаболизме гликогена обеспечивают регуляторные механизмы, в которых участвуют гормоны. Переключение процессов синтеза и мобилизации гликогена происходит при смене абсорбтивного периода на постабсорбтивный или состояния покоя организма на режим физической работы. В переключении этих метаболических путей в печени участвуют гормоны инсулин, глюкагон и адреналин, а в мышцах - инсулин и адреналин.
Характеристика гормонов, регулирующих обмен гликогена
Первичным сигналом для синтеза и секреции инсулина и глюкагона является изменение уровня глюкозы в крови. В норме концентрация глюкозы в крови соответствует 3,3-5,5 ммоль/л.
*Инсулин - пептидный гормон, синтезируется и секретируется в кровь β-клетками островков Лангерханса поджелудочной железы. В-клетки чувствительны к изменениям содержания глюкозы в крови и секретируют инсулин в ответ на повышение еѐ содержания после приѐма пищи. Транспортный белок (ГЛЮТ-2), обеспечивающий поступление глюкозы в β-клетки, отличается низким сродством к ней. Следовательно, этот белок транспортирует глюкозу в клетку поджелудочной железы лишь после того, как еѐ содержание в крови будет выше нормального уровня (более 5,5 ммоль/л).
*В β-клетках глюкоза фосфорилируется глюкокиназой, имеющей также высокую Кm = 12 ммоль/л. Скорость фосфорилирования глюкозы глюкокиназой в β-клетках прямо пропорциональна еѐ концентрации в крови.
*Синтез инсулина регулируется глюкозой. Глюкоза (или еѐ метаболиты), по-видимому, непосредственно участвуют в регуляции экспрессии гена инсулина. Секреция инсулина и глюкагона также регулируется глюкозой, которая стимулирует секрецию инсулина из β-клеток и подавляет секрецию глюкагона из α-клеток. Кроме того, сам инсулин снижает секрецию глюкагона (см. раздел 11).
*Глюкагон - «гормон голода», вырабатываемый α-клетками поджелудочной железы в ответ на снижение уровня глюкозы в крови. По химической природе глюкагон - пептид.
*Адреналин выделяется из клеток мозгового вещества надпочечников в ответ на сигналы нервной системы, идущие из мозга при возникновении экстремальных ситуаций (например, бегство или борьба), требующих внезапной мышечной деятельности. Адреналин является сигналом «тревоги». Он должен мгновенно обеспечить мышцы и мозг источником энергии.

Регуляция активностей гликогенфосфорилазы и гликогенсинтазы
Поскольку синтез и распад гликогена протекают по различным метаболическим путям, эти процессы могут контролироваться реципрокно. Влияние гормонов на синтез и распад гликогена осуществляется путѐм изменения в противоположных направлениях активности двух ключевых ферментов: гликогенсинтазы и гликогенфос-форилазы с помощью их фосфорилирования и дефосфорилирования.
Гликогенфосфорилаза существует в 2 формах: 1) фосфорилированная – активная (форма а); 2) дефосфорилированная - неактивная (форма в). Фосфорилирование осуществляется путѐм переноса фосфатного
остатка с АТФ на гидроксильную группу одного из сериновых остатков фермента. Следствие этого - конформационные изменения молекулы фермента и его активация.
Взаимопревращения 2 форм гликогенфосфорилазы обеспечиваются действием ферментов киназы фосфорилазы и фосфопротеинфосфатазы (фермент, структурно связанный с молекулами гликогена). В свою очередь, активность киназы фосфорилазы и фосфопротеинфосфата-зы также регулируется путѐм фосфорилирования и дефосфорилирования.
Активация киназы фосфорилазы происходит под действием протеинкиназы А (ПКА) (цАМФ-зависимой). цАМФ сначала активирует ПКА, которая фосфорилирует киназу фосфорилазы, переводя еѐ в активное состояние, а та, в свою очередь, фосфорилирует гликогенфосфорилазу. Образование цАМФ стимулируется адреналином и глюкагоном.
Активация фосфопротеинфосфатазы происходит в результате реакции фосфорилирования, катализируемой специфической протеинкиназой, которая, в свою очередь, активируется инсулином посредством каскада реакций с участием Ras-белка, а также других белков и ферментов (сигнальный Ras-путь). Активируемая инсулином протеинкиназа фосфорилирует и тем самым активирует фосфопротеинфосфатазу. Активная фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу.
Активность гликогенсинтазы также изменяется в результате фосфорилирования и дефосфорилирования. Однако есть существенные различия в регуляции гликоген-фосфорилазы и гликогенсинтазы:
•фосфорилирование гликогенсинтазы катализирует ПКА и вызывает еѐ инактивацию;
•дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, еѐ активирует.

РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА В ПЕЧЕНИ
Как уже отмечалось, первичный сигнал для синтеза инсулина и глюкагона - изменение концентрации глюкозы в крови. Инсулин и глюкагон постоянно присутствуют в крови, но при смене абсорбтивного периода на постабсорбтивный изменяется их относительная концентрация, что является главным фактором, переключающим метаболизм гликогена в печени. Отношение концентрации инсулина в крови к концентрации глюкагона называют «инсулин-глюкагоновый индекс». В постабсорбтивном периоде инсулин-глюкагоновый индекс снижается, и решающее значение в регуляции концентрации глюкозы в крови приобретает концентрация глюкагона.
Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счѐт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ - глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ. Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы. Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.

Адреналин стимулирует выведение глюкозы из печени в кровь, для того чтобы снабдить ткани (в основном мозг и мышцы) «топливом» в экстремальной ситуации. Эффект адреналина в печени обусловлен фосфорилированием (и активацией) гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия. Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени.
Какая система передачи сигнала в клетку будет использована, зависит от типа рецепторов, с которыми взаимодействует адреналин. Так, взаимодействие адреналина с β2-рецепторами клеток печени приводит в действие аденилатциклазную систему (превращение АТФ в цАМФ). Взаимодействие же адреналина с α1-рецепторами «включает» инозитолфосфатный механизм трансмембранной передачи гормонального сигнала. Результат действия обеих систем – фосфорилирование ключевых ферментов и переключение процессов с синтеза гликогена на его распад. Следует отметить, что тип рецепторов, который в наибольшей степени вовлекается в ответ клетки на адреналин, зависит от концентрации его в крови.
Подробно механизм передачи гормонального сигнала в клетку планируем изучить на II курсе.
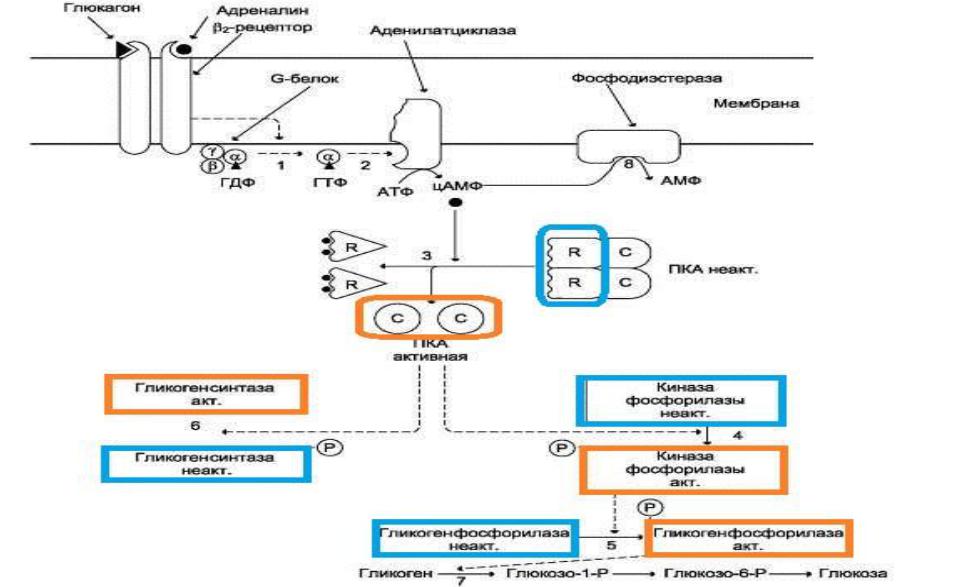
Регуляция синтеза и распада гликогена в печени глюкагоном и адреналином
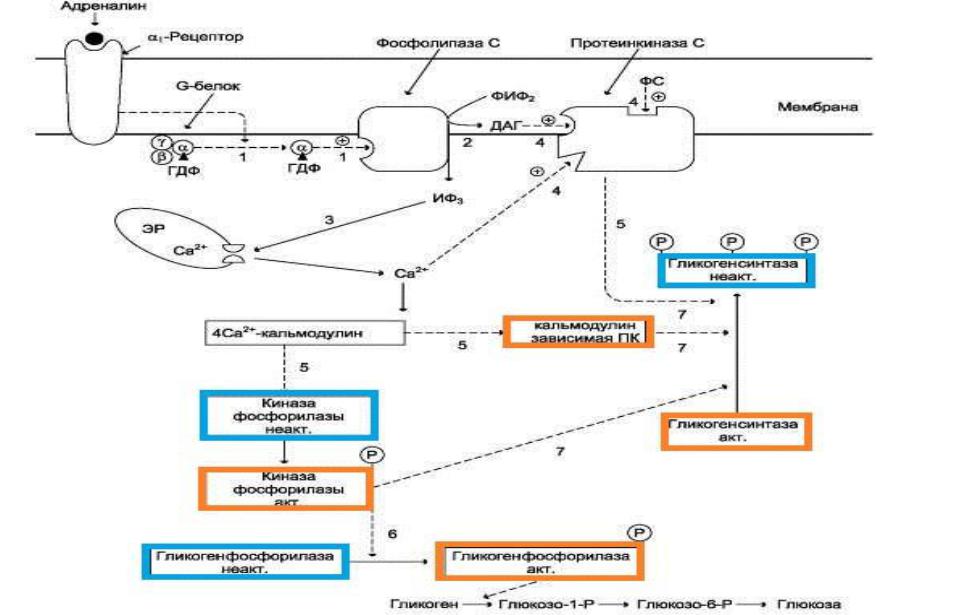
Регуляция синтеза и распада гликогена
в печени адреналином и Са2+
