
- •Вопрос 39 Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
- •3. Удаление с n-конца метионина или даже нескольких аминокислот
- •5. Включение простетической группы:
- •Вопрос 41 Фолдинг белков. Ферменты. Роль шаперонов в фолдинге белка. Фолдинг белковой молекулы с помощью шаперониновой системы. Болезни, связанные с нарушением фолдинга белка – прионовые болезни.
- •Вопрос 42 Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
Вопрос 38
Биосинтез белков (трансляция). Генетический код и его свойства. Основные компоненты белоксинтезирующей системы: аминокислоты, аминоацил-т-РНК синтетазы т-РНК, рибосомы, источники энергии, белковые факторы, ферменты.
Трансляция – циклический энергозависимый многоступенчатый процесс, в котором свободные аминокислоты полимеризуются в генетически запрограммированную последовательность с образованием полипептидов (Перевод информации, заключенной в последовательности мРНК в последовательность АК)
Генетический код – способ записи АК-последовательности с помощью треплетов нуклеотидов
Свойства генетического кода:
Триплетность – каждая АК кодируется триплетом нуклеотидов (кодоном)
(3 нуклеотида, расположенных последовательно = триплет; на 20 АК приходится 64 триплета, 3 триплета UAA, UAG, UGA - терминирующие, а AUG - инициирующие);
Специфичность (однозначность) –каждому кодону соответствует 1 АК
Вырожденность – каждая АК может кодироваться несколькими кодонами
(Исключение: Три, Мет);
Линейность записи информации – кодоны мРНК читаются с 5’-конца к
3’-концу, начиная с фиксированной стартовой точки (инициирующего кодона)
Неперекрываемость – один и тот же нуклеотид не может одновременно входить в
состав нескольких триплетов
Универсальность – генетический код одинаков для всех живых организмов, кроме
митохондриальной мРНК, кот. содерж. 4 триплета всего: UGA-Три, AUA-Мет, а AGA и AGG - стоп-кодоны);
Коллинеарность гена и продукта:
У прокариот линейно соответствуют последовательность кодона гена и
последовательность АК в белковом продукте
У эукариот последовательность АК коллинеарна последовательности экзонов
в гене или зрелой мРНК после удаления интронов
Необходимые компоненты трансляции:
1. Аминокислоты – субстраты для синтеза белков
2. тРНК – выполняют роль адапторов, они акцепторным взаимодействуют с АК,
а антикодоном с кодоном мРНК; их в организме около 50 видов.
К акцепторному концу тРНК присоединяется определенная АК, а с помощью
антикодона они узнают специфический кодон на мРНК. На рибосоме антикодонов с кодонами РНК происходит по принципу комплиментарности и антипараллельности
Некоторые тРНК способны связываться более, чем с 1 кодоном:
Первые2 основания кодона и последние 2 основания антикодона обр. прочные пары (А-у, Г-Ц) и вносят наибольший вклад в специяисноть декодирования
Связывания 3-го основания кодона с 1 основанием тРНК происходит слабее, что позволяет тРНК прочитывать больше, чем 1 кодон
“Гипотеза качания” – третье основание большинства кодонов имеет опред. степень свободы при образовании пары с соответствующим антикодоном и как бы “качается”. (поэтому тРНК около 50 видов, а не 64)
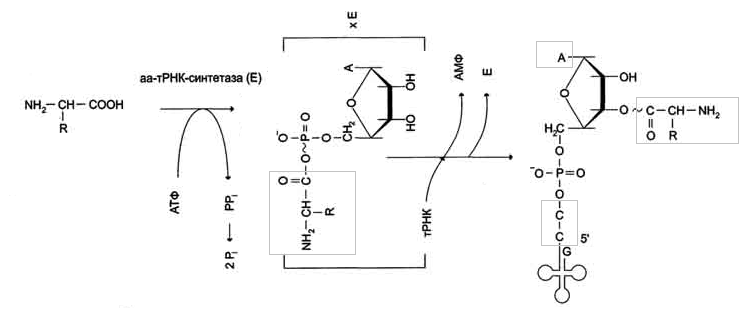
3. Аминоацил-тРНК-синтетазы – семейство ферментов (20шт – на каждую АК),
катализирующих реакцию специфического связывания определенной АК с тРНК – присоединение α-карбоксильной гр. АК к 3’-гидроксильному акцепторному концу соответствующей с обр. сложноэфирной связи тРНК
Они осуществляют активацию АК:
1 стадия – АК присоединяется к ферменту и реагирует с АТФ с обр-ем богатого
энергией аминоацил-АМФ
2 стадия – аминоацильный остаток аминоациладенилата, оставаясь связанным с
ферментом, взаимодействует с соответствующей тРНК с образованием аминоацил-тРНК
АК присоединяется к 3’-ОН группе рибозы на 3’-конце тРНК, где все тРНК имеют
общую нуклеотидную последовательность -ССА
4. мРНК – матрица, содержащая линейную последовательность кодонов,
определяющую первичную стр-ру белка
5. Рибосома – рибонуклеопротеиновая субклеточная структура, являющаяся местом синтеза белка. Они имеют константу седиментации 80S и состоят из 2х субъединиц:
Малой (40S) – рРНК 18S 30-40 белков
Большой (60S) – 3 вида рРНК – 5S, 5.8S и 28S и около 50 белков
В присутствии мРНК 40S и 60S объединяются с обр-ем полной рибосом.
В рибосоме есть 2 центра для присоединения тРНК:
(А) аминоацильный – в ходе трансляции связывает аа-тРНК, строение которой
определяет кодон, находящийся в области этого центра. В стр-ре этого кодона зашифрована природа АК, которая будет включена в ППЦ
(Р) пептидильный – его занимает пептидил-тРНК (т.е. тРНК, связанная с
пептидной цепочкой, которая уже синтезирована)
6. АТФ, ГТФ – источники энергии
2 макроэрг. связи из АТФ затрачивается в ходе реакции, катализируемой
аа-тРНК-синтетазой
Еще 2 из ГТФ: 1 исп. на связывание аа-тРНК в А-центре рибосомы,
1 исп. на стадии транслокации
7. Белковые факторы – специфические внерибосомные белки,
необходимые для трансляции;
12 факторов инициации elF
2 фактора элонгации eEF1, eEF2
факторы терминации eRF
8. Ионы Mg2+ - кофакторы, стабилизирующие структуру рибосом
Вопрос 39 Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса. Элонгация: образование пептидной связи (реакция транспептидации). Транслокация. Транслоказа. Терминация.
В ходе синтеза белка прочтение информации мРНК идёт в направлении от 5'- к З'-
концу (синтез пептида от N- к С-концу). Каждая эукариотическая мРНК кодирует строение только одной ППЦ, а прокариот – несколько (т.к. у них нет интронов).
У прокариот процессы транскрипции и трансляции не разделены, синтез белка
начинается сразу, до того, как закончился синтез самой мРНК
У эукариот трансляция протекает в цитоплазме, куда из ядра поступают
уже "зрелые" мРНК.
События на рибосоме включают этапы: инициации, элонгации и терминации.
1. Инициация трансляции – событие, в ходе которого происходит образование комплекса, включающего Мет-тРНКiМет, мРНК и рибосому
тРНКiМет – инициирующая метиониновая тРНК.
Образование инициирующего комплекса в ходе синтеза белка у эукариотов.
Мет-тРНКiМет объединяется с малой субъединицей рибосомы в форме тройного комплекса: Мет-тРНКМет, elF-2 и ГТФ.
Образовавшийся четырёхкомпонентный комплекс (малая субъед. рибосомы +
Мет-тРНКМет + elF-2 + ГТФ) присоединяется к 5'-концу мРНК с помощью неск. инициир. факторов, и малая субъединица начинает скользить по мРНК до тех пор, пока антикодон Мет-тРНКМет не свяжется с инициирующим кодоном AUG.
Достигнув начала кодир. последовательности, происходит присоединение других
факторов инициации, кот. ускоряют присоединение большой субъединицы, сопровождающееся гидролизом ГТФ. Формируются А и Р центры.
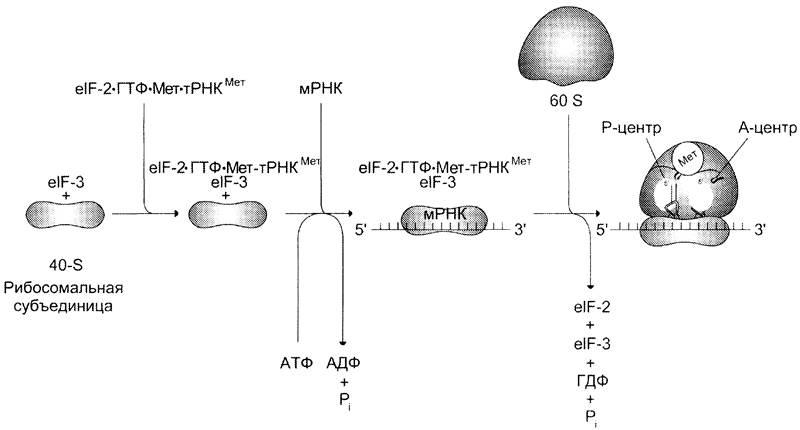
По завершении инициации рибосома располагается на мРНК таким образом:
В Р-центре находится инициирующий кодон AUG с присоединённой
к нему Мет-тРНКiМет,
В А-центре – триплет, кодирующий включение первой аминокислоты
синтезируемого белка.
2. Элонгация - самый продолжительный этап белкового синтеза, в ходе которого
рибосома с помощью аа-тРНК последовательно «читает» мРНК в виде триплетов нуклеотидов, следующих за инициирующим кодоном в направлении от 5' к 3'-концу, наращивая ППЦ за счёт последовательного присоединения АК.
Включение каждой АК в белок происходит в 3 стадии, в ходе которых:
1. Связывание аминоацил-тРНК в А-центре. Кодон мРНК, располагающийся в А-центре рядом с инициирующим кодоном, определяет природу аа1-тРНКaa1, которая будет включена в А-центр. аа1-тРНКаа1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации ЕР-1, аа1-тРНКаа1 и ГТФ.
Комплекс эффективно взаимодействует с рибосомой лишь в том случае, если антикодон аа-тРНКаа1 комплементарен и антипараллелен кодону мРНК в А-центре. Включение аа-тРНКаа1 в рибосому происходит за счёт энергии гидролиза ГТФ до ГДФ и неорганического фосфата.
Включение аа1-тРНКaa1 в рибосому.
аа1-тРНКaa1 взаимодействует с рибосомой в виде тройного комплекса, состоящего из фактора элонгации ЕF-1, аа1-тРНКaa1 и ГТФ. Антикодон аа-тРНКaa1 комплементарен и антипараллелен кодону мРНК в А- центре. Связывание аа1-тРНКaa1 происходит за счёт энергии гидролиза ГТФ до ГДФ и Рi.
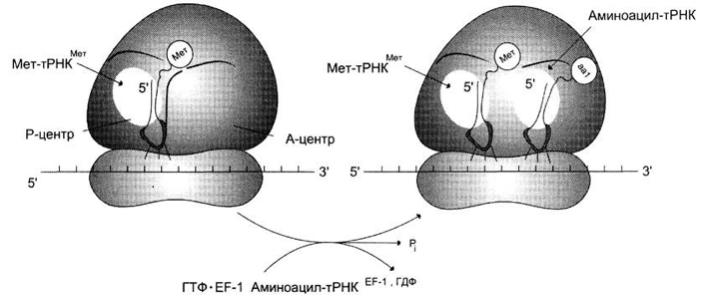
2. Реакции транспептидации – стадия образования пептидной связи, которая происходит сразу же после отщепления комплекса ЕГ-1 и ГДФ от рибосомы.
Реакция транспептидации.
Метионин от Мет-тРНКiМет, находящегося в Р-центре, присоединяется к α-NН2-группе аминоацильного остатка аа1-тРНКaa1 А-центра с образованием новой пептидной связи.
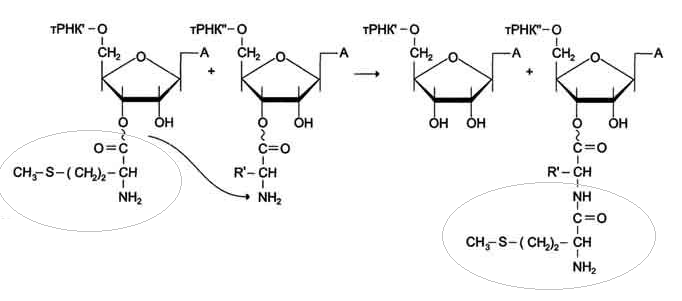
В ходе этой реакции остаток метионина Мет- тРНКiМет связывается с
α-аминогруппой первой аминокислоты, присоединённой к тРНКаа1 и расположенной в
А-центре, образуется первая пептидная связь.
3. Транслокация – к рибосоме присоединяется фактор элонгации ЕF-2 и за счёт энергии ГТФ продвигает рибосому по мРНК на один кодон к 3'-концу и дипептидил-тРНК из А-центра перемещается в Р-центр. Свободная от метионина тРНКiМeт покидает рибосому, а в область А-центра попадает следующий кодон
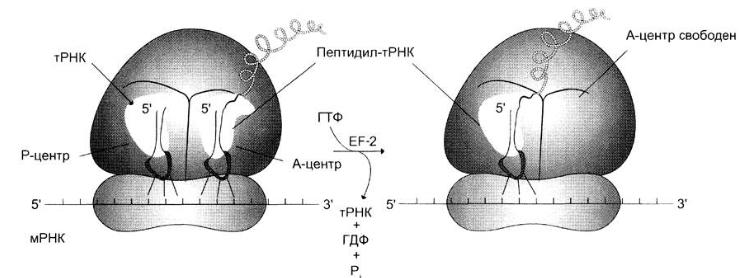
По завершении третьей стадии элонгации рибосома в Р-центре имеет дипептидил-тРНК, а в А-центр попадает триплет, кодирующий включение в ППЦ второй аминокислоты. Начинается следующий цикл стадии элонгации, в ходе которого на рибосоме снова проходят вышеописанные события. Повторение таких циклов по числу смысловых кодонов мРНК завершает весь этап элонгации.
Терминация трансляции наступает в том случае, когда в А-центр рибосомы попадает один из стоп-кодонов: UАG, UАА или UGА. Для стоп- кодонов нет соответствующих тРНК. Вместо этого к рибосоме присоединяются 2 белковых высвобождающих фактора RF или фактора терминации. Один из них с помощью пептидилтрансферазного центра катализирует гидролитическое отщепление синтезированного пептида от тРНК. Другой за счёт энергии гидролиза ГТФ вызывает диссоциацию рибосомы на субъединицы.

Малая субъединица присоединяет мРНК и декодирует информацию с помощью тРНК и механизма транслокации,
Большая субъединица ответственна за образование пептидных связей.
Вопрос 40
Процессинг первичных полипептидных цепей после трансляции: частичный протеолиз, образование ковалентных связей, присоединение простетических групп, ковалентная модификация аминокислотных остатков (гликозилирование, метилирование, фосфорилирование, ацетилирование).
Посттрансляционные модификации ППЦ – конформационные и структурные изменения ППЦ. Они включают удаление части ППЦ, ковалентное присоединение одного или нескольких низкомолекулярных лигандов, приобретение белком нативной конформации (функционально-активная трансформация).
Многие модификации осуществляются в ЭР. Здесь происходят фоддинг ППЦ и формирование уникальной третичной или четвертичной структуры белков.
Для поддержания нативной конформации молекул важно формирование дисульфидных связей.
1. Частичный протеолиз: многие белки, секретируемые из клеток, первоначально
синтезируются в виде молекул-предшественников, функционально неактивных. Удаление части ППЦ специфическими эндопротеазами приводит к образованию активных молекул.
Некоторые белки-предшественники расщепляются в ЭР или аппарате Гольджи, другие – после секреции.
Неактивные предшественники секретируемых ферментов (зимогены) образуют
активный фермент после расщепления по определённым участкам молекулы: зимоген панкреатической железы трипсиноген превращается в активный трипсин после секреции в тонкий кишечник.
Пример двухстадийного протеолиза: образование активных форм пептидных гормонов (например, инсулина или глюкагона) из препрогормонов.
Первоначально N-концевой сигнальный пептид молекулы-предшественника
удаляется в ЭР в процессе синтеза белка и образуется неактивный прогормон.
Затем прогормон в секреторных гранулах, формирующихся в аппарате Гольджи,
подвергается действию эндо- или экзопротеаз и превращается в активный гормон.
2. Ковалентные модификации: структурные белки и ферменты могут
активироваться или инактивироваться в результате присоединения различных химических групп: фосфатных, ацильных, метальных, олигосахаридных и некоторых других.
Фосфорилирование белков осуществляется по гидроксильным группам Серина,
Треонина и, реже, Тирозина ферментами из группы протеинкиназ (используется при регуляции активности ферментов или для связывания ионов кальция); дефосфорилирование катализируют гидролитические ферменты фосфопротеинфосфатазы
Гликозилирование. Углеводные цепи присоединяются по гидроксильным группам
серина или треонина (О-гликозилирование) либо аспарагина (N-гликозилирование). Последовательное наращивание углеводного фрагмента происходит в ЭР и
аппарате Гольджи.
Метилирование – метилирование аргинина и лизина в составе гистонов используется
для регуляции активности генома,
Ацетилирование – присоединение карбоксильной группы – например, при участии
витамина К происходит γ-карбоксилирование глутамата в составе протромбина, проконвертина, что позволяет связывать ионы кальция при инициации свертывания крови,
Многочисленным модификациям подвергаются боковые радикалы некотор. АК:
например, в тиреоглобулине присоединение йода необходимо для образования предшественников тиреоидных гормонов йодтиронинов; в факторах свёртывания крови карбоксилируются остатки глутамата; в ЭР фибробластов гидроксилируются остатки пролина и лизина в цепях тропоколлагена.
