
- •Вопрос 27 Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые. Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
- •Азотистые основания:
- •Вопрос 28 Первичная структура нуклеиновых кислот. Днк и рнк – черты сходства и различия состава, локализации в клетке, функции.
- •Вопрос 29 Вторичная структура днк (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру днк. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность.
- •Вопрос 30 Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
Вопрос 29 Вторичная структура днк (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру днк. Комплементарность. Правило Чаргаффа. Полярность. Антипараллельность.
Вторичная структура ДНК (Уотсон и Крик): молекула ДНК имеет форму спирали, образованную двумя полинуклеотидными цепями, закрученными относительно друг друга и вокруг общей оси.
Двойная спираль правозакрученная
Полинуклеотидные цепи в ней антипараллельны, т.е. одна из них ориентирована
в направлении 3'→5', то вторая – в направлении 5'→3'.
Все основания цепей ДНК расположены внутри двойной спирали, а
пентозофосфатный остов – снаружи.
Полинуклеотидные цепи удерживаются относительно друг друга за счёт
водородных связей между комплементарными пуриновыми и пиримидиновыми азотистыми основаниями А=Т и G≡С.
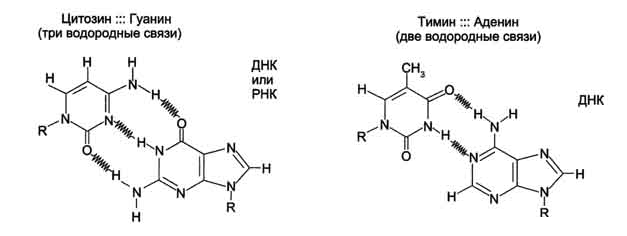
Водородные связи при других сочетаниях оснований в паре возможны, но они
значительно слабее. Последовательность нуклеотидов одной цепи полностью комплементарна последовательности нуклеотидов второй цепи.
Правило Чаргаффа: число пуриновых оснований (А+G) равно числу пиримидиновых оснований (Т+С).
Комплементарные основания уложены в стопку в сердцевине спирали. Между основаниями двухцепочечной молекулы в стопке возникают гидрофобные взаимодействия, стабилизирующие двойную спираль.
Такая структура исключает контакт азотистых остатков с водой. Пары оснований слегка смещены относительно друг друга.
В образованной структуре различают две бороздки:
Большую, шириной 2,2 нм;
Малую, шириной 1,2 нм.
Азотистые основания в области большой и малой бороздок взаимодействуют со специфическими белками, участвующими в организации структуры хроматина.
Вопрос 30 Гибридизация нуклеиновых кислот. Денатурация и ренативация днк. Гибридизация (днк-днк, днк-рнк). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
Вторичная структура нуклеиновых кислот образуется за счёт слабых взаимодействий – водородных и гидрофобных. Поэтому если водный раствор ДНК нагреть до 100 °С, то связи, удерживающие две цепи двойной спирали вместе, разрушаются.
Денатурация – расхождение цепей ДНК в результате разрыва водородных и гидрофобных связей.
Ренативация – получение двухспиральных структур, идентичных исходным, путем медленного охлаждения денатурированной ДНК.
Гибридизация – соединение комплементарных одноцепочечных НК в одну молекулу.
А – гибридизация ДНК-ДНК;
Б – гибридизация ДНК-РНК.

А – гибридизация ДНК-ДНК; Б – гибридизация ДНК-РНК.
Процесс гибридизации, основанный на денатурации и ренативации, может
осуществляться между двумя любыми цепями нуклеиновых кислот (ДНК-ДНК, ДНК-РНК) при условии, что они содержат комплементарные последовательности нуклеотидов. Такие гибридные структуры можно выделить центрифугированием в градиенте плотности сахарозы или наблюдать в электронном микроскопе.
Метод молекулярной гибридизации: если раствор, содержащий образцы
ДНК 1 и 2, выделенные из организмов разных видов, денатурировать, а затем провести ренатурацию, то образуются двухспиральные структуры. Но наряду с исходными ДНК 1 и ДНК 2 образуются гибридные двойные спирали, содержащие цепь ДНК образца 1 и цепь ДНК образца 2, где присутствуют как спирализованные, так и неспирализованные участки. В неспирализованных участках фрагменты цепей ДНК не комплементарны, т.е. в ходе гибридизации получаются несовершенные гибриды.
Методом молекулярной гибридизации можно установить:
Сходство и различие первичной структуры разных образцов нуклеиновых кислот;
Различие ДНК, выделенных из организмов разных видов;
Идентичность ДНК всех органов и тканей одного организма.
Гибридизацией ДНК-РНК было впервые установлено, что все виды РНК клетки имеют на молекуле ДНК комплементарные участки.
Метод полимеразной цепной реакции (ПЦР) позволяет подвергать специфичной
амплификации (увеличению числа копий ДНК) участки ДНК длиной от нескольких десятков до нескольких сотен пар нуклеотидов, используя в качестве матрицы любые образцы ДНК.
Необходимое условие для проведения ПЦР – знание нуклеотидной последовательности амплифицируемой области.
Участок исследуемой ДНК гибридизуют с двумя искусственно синтезированными праймерами – олигодезоксирибонуклеотидными последовательностями длиной от 15 до 30 пар нуклеотидов, которые комплементарны 3'-концам амплифицируемого участка на кодирующей и некодирующей нитях ДНК. Расстояние между праймерами определяет длину синтезируемых молекул.
В качестве матрицы для синтеза продуктов ПЦР используют любой тип ДНК:
геномную ДНК человека, различных видов про- и эукариотов, ДНК, выделенную из культур клеток, "библиотек" генов и других источников. Метод не требует больших количеств исследуемой ДНК, в принципе, достаточно даже одной молекулы, содержащейся в одном волосе на голове, одной капле крови или спермы.
Один цикл полимеризации включает 3 этапа:
Плавление: реакционную смесь нагревают до температуры 90-97 °С. Исследуемая двуцепочечная ДНК денатурирует и переходит в однонитевую форму;
Гибридизация или отжиг ДНК с праймерами. В результате снижения температуры до 50-60 °С происходит комплементарное связывание праймеров с цепями матричной ДНК и образование двухцепочечного участка на каждой из нитей ДНК;
Элонгация, удлинение нитей ДНК, комплементарных матричной ДНК, катализирует Taq-полимераза в направлении от 5'- к 3'-концу.
Затем снова наступает этап плавления, когда за счёт повышения температуры синтез ДНК прекращается, и двунитевой участок между матричными и вновь синтезированными молекулами ДНК денатурирует.
Во втором и последующих циклах праймеры гибридизируются с исходной матричной ДНК и с вновь синтезированными молекулами ДНК, количество которых нарастает в геометрической прогрессии. В последнем случае синтез ДНК заканчивается не из-за изменения температурного режима, а по достижении ДНК-полимеразой границы амплифицированного участка, что определяет строго определённый размер продукта с точностью до одного нуклеотида.
Каждый из этапов цикла имеет продолжительность от десятков секунд до 1-3 мин, в результате полный цикл длится от одной до нескольких минут.
Описанную процедуру амплификации ДНК проводят в автоматическом режиме в приборе - циклизаторе, или термоциклере, амплификаторе ДНК.
С помощью ПЦР можно получить достаточное количество копий участков ДНК, в которых предполагаются присутствие мутаций, полиморфизм сайтов, можно проводить ДНК-диагностику инфицированности пациентов вирусными, бактериальными и грибковыми возбудителями болезней.
Вопрос 31
Третичная структура ДНК. Роль гистоновых и негистоновых белков в компактизации ДНК. Организация хроматина. Ковалентная модификация гистонов и ее роль в регуляции структуры и активности хроматина.
Третичная структура ДНК (суперспирализация и компактизация ДНК) – многократная спирализация ДНК и компактизация за счет обр-я комплексов с белками.
Каждая молекула ДНК упакована в отдельную хромосому (в диплоидных клетках
человека 46 хромосом). Чтобы расположить ДНК в ядре формируется компактная стр-ра за счет суперспирализации и связи с белками.
Хроматин – комплекс белков с ядерной ДНК
Уровни структурной организации хроматина:
Двойная спираль – собственно вторичная стр-ра ДНК
Нуклеосома – комплекс гистонового октамера с ДНК (один)
Линкерная ДНК – ДНК, связывающая нуклеосомы (участок ДНК между нуклеосомами)
Нить нуклеосом – цепь ДНК, через определенное расстояние намотанная
на гистоновый октамер (много нуклеосом)
Нуклеосомное волокно – плотная однорядная упаковка нуклеосом
при участии гистона Н1
Соленоид – плотная трехрядная упаковка нуклеосом
Петли – спирализация соленоила, организующаяся при участии негистоновых белков хроматина и белков ядерного скелета
Мини-диски – структурное объединение примерно 20 петерль
Хромосома – плотная стопчатая упаковка мини-дисков
Белки, связывающиеся с ДНК, подразделяют на:
1. Гистоны (гистоновые) – ядерные белки, содержащие много остатков аргинина
и лизина, содержат структурный мотив α-спираль-поворот-α-спираль
Благодаря положительному заряду гистоны образуют ионные связи с отрицательно
заряженными фосфатными группами, расположенными на внешней стороне двойной спирали ДНК.
Существует 5 типов гистонов:
H1 связываются с ДНК в межнуклеосомных участках и защищают эти участки от действия нуклеаз.
Н2А, Н2В, НЗ и Н4 образуют октмерный комплекс – «нуклеосомный кор».
Октамерный комплекс образует с ДНК нуклеосомы (служит основной структурной единицей хроматина).
Модификация гистонов: аминокислотные остатки лизина, аргинина и концевые
аминогруппы гистонов могут модифицироваться: ацетилироваться, фосфорилироваться, метилироваться или взаимодействовать с белком убиквитином (негистоновый белок).
Активность ферментов, ответственных за модификации, регулируется и зависит от
стадии клеточного цикла.
Модификации изменяют заряд и конформацию гистонов, что влияет на
взаимодействие гистонов между собой и с ДНК

2. Негистоновые белки хроматина – множество ферментов и белков,
участвующих в синтезе ДНК, регуляции этих процессов, а также структурыне белки, обеспечивающие компактизацию ДНК. Каждый белок комплементарен определённой последовательности нуклеотидов ДНК (сайт ДНК).
"Цинковые пальцы" – семейство сайт-специфических белков, каждый из
которых узнаёт определённый сайт, состоящий из 5 нуклеотидных пар, могут удерживаться на ДНК
Гомодимеры – другое семейство сайт-специфических белков. Фрагмент такого
белка, контактирующий с ДНК, имеет структуру "спираль-поворот-спираль".
Белки высокой подвижности – структурные и регуляторные белков, которые
постоянно ассоциированы с хроматином (HMG-белки). Они имеют малую молекулярную массу и характеризуются высоким содержанием заряженных аминокислот. Благодаря небольшой молекулярной массе HMG-белки обладают высокой подвижностью при электрофорезе в полиакриламидном геле.
При участии структурных, регуляторных белков и ферментов, участвующих в синтезе ДНК и РНК, нить нуклеосом преобразуется в высококонденсированный комплекс белков и ДНК. Образованная структура в 10 000 раз короче исходной молекулы ДНК.
Хроматин – нуклеопротид клеточного ядра, составляющий основу хромосом
Он бывает двух видов:
Эухроматин – участки хроматина, находящиеся в деспирализованном состоянии
и поддающийся транскрибированию
Гетерохроматин – представляет собой конденсированные (спирализованные)
участки хроматина. Он подразделяется на:
Факультативный – содержит ДНК, не активную в данный момент в данном типе клеток, может переходить в эухроматин
Конститутивный – никогда не переходит в эухроматин, всегда в конденсированном состоянии
