
- •Вопрос 7 Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции белков. Комплементарность взаимодействующих белков с лигандом. Обратимость связывания.
- •Вопрос 9 Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация.
- •2. Различия белков по форме молекул
- •1. Реакции осаждения белков бывают обратимыми и необратимыми.
1. Реакции осаждения белков бывают обратимыми и необратимыми.
При обратимом осаждении макромолекулы белка в основном не
подвергаются глубокой денатурации, а осадки могут быть снова растворены в
первоначальном растворителе (например, воде).
Обратимое осаждение вызывается действием:
Нейтральных солей аммония,
Щелочных и щелочноземельных металлов (высаливание),
Спирта, ацетона, эфира и некоторых др. орг. растворителей.
При необратимом осаждении происходит глубокая денатурация белка, он теряет
свойства гидрофильности и становится гидрофобным. Денатурированный белок неспособен к восстановлению своих первоначальных физ-хим и биологических свойств.
Необратимое осаждение вызывается:
Высокой температурой,
Действием концентрированных минеральных и некот. орг. кислот
Ионов тяжелых металлов
Красителей.
Метод высаливания – метод очистки белков, основанный на различиях в их
растворимости при разной концентрации соли в растворе. Соли щелочных и щёлочноземельных металлов вызывают обратимое осаждение белков, т.е. после их удаления белки вновь приобретают способность растворяться, сохраняя при этом свои нативные свойства.
Чаще всего используют разные концентрации солей сульфата аммония –
(NH4)2SO4. Чем выше растворимость белка, тем большая концентрация соли необходима для его высаливания.
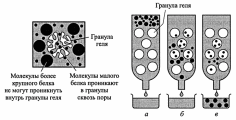
2. Гель-фильтрация – хроматографический метод, основанный на том, что
вещества, отличающиеся по молек. массе, по-разному распределяются между неподвижной и подвижной фазами.
Хроматографическая колонка заполняется гранулами пористого вещества
(сефадекс, агароза и др.). В структуре полисахарида образуются поперечные связи и формируются гранулы геля с "порами", через которые легко проходят вода и низкомолекулярные вещества. В зависимости от условий можно формировать гранулы с разной величиной "пор".
Неподвижная фаза – жидкость внутри гранул, в которую способны проникать
низкомолекулярные вещества и белки с небольшой молекулярной массой.
Смесь белков вносят в колонку с гелем и элюируют буферным раствором.
Белковые молекулы, не способные проникать в гранулы, будут перемещаться
с высокой скоростью. Средние и небольшие белки будут в той или иной степени удерживаться гранулами геля.
На выходе колонки элюат собирают в виде отдельных фракций.
3. Электрофорез белков – метод основан на том, что при определённом значении
рН и ионной силы раствора белки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки - к катоду (-).
Проводят на носителях: бумаге, крахмальном или полиакриламидном геле и т.д.
Электрофорез на бумаге – скорость миграции белка зависит от заряда;
Электрофорез в геле – скорость миграции зависит от заряда и молекулярной массы.
Разрешающая способность электрофореза в полиакриламидном геле выше: т.о. белков сыворотки можно выделить 18 фракций, а на бумаге только 5 основных
(альбумины, α1-, α2-, β-, γ-глобулины)
Для обнаружения белковых фракций бумагу или гель обрабатывают красителем.
Окрашенный комплекс белков выявляет расположение различных фракций на носителе.
4. Ионообменная хроматография основана на различии знака и величины заряда
белков при определенном значении pН
При пропускании раствора белков через хроматографическую колонку,
заполненную твердым пористым заряженным материалом, часть белков задерживается на нем в результате электростатических взаимодействий.
В качестве неподвиж. фазы используют ионообменники – полимерные
орг. вещества, содержащие заряженные функциональные группы.
«+» заряженные анионообменники (диэтиламиноэтилцеллюлоза, содержащая катионные группы)
«-» заряженные катионообменники (карбоксиметилцеллюлоза, содержащвя анионные группы)
При пропускании раствора белка через колонку прочность связывания белка с
ионообменником зависит от количества заряженных групп в молекуле.
Белки, адсорбированные на ионообменнике, можно смыть (элюировать)
буферными растворами с различной конц. соли и разными значениями рН. Постепенное увеличение концентрации соли или изменение рН меняет заряд белковой молекулы, что приводит к выделению белковых фракций, в одной из которых находится искомый белок
5. Аффинная хроматография – основана на избирательном взаимодействии
белков с лигандами, прикреплёнными к твёрдому носителю.
В качестве лиганда может быть использован субстрат или кофермент, если
выделяют какой-либо фермент, антигены для выделения антител и т.д.
Через колонку, заполненную иммобилизованным лигандом, пропускают раствор,
содержащий смесь белков. К лиганду присоединяется только белок, специфично взаимодействующий с ним; все остальные белки выходят с элюатом
Белок, адсорбированный на колонке, можно снять, промыв её раствором с
изменённым значением рН или изменённой ионной силой. В некот. случаях используют раствор детергента, разрывающий гидрофобные связи между белком и лигандом.
Аффинная хроматография отличается высокой избирательностью и помогает очистить выделяемый белок в тысячи раз.
Методы количественного определения белков.
1. Колориметрия – физический метод химического анализа, основанный на
определении концентрации вещества по интенсивности окраски растворов
Биуретовый метод – образование в щелочной среде комплекса пептидных связей с ионами меди. 540нм
Метод Лоури- образование комплекса ароматических АК с реактивом Фолина + биуретовая реакция. 750нм
Метод Брэдфорд- основан на связывании с белками красителя кумасси синего,
спектр поглощения которого при этом меняется. 595нм
2. Спектрофотометрия – физико-химический метод исследования растворов и твёрдых веществ, основанный на изучении спектров поглощения в ультрафиолетовой (200—400 нм), видимой (400—760нм) и инфракрасной (>760 нм) областях спектра.
Спектрофотометрический метод – основан на способности ароматических АК
поглощать УФ свет 280 нм.
