
- •Вопрос 7 Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции белков. Комплементарность взаимодействующих белков с лигандом. Обратимость связывания.
- •Вопрос 9 Физико-химические свойства белков. Молекулярная масса, размеры и форма, растворимость, ионизация и гидратация.
- •2. Различия белков по форме молекул
- •1. Реакции осаждения белков бывают обратимыми и необратимыми.
Вопрос 6
Конформация пептидных цепей в белках (третичная структура). Типы химических связей, участвующих в формировании третичной структуры. Доменная структура и ее роль в функционировании белков. Роль шаперонов (белки теплового шока) в формировании третичной структуры белков in vivo.
Третичная структура – укладка полипептидной цепи (ППЦ) в глобулу ("клубок"),
образующаяся за счёт взаим-й между радикалами АК, которые могут располагаться на значительном расстоянии друг от друга в ППЦ.
В стабилизации третичной структуры белка принимают участие:
1. Гидрофобные взаимодействия – при укладке ППЦ белка стремится занять
наиболее энергетич. выгодную конформацию, белок при этом свертывается таким образом, чтобы:
Гидрофобные радикалы АК были внутри молекулы (между ними происходят гидрофобные взаимодействия и обр. «гидрофобное ядро»)
Гидрофильные радикалы АК снаружи
Белки мембран имеют обратное устройство: снаружи гидрофобные радикалы АК, внутри гидрофильные
2. Ионные связи возникают между противоположно заряженными радикалами АК
остатков (например, между «-» заряж. карбокс. гр. аспарагиновой и глутаминовой к-т и «+» заряж. гр. радикалов лизина, аргинина)
3. Водородные связи возникают между гидрофильными незаряж. гр. (-OH,
-CONH2, -SH) и др. гидрофильными группами
4. Ковалентные связи: между двумя остатками цистеина обр. дисульфидные
мостики при взаимодействии их -SH гр. (в первич. стр-ре они могут находиться далеко друг от друга, но при формировании третич. стр-ры они сближаются и связываются ковалентно)
Например: инсулин, состоящий из 2х ППЦ (А и В), которые соединены 1
дисульфидной связью, и еще 1 дисульфидная связь имеется в цепи А
Для длинных ППЦ (200 или более АК остатков) характерна доменная структура.
Домен – участок ППЦ, который в процессе формирования пространств. стр-ры,
независимо от др. участков той же ППЦ, приобрел конформацию глобулярного белка.
Многие белки состоят из нескольких структурных доменов.
Их выделяют, действуя на белок протеолитическими ферментами, легко разрывающими пептидные связи на участке ППЦ, расположенной между доменами
Роль доменов в функционировании белка:
Центры связывания белка с лигандом часто располагаются между доменами (центр
связывания трипсина с его лигандом – пищевым белком)
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка.
Разные домены в белке могут перемещаться относительно друг друга при взаимодействии с лигандом (например, в молекуле гексокиназы).
Домены могут выполнять разные функции, самостоятельно связываясь с лигандами
Многофункциональные белки – их домены выполняют самостоятельные функции, связываясь с различными лигандами.
Фолдинг белка – процесс укладки вытянутой полипептидной цепи в правильную
трехмерную пространственную структуру.
В процессе синтеза ППЦ, транспорта их через мембраны, при сборке олигомерных
белков возникают промежуточные нестабильные конформации, склонные к агрегации.
На вновь синтезированном полипептиде имеется множество гидрофобных радикалов, которые в трёхмерной структуре спрятаны внутри молекулы. Поэтому на время формирования нативной конформации реакционноспособные АК остатки одних белков должны быть отделены от таких же групп других белков.
Шапероны – белки, способные связываться с белками, находящимися в неуст.
состоянии, стабилизируя их конформацию и обеспечивая фолдинг
В соответствии с молекулярной массой все шапероны можно разделить на 6 основных групп:
Высокомолекулярные, с молекулярной массой от 100 до 110 кДа;
Ш-90 – с молекулярной массой от 83 до 90 кДа;
Ш-70 – с молекулярной массой от 66 до 78 кДа;
Ш-60;
Ш-40;
Низкомолекулярные шапероны с молекулярной массой от 15 до 30 кДа.
Среди шаперонов различают:
Конститутивные белки (высокий базальный синтез которых не зависит от
стрессовых воздействий на клетки организма)
Индуцибельные, синтез которых в нормальных условиях идёт слабо, но при
стрессовых воздействиях на клетку резко увеличивается – они относятся к «белкам теплового шока», быстрый синтез которых отмечают в клетках, которые подвергаются стрессовым воздействиям
Синтез БТШ увел-ся при воздействии различных стрессовых факторов (высокая
температура, гипоксия, инфекция, УФО, изменение рН среды, действие токс. хим. веществ, тяжёлых Ме и т.д.). Они имеют высокое сродство к гидрофобным участкам частично денатурированных белков и потому могут препятствовать их полной денатурации и восстанавливать нативную конформацию белков.
Кратковременные стрессовые воздействия увеличивают выработку БТШ и
повышают устойчивость организма к длительным стрессовым воздействиям. (кратковрем. ишемия миокарда в период бега значительно повышает устойчивость миокарда к длительной ишемии)
Вопрос 7 Активный центр белков и его специфическое взаимодействие с лигандом как основа биологической функции белков. Комплементарность взаимодействующих белков с лигандом. Обратимость связывания.
Для функционирования белка необходимо присоединение к его активному
центру другого вещества – лиганда
Активный центр белков (АЦ) – изолированный участок белковой молекулы
находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом.
Высокая специфичность связывания белка с лигандом обеспечивается
комплементарностью структуры активного центра белка структуре лиганда.
Комплементарность – пространственное и химическое соответствие
взаимодействующих молекул.
Лиганд должен обладать способностью входить и пространственно совпадать
сконформацией активного центра (совпадение может быть неполным, но благодаря конформационной лабильности белка АЦ способен к небольшим изменениям и "подгоняется" под лиганд)
Между функциональными группами лиганда и радикалами АК, образующих АЦ
должны возникать связи, удерживающие лиганд в активном центре: нековалентные (ионными, водородными, гидрофобными), и ковалентные.
Уникальные свойства активного центра зависят:
От химических свойств формирующих его аминокислот
От точной взаимной ориентации в пространстве.
Даже незначительные нарушения общей конформации белка в результате точечных
изменений его первичной структуры или условий окружающей среды могут привести к изменению хим. и функциональных свойств радикалов, формирующих АЦ, нарушать связывание белка с лигандом и его функцию.
При денатурации активный центр белков разрушается, и происходит
утрата их биологической активности.
Основное свойство белков, лежащее в основе их функций – избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
В некоторых случаях лиганд присоединяется только к одному из атомов обладающему определённой реакционной способностью: О2 присоединяется только к Fe гемоглобина, но это обусловлено расположением радикалов АК, окружающих атом железа в составе гема.
Многообразие лигандов:
Лигандами могут быть неорг. (часто ионы Ме) и орг. вещества,
низкомолекулярные и высокомолекулярные вещества;
Существуют лиганды, которые изменяют свою хим. стр-ру при присоединении к
активному центру белка (изменения субстрата в активном центре фермента);
Существуют лиганды, присоединяющиеся к белку только в момент
функционирования (например, О2, транспортируемый гемоглобином)
Лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при
функционировании белков (например, железо, входящее в состав гемоглобина).
Большинство ферментов – белковые молекулы, которые не могут функционировать без присоединения небелковой части
В АЦ многих ферментов присутствует:
Кофактор – ион металла
Кофермент – органическая небелковая молекула
Простетическая группа – небелковая часть, прочно связанная с активным центром белка и необходимая для его функционирования.
Например: Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо
Соединение протомеров в олигомерном белке – пример взаимодействия высокомолекулярных лигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами.
Например: белок кальмодулин после связывания с четырьмя ионами Са2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.
Взаимодействие белка с лигандом - процесс обратимый.
Скорость взаимодействия «белок–лиганд» определяется конц. белка и лиганда в растворе, а также степенью их комплементарности.
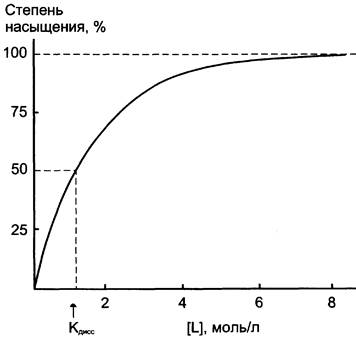
Этот процесс характеризуется константой диссоциации и описывается уравнением:
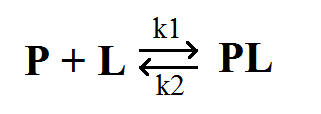
Р – белок, L – лиганд, PL – комплекс белка с лигандом
К1, К2 – соответственно константы скорости связывания/распада комплекса РL
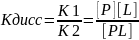
[P], [L], [PL] – соотв-но конц. белка, лиганда, их комплекса
Чем меньше Кдисс, тем больше молекул лиганда связано с белком, тем больше
комплементарность между Р и L
При постоянной концентрации белка увеличение концентрации лиганда приводит к
росту концентрации комплекса [РL]. Эта зависимость носит характер гиперболы
Кривая стремится к максимуму, когда при некоторой концентрации
лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом).
При полунасыщении белка лигандом концентрации [РL] и [Р] равны, и из
уравнения Кдисс, приведённого выше, следует, что Кдисс = [L], т. е. Кдисс численно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. По кривой насыщения, можно найти Кдисс и оценить сродство данного белка лиганду.
Вопрос 8
Четвертичная структура белков. Особенности строения и функционирования олигомерных белков на примере гемоглобина. Кооперативные изменения конформации протомеров. Возможность регуляции биологической функции олигомерных белков аллостерическими лигандами.
Четвертичная структура – способ укладки в пространстве отдельных ППЦ,
обладающих одинаковой (или разной) первичной, вторичной или третичной структурой, и формирование единого в структурном и функциональном отношениях макромолекулярного образования.
В образовании четвертичной структуры белка принимают участие те же связи, что
и при образовании третичной структуры, за исключением ковалентных.
Протомер – каждая отдельная ППЦ в четвертичной стр-ре (чаще всего не обладает
биологической активностью).
Олигомерные белки содержат от 2 до 312 протомеров с одинаковыми или
разными молекулярными массами – от нескольких тысяч до сотен тысяч.
Например: молекула гемоглобина состоит из 2х одинаковых α- и 2х β-ППЦ,
т.е. представляет собой тетрамер.
Кооперативные изменения конформации протомеров – изменение
конформации (и функц. свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них
Пример: взаимодействие О2 с гемоглобиом
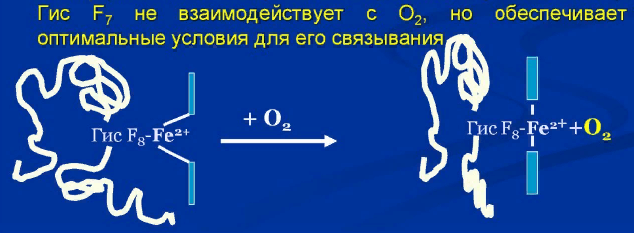
О2 связывается с протомерами Нb через Fe2+, который соединен с 4 атомами азота
пиррольных колец и атомом азота Гис F8 белковой части протомера.
Связывание О2 с оставшейся свободной координационной связью Fe2+ происходит
по другую сторону от плоскости гема в области гис Е7
Гис Е7 сам не связывается с О2, но обеспечивает оптимальные условия.
Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и ППЦ
Т.к. протомер связан с остальными протомерами, а белки обладают
конформационной лабильностью, происходит изменение конформации всего белка.
Конформационные изменения, произошедшие в других протомерах, облегчают
присоединение следующей молекулы кислорода, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой.
Аналогичным образом в тканях диссоциация каждой молекулы О2 изменяет конформацию всех протомеров и облегчает отщепление следующих молекул О2
