
II. хим реакторы
.pdf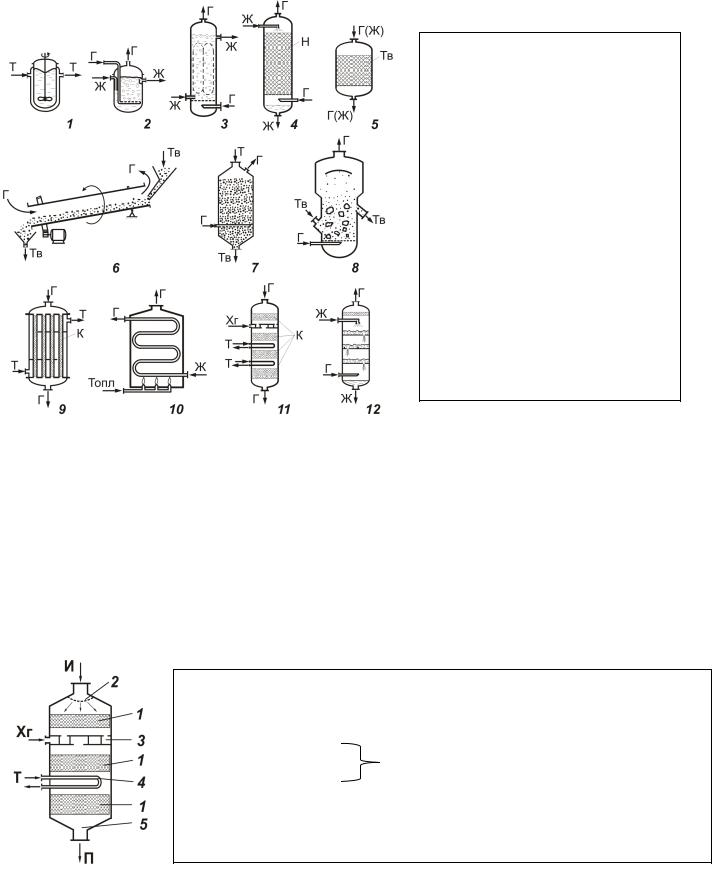
ТЕОРИЯ ХИМИЧЕСКИХ РЕАКТОРОВ
Химический реактор - устройство, предназначенное для проведения в нем химических превращений.
Общий вид реактора и схемы некоторых из них приведены на рис.
Схемы химических реакторов:
1,2 – емкостной;
3 – колонный;
4 – насадочный;
5-8 для систем Г – ТВ;
9, 10 – трубчатый;
11, 12 - многослойный реактор
Г - газ; Ж - жидкость;
Т - теплоноситель; Н - насадка;
Тв - твердый реагент; К - катализатор; Хг - холодный газ; Топл – топливо.
Классификация реакторов:
по организации мат. потоков (вытеснение, смешения, неидеальный)
по организации тепл. потоков (изотермический, адмабатический, автотермический, с теплообменом (внутренним или внешним))
принцип действия (периодический (непроточный), непрерывный (проточный), полупериодический)
по назначению (гомогенный, гетерогенный, каталитические)
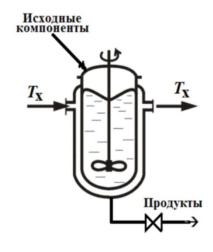
Функциональные (структурные) элементы реактора:
1 |
- реакционная зона (объем реактора, в котором протекает хим. реакция); |
||
2 |
- входное и распределительное устройство; |
||
3 |
- смеситель, |
|
|
Для изменения состава и температуры |
|
||
|
|
|
|
4 |
- теплообменник, |
потока между реакционными зонами |
|
5 |
- выходное устройство; |
|
|
|
|
||
Хг - холодный газ; Т - теплоноситель; И и П - исходный и конечный продукты соответственно
Общий вид математической модели процесса в химическом реакторе
Этапы построения математической модели реактора:
1.Изучить схему организации потоков и их структуру
2.Выбрать элементарный объем в котором отсутствуют градиенты любого параметра
3.Для элементарного объема получить наблюдаемую скорость превращения. Рассмотреть явления переноса, оказывающие влияние на протекание хим. процесса в элементарном объеме
4.Составить уравнение материального и теплового баланса для элементарного объема в алгебраической и дифференциальной форме.
5.Отнести балансовые уравнения ко всему объему или проитегрировать уравнение по всему объему.
Математическая модель процесса в химическом реакторе выглядит
следующим образом: |
|
dN/dt = Nвх + Nист; |
(4.1) |
dq/dt = Qвх + Qист. |
(4.2) |
Здесь dN/dt и dq/dt - накопление вещества и теплоты в выделенном элементарном объеме; Nвх, Qвх - материальные и тепловые потоки, входящие в выделенный объем (покидающие объем потоки имеют отрицательное значение); Nист, Qист - источники вещества и тепла внутри выделенного объема.
Источником вещества является химическая реакция, источником тепла - химическая реакция и фазовые превращения.
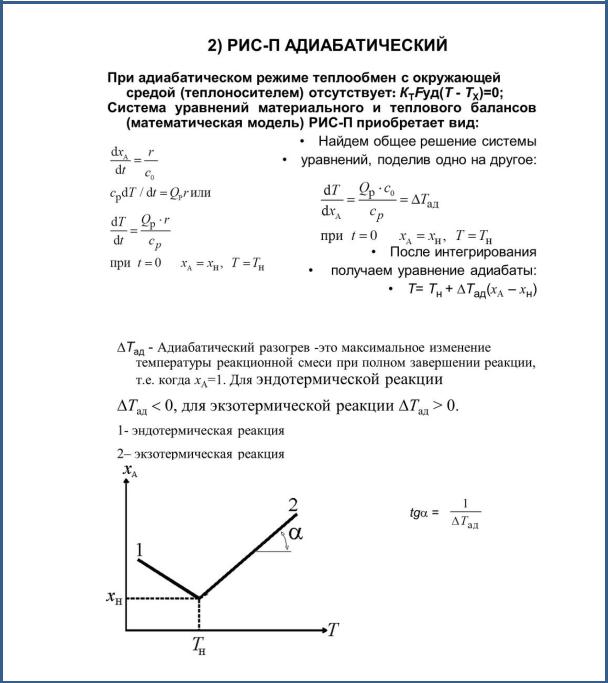
Режим (модель) идеального смешения периодический - ИС-п.(рактор1)
Все компоненты загружаются одновременно. За счет интенсивного перемешивания концентрации и температуры в каждый момент времени одинаковы по всему объему vp реакционной зоны (реактора).
ТX - температура теплоносителя
FT - площадь поверхности теплообмена КT - коэффициент теплообмена - КT.

Процесс - нестационарный. В реакторе нет входящих и выходящих потоков иNвх = 0. Источником i-го вещества является химическое превращение:
Nист,i = Wi(С, Т)vp.
Количество вещества в реакторе Ni = vpСi, тогда уравнение (4.1) принимает вид:
dСi/dt = Wi(С, Т); |
(4.3) |
Источник теплоты – тепловой эффект химического превращения |
(для |
единственной реакции Qист = QPr(С, Т)vp) и теплообмен с теплоносителем КTFT(ТX - Т). Уравнение 4.2 примет вид:
dq/dt = QPr(С, Т)vp + КTFT(ТX - Т).
Изменение количества теплоты в реакторе: dq = сpvpdТ (теплоемкость сp
неизменна), удельная поверхность теплообмена: Fуд = FT/vp: |
|
|
|
||||
|
|
сpdТ/dt = QPr(С, Т) - КTFуд(Т - ТX); |
(4.4) |
||||
|
|
|
|
|
|
|
|
|
|
|
dСi/dt = Wi(С, Т); |
|
|
|
|
Математическая модель РИС-п: |
сpdТ/dt = QPr(С, Т) - КTFуд(Т - ТX); |
|
|
||||
|
|
|
при нач. условиях: С=С0, |
Т=Т0, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Режимы работы РИС-п
*Более подробно в РИВ
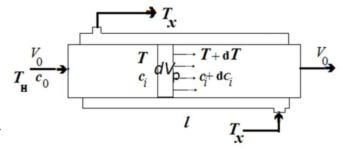
Режим (модель) идеального вытеснения - ИВ. (реакторы 4-7,9-11)
Процесс непрерывный, стационарный. Поток течет через реактор без перемешивания. Профиль скорости по сечению – плоский.
Реактор представим в виде трубки сечением S, через который проходит поток величиной V0 - рис. 4.3, в. Выделим элементарный объем - участок толщиной dl и объемом dvp = Sdl. В него с потоком входит компонент i в количестве V0Сi и выходит V0(Сi + dСi). Источник вещества в выделенном объеме - химическое
превращение Nист,i = Wi(С, Т)dvp.
0= V0Сi - V0(Сi + dСi) + Wi(С, Т)dvp.
Процесс стационарный, объем реакционной смеси не меняется, и уравнение (4.1)
примет вид: |
|
dСi/d = Wi(С, Т); |
(4,7) |
Условное время реакции связано со скоростью потока u выражением = l/u. |
|
Тепловое уравнение процесса (4.2): V0сpТ - тепловой поток, входящий в элементарный объем, и V0сp(Т + dТ) - выходящий из него; QPr(С, Т)dvp + КTdFT(ТX - Т) - источники теплоты (реакция и теплообмен через боковую поверхность dFT в выделенном объеме).
0= V0сpТ - V0сp(Т + dТ) + QPr(С, Т)dvp + КTdFT(ТX - Т).
Fуд = dFT/dvp - удельная поверхность теплообмена, - условное время
реакции. Получаем следующее выражение: |
|
|
|
сpdТ/d = QPr(С, Т) - КTFуд(Т - ТX); |
(4.8) |
||
|
|
|
|
Математическая модель РИВ: |
dСi/d = Wi(С, Т); |
|
|
сpdТ/d = QPr(С, Т) - КTFуд(Т - ТX); |
|
|
|
|
|
|
|
|
при нач. условиях: С=С0, Т=Т0, при |
|
|
|
|
|
|
Изотермический режим РИС-п и РИВ
Процессы в реакторах, работающих в режимах идеального смешения периодическом (РИС-п) и идеального вытеснения (РИВ) описываются математически идентичными уравнениями. Полагая , t в зависимости от процесса, для дальнейшего рассмотрения используем уравнение вида:
dС/d = W(С), С = С0 при = 0. |
(4.10) |

Простая необратимая реакция А = В.
Математическая модель процесса, скорость превращения исходного компонента которого описывается уравнением W(С) = -kС (реакция первого порядка), имеет вид:
dСA/d = -r = -kСA, СA = С0 |
при = 0. |
(4.11) |
|||||||||
Решением уравнения (4.10) являются зависимости: |
|
||||||||||
|
1 |
ln |
CA |
; |
CA C0e k ; |
(4.12) |
|||||
|
|
||||||||||
|
|
|
k |
|
C0 |
|
|
||||
|
1 |
ln |
1 |
|
; |
xA 1 e k . |
(4.13) |
||||
|
|
|
|
||||||||
|
k |
1 xA |
|
|
|||||||
Графическое представление С( ) |
из уравнения (4.12) |
и х( ) для исходного |
|||||||||
вещества из уравнения (4.13) иллюстрирует рис. (n =1).
Влияние порядка реакции.
Для реакции n-го, скорость превращения
исходного компонента описывается выражением W(С) = - r = - kСn,уравнение
(4.11) преобразуется к виду:
dСA/d = -kСAn или dхA/d = kС0n-1(1 - хA)n.
(4.14), решением которого является следующая зависимость С( ):
1 n |
1 1 n |
|
CA C0 |
1 n k |
.(4.15) |
Рис 4.4 Зависимость концентрации исходного вещества C (а) и степени превращения x (б) от для простых необратимых реакций разного порядка n в режимах ИВ (или ИС-п).
(показывают влияние условий процесса на измен-е С и х во времени (РИС-п) или по длине реактора(РИВ) )
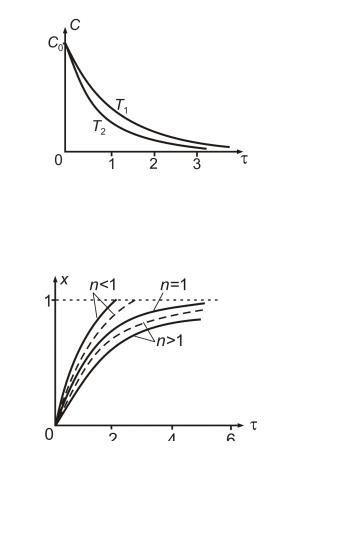
В л и я н и е т е м п е р а т у р ы .
Только константа скорости k зависит от температуры (по уравнению Аррениуса k = k0exp(-Е/RТ)), увеличиваясь вместе с ней. Таким образом, с ростом температуры скорость реакции увеличивается, концентрация исходного компонента быстрее уменьшается со временем, и интенсивность процесса возрастет (рис. 4.5).
Рис. 4.5. Влияние температуры Т на зависимость C( ) (T2 > T1)для режима ИВ (или ИС-п)
В л и я н и е н а ч а л ь н о й к о н ц е н т р а ц и и
С0 на процесс в реакторе оценивается по
двум |
факторам: |
производительности |
|
|
процесса и изменению степени превращения |
|
|||
при определенной нагрузке на реактор V0. |
|
|||
Увеличение концентрации С (и С0) исходного |
Рис. 4.6. Влияние C0 на изменение функции |
|||
компонента |
вызывает |
повышение скорости |
x( ) для реакций порядка n для режима ИВ |
|
|
||||
реакции |
r |
= kСn, |
что вызывает рост |
(или ИС-п); сплошные линии получены при |
производительности процесса. |
C01, штриховые – при C02 > C01 |
|||
|
||||
С другой стороны увеличение концентрации приводит к возрастанию количества вещества, которое надо превращать. Для реакций с n = 1 начальная концентрация С0 не влияет на зависимость х( ) (уравнение 4.13). Если n > 1, то с ростом С0 степень превращения возрастает (уравнение 4.15). Если n < 1, то с увеличением С0, х медленнее меняется во времени, степень превращения уменьшается (рис. 4.6)
Простая обратимая реакция А = R.
Скорость простой обратимой реакции r(С) = k1СA зависит от концентрации двух реагентов. Выразим математическую модель процесса через степень превращения реагента А (СA = С0(1- хA), СR = С0 хA, С0 – исходная концентрация А):
dхA /d = k1(1 - хA) - k2 хA, хA = 0 при = 0. |
(4.16) |
|||||||||
После интегрирования: |
|
|
|
|
|
|
|
|
|
|
|
|
|
k1 |
|
|
e |
k1 k2 |
|
. |
(4.17) |
xA |
k |
k |
|
1 |
|
|
||||
|
|
2 |
|
|
|
|
|
|||
|
1 |
|
|
|
|
|
|
|
||
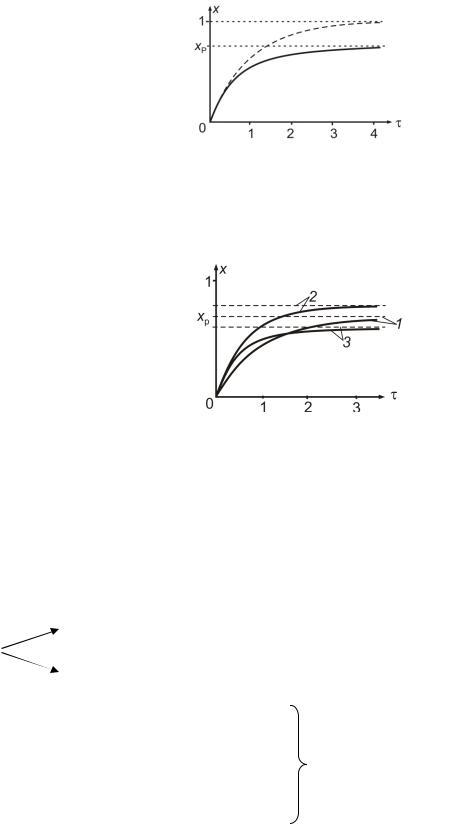
В отличие от простой необратимой реакции, протекающей до конца (х = 1), обратимая реакция протекает до равновесия, предельная степень превращения в этом случае равна равновесной (х = хP) рис. 4.7 (n = 1).
Рис. 4.7. Зависимость степени превращения x от для простой обратимой (сплошная линия) и для необратимой реакции (штриховая) в режимах ИВ (или ИС-п)
В л и я н и е т е м п е р а т у р ы .
Повышение температуры приводит к
росту константы скорости как прямой k1, так и обратной k2 реакции. Насколько каждая их констант влияет на общую скорость реакции определяется соотношением их энергий активации (соответственно Е1 и Е2). Для экзотермической реакции QP > 0 (QP = Е2 - Е1), Е2 > Е1, и k2 (и скорость обратной реакции) увеличивается с температурой сильнее, чем k1 (и скорость прямой реакции). Для эндотермической это соотношение будет обратным.
Рис. 4.8. Зависимость x( ) при температурах Т1 (1) и Т2 > Т1 (2, 3) для эндотермической (2) и экзотермической (3) реакций в реакторе ИВ (или ИС-п); штриховыми линиями показаны равновесные степени превращения xр для тех же условий
Сложная реакция с параллельной схемой превращения |
|
|||||||||||||
k1 |
|
|
R |
|
|
|
|
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k2 |
|
|
S |
|
|
|
|
|
|
|
|
|
|
|
Математически процесс описывается уравнениями (n=1): |
|
|||||||||||||
|
|
dСA/d = -(k1+k2)СA; |
|
|||||||||||
|
|
|
|
dСR/d = k1СA; |
(4.18) |
|||||||||
|
|
dСS/d = k2СA; |
|
|
||||||||||
|
|
СA = С0, СR = СS = 0 при = 0. |
|
|||||||||||
Решим систему уравнений (4.18) относительно концентраций реагентов А, R и S: |
||||||||||||||
CA C0e |
k1 k2 |
; |
(4.19) |
|||||||||||
|
|
|
|
|
|
|
|
|||||||
C |
R |
|
|
k1 |
|
C |
0 |
1 e k1 k2 ; |
(4.20) |
|||||
|
k1 k2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
1 e k1 k2 . |
|
|||||
C |
|
|
|
k2 |
|
C |
0 |
(4.21) |
||||||
|
|
|
||||||||||||
S |
|
k1 k2 |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||
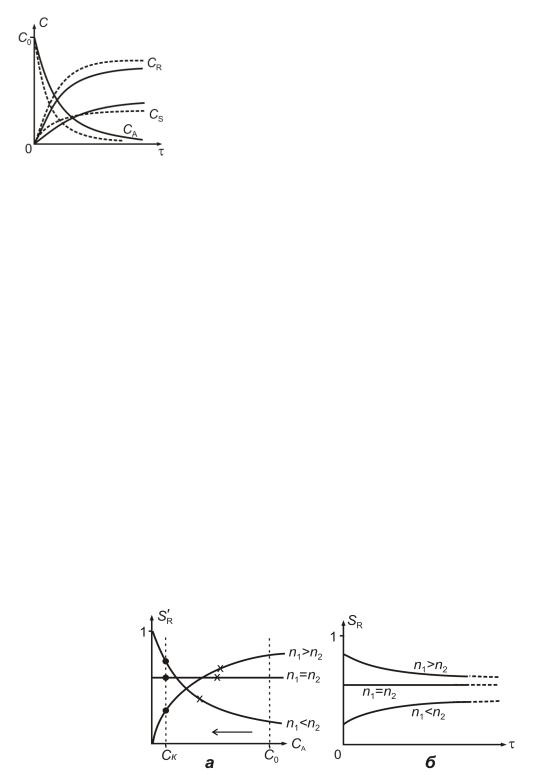
Рис. 4.9. Изменение концентрации реагентов в реакторе ИВ (или ИС-п) при протекании сложной параллельной реакции: сплошные линии построены при температуре Т1, штриховые - при Т2 > Т1 и E1 >
E2
В л и я н и е т е м п е р а т у р ы .
Если Е1 > Е2 (Е1 - энергия активации реакции, в которой образуется продукт R), то при повышении температуры, концентрация продукта R возрастет при всех . Концентрация продукта S (CS) вначале возрастет за счет увеличения скорости превращения, а затем – уменьшится, т.к. большая доля А будет превращаться в R
(рис. 4.9).
С е л е к т и в н о с т ь п р о ц е с с а
зависит не только от соотношения констант скоростей реакций, но и от их порядка (см. прошлые лекции). По мере протекания процесса в реакторе, с увеличением и уменьшением СA, селективность процесса SR будет меняться в интервале между С0 и текущим значением СA (направление изменения показано стрелкой на рис. 4.10, а) как среднеинтегральная величина значений дифференциальной селективности SR'. Если n1 = n2 (n1 и n2 – порядки частных реакций образования R и S, соответственно) то, следуя уравнениям 4.20 и 4.21, изменения S'R и SR в ходе реакции не происходит (рис. 4.10, а и б). Характер изменения селективности в ходе реакции в случае n1 > n2 и n1 < n2 представлен на рис. 4.10.
Рис. 4.10. Зависимость дифференциальной селективности S R для параллельной реакции от концентрации СА (а) и интегральной селективности SR от (б) в реакторе ИВ при различном соотношении порядков частных реакций n1 и n2
