
II. хим реакторы
.pdf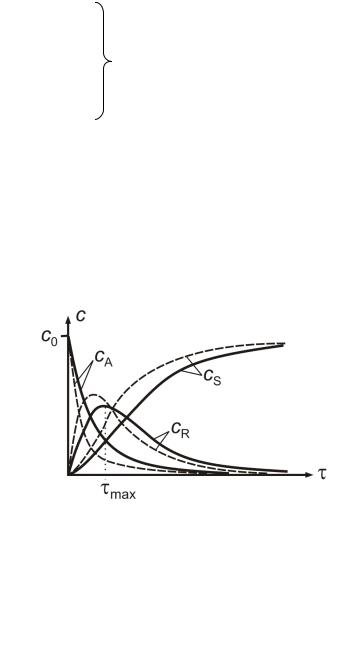
П р а к т и ч е с к и е в ы в о д ы . При n1 = n2 достигаемая в реакторе степень превращения не будет влиять на селективность процесса. Если n1 > n2, то достижение высоких степеней превращения может быть нецелесообразным из-за уменьшения избирательности по продукту R. Если n1 < n2, то увеличение степени превращения благоприятно для селективности по продукту R. Повышение температуры благоприятно и для интенсивности, и для селективности процесса, если Е1 > Е2. В противоположном случае (Е1 < Е2) снижение температуры благоприятно для селективности процесса в ущерб его интенсивности.
Сложная реакция с последовательной схемой превращения
k1 |
k 2 |
А R S |
|
Математически процесс описывается системой уравнений (n=1): |
|
dСA/d = -k1СA; |
|
dСR/d = k1СA - k2СR; |
(4.22) |
dСS/d = k2СR; |
|
СA = С0, СR = СS =0 при = 0.
Решим систему уравнений (4.22) относительно концентраций реагентов А, R и S:
|
|
C |
A |
C |
0 |
e k1 ; |
|
|
(4.23) |
|||||||||
|
|
|
|
|
|
|
|
|
|
C0 e k1 e k2 ; |
|
|||||||
|
|
CR |
|
|
|
|
k1 |
|
|
|
(4.24) |
|||||||
|
|
k1 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
k2 |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
k |
2 |
e k1 |
k e k2 |
|
|
||
|
|
C |
|
C |
|
|
1 |
|
|
|
|
1 |
. |
(4.25) |
||||
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
S |
|
|
0 |
|
|
|
|
|
|
k2 k1 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Графически зависимости (4.23), (4.24), |
|
|
|
|
|
|
|
|
|
|||||||||
(4.25) представлены на рис. 4.11. |
|
|
|
|
|
|
|
|
|
|||||||||
Максимум на кривой СR соответствует |
|
|
|
|
|
|
|
|
|
|||||||||
Rmax - моменту, когда скорости |
|
|
|
|
|
|
|
|
|
|||||||||
образования |
и |
расходования |
|
|
|
|
|
|
|
|
|
|||||||
промежуточного |
|
продукта |
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
||
сравниваются, а также СRmax |
|
|
– |
|
|
|
|
|
|
|
|
|
||||||
максимальному |
содержанию продукта |
|
|
|
|
|
|
|
|
|
||||||||
R в смеси. Интегральная селективность |
|
|
|
Рис. 4.11. Изменение концентрации реагентов в |
||||||||||||||
по продукту R уменьшается с глубиной |
|
|
|
реакторе ИВ (или ИС-п) при протекании |
||||||||||||||
превращения. |
|
|
|
|
|
|
|
|
|
|
|
|
последовательной |
реакции; |
сплошные линии - |
|||
|
|
|
|
|
|
|
|
|
|
|
|
при температуре Т1 |
и Е1, штриховые - при T2 > T1 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
и E1 > E2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

В л и я н и е т е м п е р а т у р ы . |
|
|
|
|
|
||||
Вследствие увеличения температуры изменение |
|
|
|
||||||
концентрации любого компонента происходит |
|
|
|
||||||
за меньшее время, следовательно, Rmax – время |
|
|
|
||||||
достижения |
максимального |
количества |
|
|
|
||||
продукта R уменьшается (рис. 4.11). Если Е1 > |
|
|
|
||||||
Е2 (Е1 - |
энергия активации |
первой |
частной |
Зависимость |
интегральной |
||||
реакции), |
то |
увеличение |
|
температуры |
селективности SR от в РИВ (или |
||||
|
РИС-п) |
при |
протекании |
||||||
способствует |
большему |
|
выходу |
||||||
|
последовательной |
реакции; |
|||||||
промежуточного |
продукта |
R, а |
также |
||||||
штриховая |
линия |
построена при |
|||||||
|
|
|
|
|
|
||||
увеличению селективности по R. |
В обратном |
температуре Т1 и Е1, сплошная – |
|||||||
случае (Е2 > Е1) |
максимальная концентрация и |
при T2 > T1 |
и E1 > E2 |
||||||
селективность по R уменьшатся.
П р а к т и ч е с к и е в ы в о д ы . Максимальный выход промежуточного продукта R обеспечивает проведение процесса при max (длина реактора ИВ или время периодического процесса). Уменьшение приведет к увеличению селективности по R в ущерб общему превращению. Увеличение приведет к потери как в селективности SR, так и выходе продукта R. Если же целевой продукт - конечный (S), то следует добиваться как можно большей степени общего превращения. Увеличение температуры целесообразно, если Е1 > Е2 – в этом случае возрастет и интенсивность, и выход R, и селективность по R.
Адиабатический режим РИС-п и РИВ
Исходя из идентичности математических моделей процессов в реакторах ИС–п и ИВ, воспользуемся описанием процесса в режиме ИВ (уравнения (4.7 и 4.8) и преобразуем их в случае протекания простой реакции А = В (WА(C,T) = -r(C,T)), используя определение степени превращения:
dT
d
|
|
|
dx |
|
r C,T |
; |
|
||||
|
|
|
d |
|
|
C0 |
|
|
|
||
|
QpC0 r |
C,T |
|
|
Kт Fуд |
T Tx |
|||||
cp |
|
|
|
C0 |
|
ср |
|||||
|
|
|
|
|
|||||||
|
x xн , |
|
T Tн |
при 0. |
|||||||
; (4.28)
Следует обратить внимание, что С0 - начальная концентрация исходного компонента в непрореагировавшей смеси не равна Сн - концентрация этого же компонента на входе в реактор, в случае когда хн 0.
Обозначим QPС0/сP как Tад (адиабатический разогрев), отношение r(С,Т)/С0
выразим как r(х, Т), а выражение КтFуд/сP как В - параметр теплоотвода:

Система (4.28) приобретает вид:
dx d r x,T ; |
|
|
|
|
|
|
|
dT d Tадr x,T B T Tx ; |
(4.29) |
||
x xн |
T Tн при = 0. |
|
|
|
|
||
Система уравнений (4.29) в общем виде не имеет аналитического решения
Анализ процесса.
В а д и а б а т и ч е с к о м р е ж и м е теплообмена с окружающей средой (теплоносителем) нет, т.е. В = 0 и система (4.29) примет вид:
dx d r x,T ; |
|
|
|||
dT d Tадr x,T ; |
|
|
|||
|
(4.30) |
||||
x x |
н |
T T |
при 0. |
|
|
|
н |
|
|
|
|
Решением системы уравнений (4.30) является линейная зависимость
Т - Тн = Tад(х - хн), (4.31)
где (Т - Тн) - разогрев реакционной смеси до достижения степени превращения х. Разогрев реакционной смеси не зависит пути превращения. Т.е. результат процесса (конечная Т) не зависит от изменения состояния химически реагирующей сис-мы (степени превращения) и не зависит от пути превращения, от кинетики
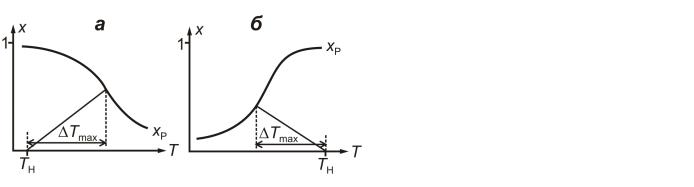
Зависимость х(Т) (рис. 4.15) адиабатического процесса представляет прямую линию с тангенсом угла наклона : tg = 1/ Tад, причем для экзотермической реакции наклон положительный (QP > 0 и Tад > 0), для эндотермической - отрицательный (QP 0 и Tад 0). Чем больше абсолютное значение Tад, тем

реакционная смесь будет сильнее разогреваться или охлаждаться (штриховая линия на рис. 4.15 для экзотермической реакции).
Рис. 4.15. Зависимость x(Т) для адиабатического процесса в режиме ИВ: 1 - эндотермическая реакция; 2, 3- экзотермическая реакция (сплошная линия соответствует Тад, штриховая -
Т’ад > Тад)
Изменение Т и х с в ходе экзотермического и эндотермического процесса показано на рис. 4.16 и 4.17.
Рис. 4.16-1. Профили |
температуры Т(а) и |
Рис. 4.17. Профили температуры Т(а) и степени |
||||
степени превращения |
x(б) в режиме ИВ. |
|||||
превращения x(б) в режиме ИВ. Сплошные |
||||||
Сплошные |
линии |
соответствуют |
||||
линии |
соответствуют |
эндоотермическому |
||||
экзотермическому |
адиабатическому процессу |
|||||
адиабатическому процессу; штриховые линии - |
||||||
при Тад(1) и Т ад > Тад(2); штриховые линии |
||||||
изотермическому процессу при температурах Т1 |
||||||
- изотермическому процессу при температурах |
||||||
и Т2. |
|
|
||||
Т1 и Т2. |
|
|
|
|
||
|
|
|
|
|
||
Протекание реакции сопровождается ростом степени превращения х и уеличением (экзорис.4.16) или уменьшением (эндорис.4.17) температуры Т. Максимальный разогрев достигается при х→1 и равен Т’ад. На зависимость влияет исходная концентрация, увеличение которой ведет к повышению адиабатического разогрева ( Т’ад) и ускорению превращения (кривые 2 на рис. 4.16).
Со п о с т а в л е н и е а д и а б а т и ч е с к о г о п р о ц е с с а с и з о т е р м и ч е с к и м д л я РИ В и л и РИ С - п .
Если изотермический процесс осуществляется при температуре Т1 равной Тн (рис. 4.16 и 4.17 штиховые линии), то изотермический процесс в сравнении с адиабатическим экзотермическим будет менее интенсивным, а в сравнении с эндотермическим более интенсивным. Если температура изотермического процесса Т2 > Тн, то изотермический процесс будет интенсивнее адиабатического экзотермического, до тех пор, пока температура экзотермического процесса не станет равной Т2. В эндотермическом процессе при Т2 < Тн картина будет обратной. Если реакция обратимая, то общий характер зависимостей "х - " и "Т - " для экзо- и эндотермических реакций сохраняется, но процесс будет протекать только до равновесной степени превращения (рис. 4.18 зависимость хP(Т) и х(Т)). Пересечение этих линий соответствует максимальному разогреву в слое - Tmax.
Рис. 4.18. К определению максимального адиабатического разогрева Тmax при протекании обратимых экзотермической (а) и эндотермической (б) реакций; xр - равновесные степени превращения; прямые - адиабаты в режиме ИВ

Режим (модель) идеального смешения непрерывный - ИС-н.(рактор2,3,8)
Процесс стационарный (dNi/dt = 0 и dq/dt = 0) Благодаря ИС изменение х, с, Т, r, SR в реакторе
происходит мгновенно (скачкообразно)
Влюбой т. реакц. объема устанавл. абсолютно одинаковые значения х, с, Т, r, SR
Св-ва элементарного объема идентичны свойствам всего объема. Объем реакционной смеси не меняется
Вединицу времени в реактор входит поток реагентов объемом V0, содержащий компоненты в количестве V0Сi0. Температура во входном потоке - Т0. Из реактора выходит поток V0 с температурой Т с содержанием каждого компонента - V0Сi..
Источник веществ - химическое превращение: Ni,ист = Wi(С, Т)vp. 0=V0Сi0 - V0Сi+ Wi(С, Т)vp.
vp/V0 = - как условное время реакции (среднее время пребывания реакционной массы в реакционной зоне, определяемое как отношение объема реакц. зоны к объемному расходу реакционной массы при раб. условиях). Уравнение (4.1) примет вид:
(Сi - Сi0)/ = Wi(С, Т). |
(4.5) |
Источник теплоты – хим. превращение QPr(С, Т)vp |
и теплообмен КTFT(ТX - Т). |
0= V0сpТ0 - V0сpТ + QPr(С, Т)vp + КTFT(ТX - Т); |
|
Используя приведенные ранее выражения |
для источника теплоты, |
теплообмена, условного времени реакции и удельной поверхности теплообмена:
сp.(Т - Т0)/ = QPr(С, Т) – КTFуд(Т - ТX). |
(4.6) |
(Сi - Сi0)/ = Wi(С, Т).
Математическая модель РИС-н: сp.(Т - Т0)/ = QPr(С, Т) – КTFуд(Т - ТX). Начальные условия входят в ур-я

Изотермический режим РИС-н
Простая необратимая реакция А = R. Изотермический процесс в проточном реакторе идеального смешения описывается уравнением (4.9, б):
(СA - С0)/ = WA(С)
Найдем концентрацию и степень превращения в реакторе при протекании
реакции первого порядка W(C) = - kC |
|
|
СA = С0/(1 + k), |
хA = k/(1 + k) |
(4.26) |
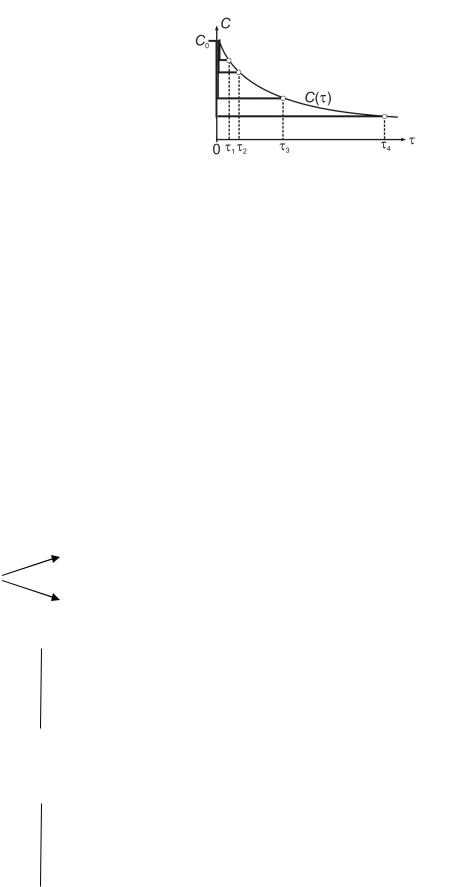
Поскольку = vр/V0 - фиксированная |
|
|||
величина |
для |
каждого |
конкретного |
|
проточного реактора идеального смешения |
|
|||
зависимость С( ) должна быть представлена |
|
|||
точкой (рис. 4.12). Показанная зависимость |
|
|||
С( ) есть зависимость для ряда реакторов |
|
|||
Рис. 4.12. График C( ) для процесса в |
||||
разного объема vp, или для одного реактора |
проточных реакторах идеального |
|||
при разной нагрузке на него V0. |
|
смешения. |
||
|
|
|||
Характер влияния Т, С0, n на С( ) будет такой же, как и в рассмотренном выше процессе в режиме идеального вытеснения (рис 4.4-4.6).
Простая обратимая реакция А = R.
Выразим модель процесса (С - С0)/ = W(С) через степень превращения хA:
xА |
|
|
k1 |
|
(4.27) |
|
k1 k2 |
|
|||
|
1 |
|
|||
Вид зависимость х( ) и влияние на нее температуры будет такое же, как в режиме ИВ. (рис4.7 – 4.8)
Сложные реакции.
Приведены зависимости для частных реакций первого порядка.
П а р а л л е л ь н а я с х е м а п р е в р а щ е н и я : k1 R
А |
|
k2 |
S |
(С0 - СA)/ = -(k1+k2)СA; |
СA = С0/[1 + (k1+k2) ]; |
СR/ = k1СA; |
СR = k1 С0/[1 + (k1 + k2) ]; |
СS/ = k2СA; |
СS = k2 С0/[1 + (k1 + k2) ]. |
П о с л е д о в а т е л ь н а я с х е м а п р е в р а щ е н и я :
kk
А1 R 2 S
(С0 - СA)/ = -k1СA; |
СA = С0/(1 + k1 ); |
СR/ = k1СA - k2СR; |
СR = k1 С0/[(1 + k1 )(1 + k2 ]; |
СS/ = k2СR; |
СR = k1k2 2С0/[(1 + k1 )(1 + k2 ]. |
Зависимость С( ), влияние на нее температуры, а так же изменение избирательности с будет такой же, как и в режиме идеального вытеснения (см.
рис. 4.9 - 4.11).
Адиабатический режим РИС-н
Для в-ва А
Анализ процесса. Математически процесс в проточном реакторе идеального смешения описывается уравнениями (4.5 и 4.6). Используя введенные параметрыTад и В, а также выражение r(х,Т), преобразуем систему (4.5-4.6), как было сделано для модели идеального вытеснения:
|
x r x,T |
|
|
|
T T |
T |
r x,T |
B T T |
|
|
||||
н |
ад |
|
x |
|
В адиабатическом режиме (параметр теплоотвода В = 0):
x xн r x,T |
|
||
T T |
T |
|
|
r x,T |
|||
н |
ад |
|
|
(4.126)
(4.127)
Разделив второе уравнение на первое, получим линейную связь х и Т: Т - Тн =Tад(х - хн), - аналогичное режиму идеального вытеснения (4.31). Конечный результат - разогрев реакционной смеси (Т - Тн) – не зависит от пути превращения – в режиме смешения или вытеснения.
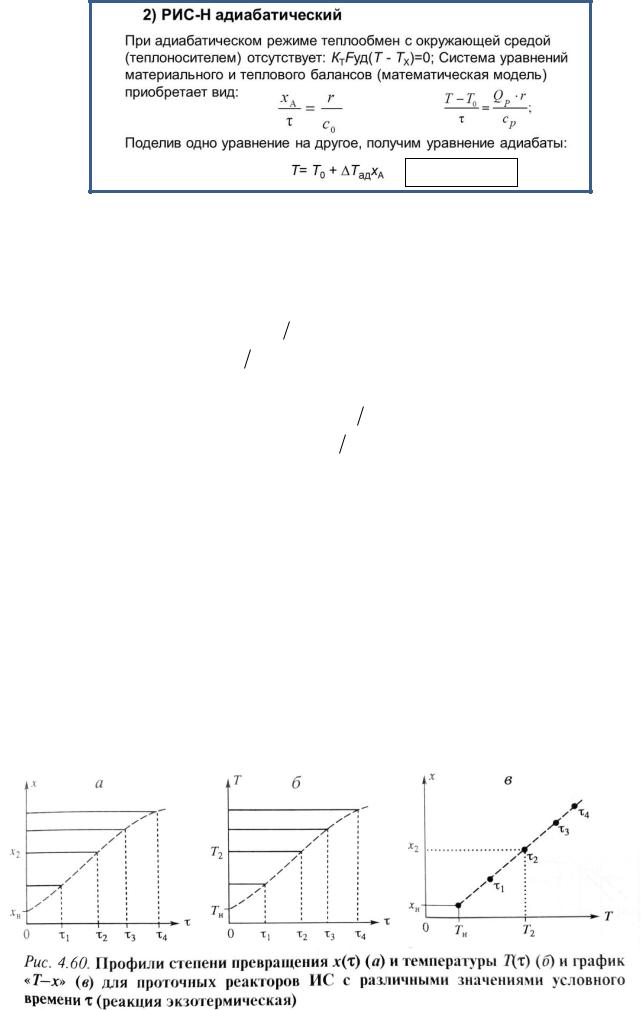
Температура и степень превращения в реакторе будут иметь ступенчатое распределение (рис. 4.12). Кривые Т( ) и х( ) есть графическое отображение функции (4.31), и эти зависимости надо представлять как набор режимов различных реакторов. В координатах "Т-х" режим процесса в реакторе будет представлен двумя точками - начальной при (хн, Тн) и в реакторе с заданным при полученных в нем х и Т (рис. 4.60в), т.е. последовательность точек при разных будет лежать на прямой адиабаты Т = Тн + Tад(х - хн), показанной штриховой линией.

Сравнение и выбор эффективного реактора
Важнейшими показателями работы реактора, определяющими экономичность химического процесса, являются:
1)размер реактора, от которого зависит его интенсивность;
2)избирательность протекающего в нем процесса, т.е. селективность;
3)выход продукта.
Для изотермического режима
При протекании простых необратимых реакций типа A → R превращение идет в одном направлении, и чем выше степень превращения, тем больше выход продукта. Выберем из двух проточных реакторов идеального вытеснения и идеального смешения, реактор меньшего объема vp, требуемого для достижения заданной степени превращения.
(Уравнения РИС-П и РИВ идентичны, поэтому время протекания химической реакции, необходимое для достижения заданной степени превращения, в этих реакторах одно и то же. Но в РИСП полное время процесса складывается из вспомогательного и рабочего времени а в РИВ вспомогательные операции отсутствуют; процесс протекает непрерывно, поэтому интенсивность РИВ выше, чем РИС-П.)
