
- •Расчетно-графическая работа по экологии на тему: «Экологическая оценка ландшафта (на примере Лесной опытной дачи ргау-мсха им. Тимирязева)»
- •Глава I.
- •1.1. История сао
- •1.2.Зеленые насаждения и предприятия.
- •Глава II.
- •2.1. История лод
- •2.2. Рельеф.
- •2.3. Территория.
- •2.4. Почва.
- •2.5. Климат.
- •Глава III.
- •3.1. История Cu.
- •3.2. Нахождение Cu в природе.
- •3.4. Химические свойства Cu.
- •3.5. Биологическая роль.
- •3.6. Производство Cu.
- •3.7. Применение Cu.
- •Глава IV.
- •4.1. Показатель накопления элемента ( ).
- •4.5.Арифметическая и геометрическая прогрессия.
- •4.6. Итоговая таблица экологической характеристики.
3.2. Нахождение Cu в природе.
Среднее содержание меди в земной коре (Кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе).
Медь встречается в природе, как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит(CuFeS2), также известный как медный колчедан, халькозин(Cu2S) и борнит(Cu5FeS4). Вместе с ними встречаются и другие минералы меди: ковеллин (CuS),куприт(Cu2O),азурит (Cu3(CO3)2(OH)2),малахит(Cu2CO3(OH)2). Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах— медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Забайкальском крае, Жезказган в Казахстане, медоносный пояс Центральной Африки и Мансфельд в Германии. Другие самые богатые месторождения меди находятся в Чили (Эскондида и Кольяуси) и США (Моренси). Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %.
3.3. Физические свойства Сu.
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь
обладает высокой тепло- и электропроводностью (занимает
второе место по электропроводности
среди металлов после серебра).
Удельная электропроводность при 20 °C:
55,5-58 МСм/м.
Медь имеет относительно большой температурный
коэффициент сопротивления:
0,4 %/°С и в широком диапазоне температур
слабо зависит от температуры. Медь
является диамагнетиком.
Атомная плотность Cu
=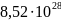 {\displaystyle
8,52\centerdot 10^{28}}
(атом/м³).
{\displaystyle
8,52\centerdot 10^{28}}
(атом/м³).
3.4. Химические свойства Cu.
В
соединениях медь проявляет две степени
окисления: +1 и +2. Соединения с
 бесцветны, а с
бесцветны, а с
 синие, сине-зеленые. Медь
является
слабым восстановителем, не вступает в
реакцию с водой и разбавленной соляной
кислотой. Окисляется концентрированными
серной и азотной кислотами(1), «царской
водкой»(2), кислородом(3), галогенами(4),
оксидами неметаллов(5). Вступает в реакцию
при нагревании с галогеноводородами.
синие, сине-зеленые. Медь
является
слабым восстановителем, не вступает в
реакцию с водой и разбавленной соляной
кислотой. Окисляется концентрированными
серной и азотной кислотами(1), «царской
водкой»(2), кислородом(3), галогенами(4),
оксидами неметаллов(5). Вступает в реакцию
при нагревании с галогеноводородами.
1)Cu + H2SO4 (конц.) → CuO + SO2↑ + H2O
3Cu + 8HNO3( разбав.) → 3Cu(NO3)2+2NO↑+4H2O
2)3Cu
+ 2 + 6HCl →
+ 6HCl →
 + 2NO↑ +
+ 2NO↑ +

3)
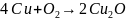

4)
5)
3.5. Биологическая роль.
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина.
Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем молекулярный кислород белке гемоцианине. В крови всех головоногих и большинства брюхоногих моллюсков и членистоногих медь входит в состав гемоцианина в виде имидазольного комплекса иона меди, роль, аналогичная роли порфиринового комплекса железа в молекуле белка гемоглобина в крови позвоночных животных.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
При недостатке меди в хондро- и остеобластах снижается активность ферментных систем и замедляется белковый обмен, в результате замедляется и нарушается рост костных тканей.
Содержание меди в питьевой воде не должно превышать 1 мг/л, однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения сформулировала (ВОЗ) в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта.
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью. Особенно выраженно бактерицидное действие поверхностей из меди (и её сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA.
Излишняя концентрация ионов меди придает воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2—10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
