
- •Основы химической термодинамики
- •Состояние системы - совокупность ее химических и физических свойств, которые подразделяются на термодинамические
- •Энергия системы -
- •Термодинамические функции
- •2. Функции процесса
- •Теплота и работа
- •Работа процесса –
- •Теплота и работа характеризуют качественно и количественно две различные формы передачи движения от
- •Классификация термодинамических процессов
- •2. В зависимости от способа проведения процесса
- •Термохимия
- •Химические реакции, в которых указан тепловой эффект, называются
- •Все фазовые переходы сопровождаются тепловыми эффектами.
- •Второе начало термодинамики
- •Самопроизвольными являются такие процессы, которые сопровождаются диссипацией (рассеиванием) энергии без изменения ее общего
- ••Система изолированная
- •С увеличением числа молекул вероятность отклонения от равномерного распределения быстро уменьшается и становится
- •Мерой вероятности существования системы в том или другом состоянии является э н т
- •С увеличением термодинамической вероятности увеличивается и энтропия. То есть тенденция к равномерному распределению
- •Для вычисления изменения энтропии в химических реакциях применимо использование следствия из закона Гесса,
- •Дело в том, что в результате реакции изменяется не только система, но и
- •Условие возможности протекания самопроизвольного процесса в некоторой системе (где изменения энтропии и энтальпии
- •Термодинамическое равновесие
- •Реакция не идет ни в одном из направлений, если
- •Задача
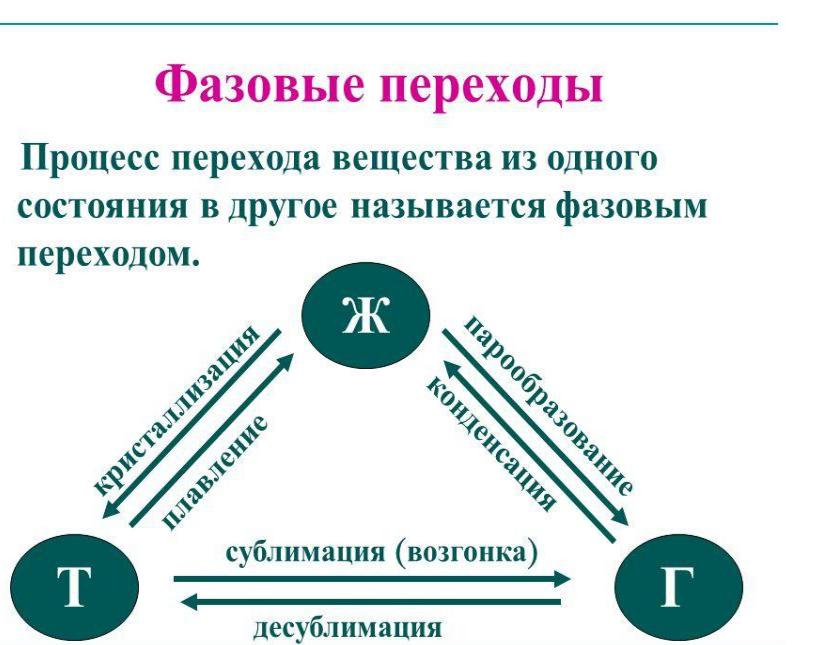
Все фазовые переходы сопровождаются тепловыми эффектами.
Тепловые эффекты биологических процессов Расход энергии6
Стирка – 10 кДж/мин Ходьба – 16 кДж/мин Бег – 40 кДж/мин
В сутки Мужчины – 9200-12000 кДж
Женщины – 6700-8800 кДж
Калорийность продуктов, кДж/г Масло – 30,41 Сыр – 16,82 Сахар – 16,80 Капуста – 1,25 Кабачки – 0,92
Пиво – 1,29 х 500 = 650 кДж
Второе начало термодинамики
Самопроизвольные процессы
Не требуют затрат энергии извне (охлаждение, течение реки по склону, взрывы)
Несамопроизвольные процессы
требуют затрат энергии (подъем тела, нагрев, разложение) Первый закон термодинамики не описывает возможность и направление
протекания процесса.
Второй закон
•Определяет, какие процессы в данной системе и в данных условиях могут протекать самопроизвольно
• Устанавливает предел возможного самопроизвольного протекания процесса
• Дает возможность определить, какими должны быть внешние условия, чтобы интересующий нас процесс шел в нужном направлении и в нужной степени.
Самопроизвольными являются такие процессы, которые сопровождаются диссипацией (рассеиванием) энергии без изменения ее общего количества в мире.
Что такое рассеивание в физическом смысле? Это максимально равномерное распределение энергии и вещества, при котором выравниваются интенсивные (не зависящие от числа молей вещества в системе) параметры системы (температура, давление, электрический потенциал, плотность, концентрация.
Система с интенсивными параметрами, одинаковыми во всех частях системы, является равновесной, в ней происходят только обратимые процессы, ее свойства не меняются во времени. Такое состояние системы является наиболее вероятным.

•Система изолированная
•4 молекулы абсолютно одинаковы про физическим свойствам
•Молекулы свободно двигаются по всему объему и способны находиться в обеих половинках ящика, попадая в ту или другую половину случайным образом
•Возможные варианты распределения молекул по двум половинкам сосуда назовем состояниями системы.
•W – число способов, которым может быть реализовано данное состояние системы или же
термодинамическая вероятность системы
•Таким образом, существует W1+W2 +W3 +W4 +W5 =16 способов размещения четырех
молекул по двум половинкам сосуда. Какое же из них наиболее вероятно?
•В большем числе случаев возникает равномерное распределение.
•В результате случайных движений происходит направленный самопроизвольный процесс.
С увеличением числа молекул вероятность отклонения от равномерного распределения быстро уменьшается и становится ничтожно малой для
макроскопических систем. Например, в объеме газа 0,2 мкм3 отклонение от средней плотности на 1% происходит каждые 10-9 с. Вероятность того, что плотность в объеме газа 1мм3 будет отличаться от средней на 0,01 %, равна 10-60.
Для реальных веществ величина W = 10n, где n=10 1023 , т. е. W=10240.
Число частиц во Вселенной 10100
Мерой вероятности существования системы в том или другом состоянии является э н т р о п и я (S), связанная с
термодинамической вероятностью (W) уравнением Больцмана.
S = klnW ,
где k – это константа Больцмана, одна из фундаментальных мировых констант;
k = 1,38 10-23 Дж/К.
Обратите внимание на порядок численного значения. Сравним с числом Авогадро NA = 6,02 1023. Фундаментальные константы
показывают нам, что все в мире взаимосвязано.

С увеличением термодинамической вероятности увеличивается и энтропия. То есть тенденция к равномерному распределению частиц, наблюдаемая в самопроизвольных процессах, связана с увеличением энтропии (ΔS>0).
Чем меньшим числом способов описывается система, тем выше в ней порядок. Следовательно, увеличение энтропии является мерой увеличения беспорядка в системе.
при повышении температуры энтропия возрастает. Повышение температуры определяется сообщением системе некоторого количества теплоты. В этом случае изменение энтропии описывается формулой
ΔS =.
Если система поглощает теплоту, то ее энтропия увеличивается (ΔS >0). Если система теряет теплоту, то ее энтропия уменьшается (ΔS <0).
Для вычисления изменения энтропии в химических реакциях применимо использование следствия из закона Гесса, поскольку энтропия (как и энтальпия, внутренняя энергия), является функцией состояния системы. Поэтому изменение энтропии в химической реакции описывается как разность энтропий продуктов и реагентов:
S |
= ΣS0 |
̶ SΣ0 |
|
|
|
|
|
р-и |
прод |
исх. |
Соединение |
H2 |
O2 |
H2O(ж) |
|
Например |
|
||||||
|
S0298, Дж/моль · К |
130,6 |
205,1 |
69, 9 |
|||
2Н2+О2= 2Н2О, Нсреды = +571,7 кДж; (ΔНсистемы = -571,7 кДж) |
|||||||
|
|
|
|
||||
Sр-и = 2·69,9 – (2·130,6 + 205,1) = -326,5 Дж/К. |
|
|
|
|
|||
В этом процессе изменение энтропии намного меньше нуля, следовательно, он невозможен как самопроизвольный. Тем не менее, известно, что реакция соединения водорода и кислорода идет со взрывом (взрыв гремучего газа)
Дело в том, что в результате реакции изменяется не только система, но и окружающая среда, в которую выделилась теплота реакции, при этом энтропия среды тоже изменяется. Таким образом, информации об энтропиях участвующих в реакции веществ, недостаточно для решения вопроса о ее протекании. Нужно учитывать не только изменение энтропии системы (ΔSсист), но и изменение энтропии среды (ΔSср). Критерий
возможности самопроизвольного процесса – суммарное увеличение системы и окружающей среды, которое называют изменением энтропии мира (ΔSм).
Sм = Sсист + Sср.
В данном случае Sсист = -326,5 Дж/К. В окружающей среде рассеялась теплота +571,7 Кдж и при
комнатной температуре изменение энтропии среды
Sср = Нср/Т= 571700/298 = 1918,5 Дж/К.
Тогда
Sм = Sсист + Sср = -326,5 + 1918,5 = 1592,0 Дж/К>>0.
Именно поэтому данный процесс осуществляется как самопроизвольный. Для проведения его в противоположном направлении (разложение воды) при комнатной температуре необходимо затратить работу, например, электрического тока.
Таким образом
Sм = Sсист + Sср =ΔSсист + Нср/Т = Sсист − Нсист/Т.
Условие возможности протекания самопроизвольного процесса в некоторой системе (где изменения энтропии и энтальпии относятся только к самой системе)
S − Н/Т>0 или Н −T S< 0.
Это выражение обозначается как |
G: |
G = |
Н −T S. |
Знак этой функции определяет направление процесса. G – это еще одна |
|
функция состояния системы, называемая энергией Гиббса или изобарно- изотермическим потенциалом, а также свободной энергией системы. В системе возможет только тот процесс, в результате которого свободная энергия системы уменьшается ̶ G<0.
G = Н −T S – это основное уравнение химической термодинамики, так как связывает возможность протекания химической реакции с изменениями H
и S. Знак изменения свободной энергии зависит от знаков и относительных величин изменения энтальпии и энтропии, а также от температуры.
