- •Основы химической термодинамики
- •Состояние системы - совокупность ее химических и физических свойств, которые подразделяются на термодинамические
- •Энергия системы -
- •Термодинамические функции
- •2. Функции процесса
- •Теплота и работа
- •Работа процесса –
- •Теплота и работа характеризуют качественно и количественно две различные формы передачи движения от
- •Классификация термодинамических процессов
- •2. В зависимости от способа проведения процесса
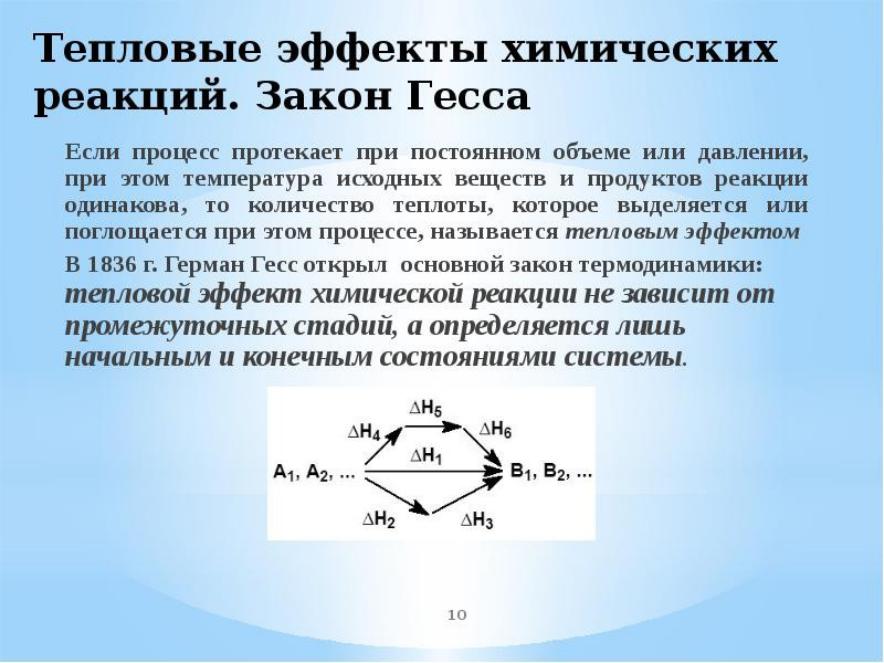
- •Термохимия
- •Химические реакции, в которых указан тепловой эффект, называются
- •Все фазовые переходы сопровождаются тепловыми эффектами.
- •Второе начало термодинамики
- •Самопроизвольными являются такие процессы, которые сопровождаются диссипацией (рассеиванием) энергии без изменения ее общего
- ••Система изолированная
- •С увеличением числа молекул вероятность отклонения от равномерного распределения быстро уменьшается и становится
- •Мерой вероятности существования системы в том или другом состоянии является э н т
- •С увеличением термодинамической вероятности увеличивается и энтропия. То есть тенденция к равномерному распределению
- •Для вычисления изменения энтропии в химических реакциях применимо использование следствия из закона Гесса,
- •Дело в том, что в результате реакции изменяется не только система, но и
- •Условие возможности протекания самопроизвольного процесса в некоторой системе (где изменения энтропии и энтальпии
- •Термодинамическое равновесие
- •Реакция не идет ни в одном из направлений, если
- •Задача
Теплота и работа характеризуют качественно и количественно две различные формы передачи движения от данной части материального мира к другой. Теплота и работа не могут содержаться в теле. Теплота и работа возникают только тогда, когда возникает процесс, и характеризуют только процесс. В статических условиях теплота и работа
не существуют.


Q = ΔU + P ΔV
Классификация термодинамических процессов
Q = ΔU + P
1. В зависимостиΔVот условий, в которых протекает процесс,
он может быть:
Изохорным – протекает при постоянном объеме системы (V = const).
Изобарным – протекает при постоянном давлении в системе (Р = const).
Изотермическим– протекает при постоянной температуре (Т = const).
Изохорно-изотермическим – (V = const и Т = const). Изобарно-изотермическим – (Р = const и Т = const). Адиабатным – система не отдает теплоту в окружающую среду и не получает теплоты из окружающей среды (Q = 0).
2. В зависимости от способа проведения процесса
1.Термодинамически обратимый процесс – после проведения процесса окружающая среда и система могут вернуться в первоначальное состояние. В результате такого процесса в окружающей среде и в системе не происходит никаких изменений, отсутствуют всякие энергетические потери, и система совершает максимально возможную работу.
Обратимый процесс допускает возможность возвращения системы в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Все реальные процессы необратимы.
Термохимия
При химических реакциях А – это работа против внешнего давления, т. е. в первом приближении А= P V, где V – изменение объема системы (V2 – V1). Так как большинство химических реакций проводят при постоянном давлении, то для изобарно-изотермического процесса (р=соnst, Т=const) теплота Q будет равна
Qp = U + Р V;
Qp = (U2 – U1) + p(V2 – V1); Qp = (U2 + pV2) – (U1+ pV1).
Сумму U + pV обозначим через Н, тогда
Qp = H2 – H1 = H. - энтальпия (теплосодержание)
Энтальпия – функция состояния системы, то есть, ее изменение не зависит от пути процесса.


Химические реакции, в которых указан тепловой эффект, называются
термохимическими уравнениями. Приборы для измерения тепловых эффектов называются
калориметрами