
- •Основы химической термодинамики
- •Состояние системы - совокупность ее химических и физических свойств, которые подразделяются на термодинамические
- •Энергия системы -
- •Термодинамические функции
- •2. Функции процесса
- •Теплота и работа
- •Работа процесса –
- •Теплота и работа характеризуют качественно и количественно две различные формы передачи движения от
- •Классификация термодинамических процессов
- •2. В зависимости от способа проведения процесса
- •Термохимия
- •Химические реакции, в которых указан тепловой эффект, называются
- •Все фазовые переходы сопровождаются тепловыми эффектами.
- •Второе начало термодинамики
- •Самопроизвольными являются такие процессы, которые сопровождаются диссипацией (рассеиванием) энергии без изменения ее общего
- ••Система изолированная
- •С увеличением числа молекул вероятность отклонения от равномерного распределения быстро уменьшается и становится
- •Мерой вероятности существования системы в том или другом состоянии является э н т
- •С увеличением термодинамической вероятности увеличивается и энтропия. То есть тенденция к равномерному распределению
- •Для вычисления изменения энтропии в химических реакциях применимо использование следствия из закона Гесса,
- •Дело в том, что в результате реакции изменяется не только система, но и
- •Условие возможности протекания самопроизвольного процесса в некоторой системе (где изменения энтропии и энтальпии
- •Термодинамическое равновесие
- •Реакция не идет ни в одном из направлений, если
- •Задача
Основы химической термодинамики
Система – тело или группа тел, мысленно выделенных из окружающей среды. Окружающая среда – все, что находится за пределами системы.
Фаза – часть системы, ограниченная поверхностью раздела.
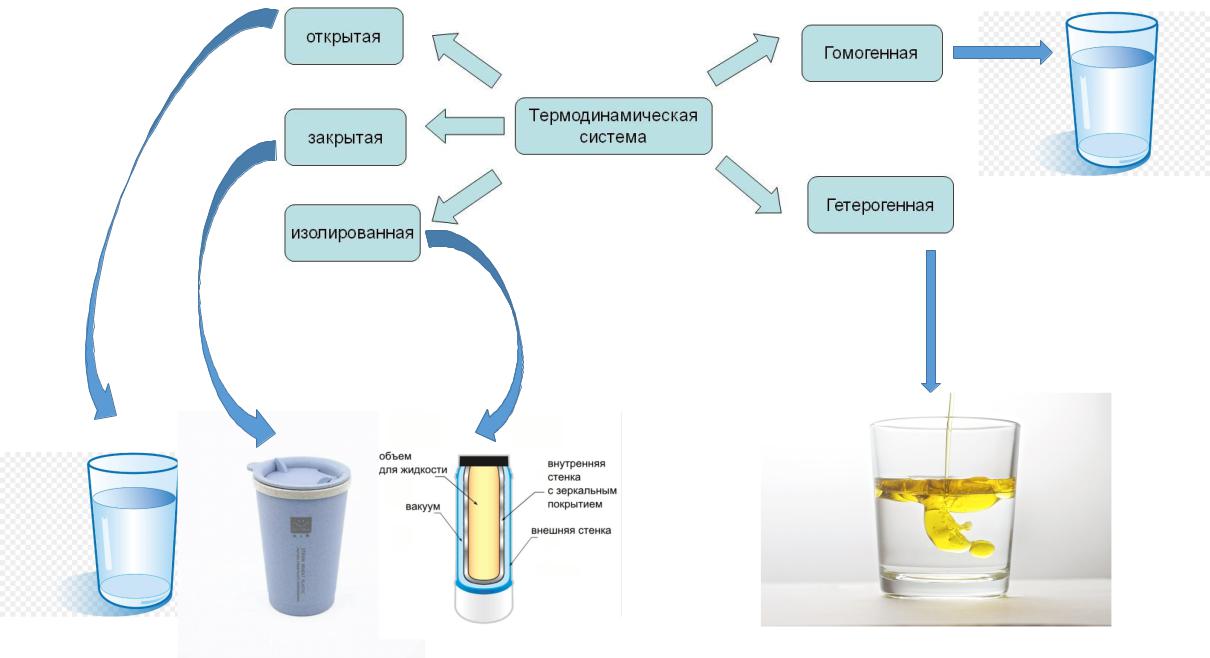
Классификация систем:
1. По отношению к окружающей среде.
Открытая система – обменивается с окружающей средой массой и энергией. Закрытая система – обменивается с окружающей средой только энергией.
Изолированная система – не обменивается ни массой, ни энергией.
2. По количеству фаз в системе.
Гомогенная система состоит из одной фазы. Гетерогенная система состоит из двух и более фаз.
Состояние системы - совокупность ее химических и физических свойств, которые подразделяются на термодинамические параметры состояния и
термодинамические функции.
Термодинамические параметры состояния – величины, которые могут быть непосредственно измерены (давление Р, температура Т, концентрация С, объем V).
Математическое выражение, связывающее параметры состояния, называется
уравнением состояния:
PV = νRT,
где ν – количество вещества.
Уравнение Менделееева-Клапейрона
Энергия системы -
мера способности системы совершать работу, качественная мера движения и взаимодействия материи.
Энергия является неотъемлемым свойством материи.
Полная энергия системы -
Потенциальная энергия, обусловленная положением тела в поле некоторых сил (Eп), кинетическая энергия, обусловленная изменением положения тела в пространстве (Eк) и внутренняя энергия (U). Единица измерения – Джоуль (Дж).
Термодинамические функции
–величины, которые не могут быть непосредственно измерены
изависят от параметров состояния.
Подразделяются
1. На функции состояния (U – внутренняя энергия; Н – энтальпия; S – энтропия, G – энергия Гиббса, А – изохорно- изотермический потенциал).
Измерение функций состояния не зависят от пути и способа проведения процесса, а зависят только от начального и конечного состояния системы.
Изменение функции, например, U = U2 − U1, не зависит от того, как осуществляется процесс.

2. Функции процесса
(Q – теплота; А – работа). Изменение функций процесса зависит от того, в каких условиях и каким путем протекал процесс.
Теплота и работа
– две разные формы передачи энергии от одной системы к другой или от системы к окружающей среде.
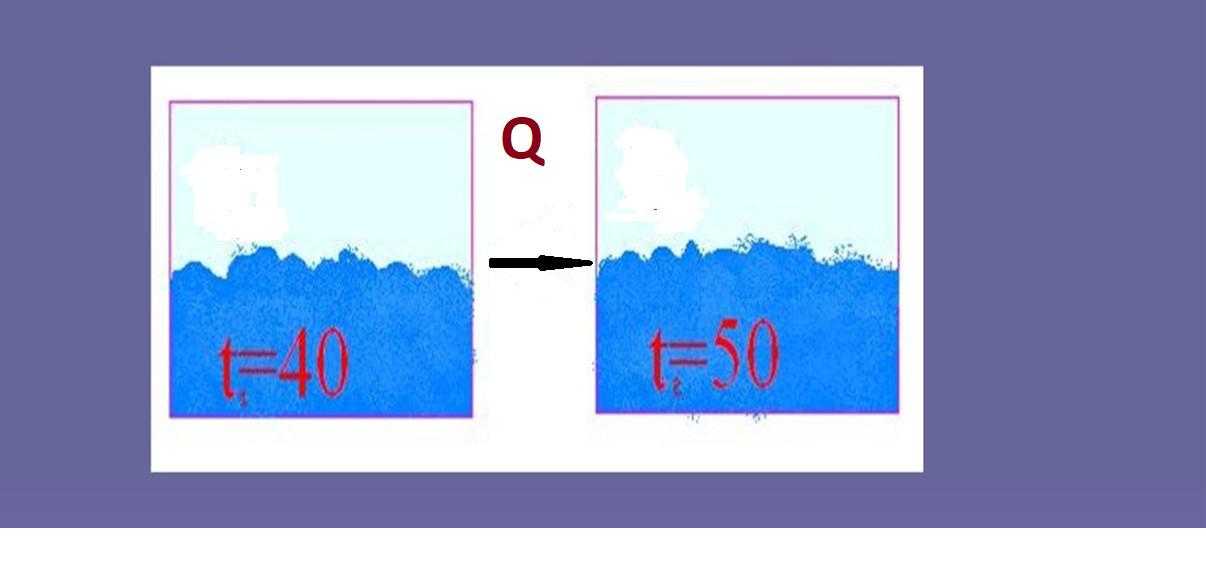
Теплота — форма передачи энергии путём неупорядоченного движения молекул. Передача энергии, вызываемая градиентом температуры, называется передачей теплоты. Теплота не является параметром состояния системы. Например, вода в стакане может иметь температуру 40 оС, но нельзя сказать, что вода содержит теплоту. Если нагреть воду до 70 оС, то ей нужно передать некоторую энергию в форме теплоты. Наоборот, при охлаждении воды до комнатной температуры часть энергии передается окружающей среде в виде теплоты.
Итак, понятие «теплота» относится не к состоянию системы, а к какому-то процессу ее передачи, т. е. теплота является функцией процесса. Единица измерения теплоты
– Джоуль (Дж). Если теплота поглощается системой, то величина ее количество в окружающей среде уменьшается, Q<0. Если теплота выделяется в окружающую среду, то величина Q>0.
Работа процесса –
это энергия, передаваемая одним телом другому при их взаимодействии и не зависящая от температуры. Система выполняет работу только если она преодолевает внешнее сопротивление. В этом случае работа положительна (А>0). Если работа выполняется над системой, то А <0. Пример – процесс
расширения и сжатия газа. То есть, работа также является функцией процесса.
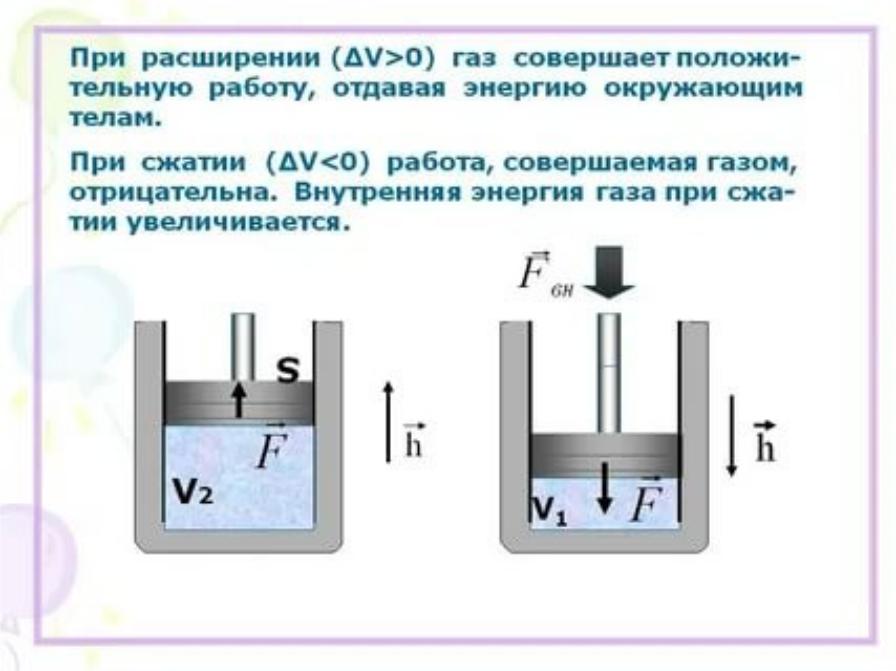
S – площадь поршня, Δh = h2
– h1
A = FΔh, F = PS A = PS Δh = p ΔV
