
- •Классификация и номенклатура неорганических веществ
- •Наука, включающая в себя химию и физику, изучает природу и свойства материи и
- •Вещества, изучаемые химией —
- •Вещества
- •Простые вещества
- •Сложные вещества
- •Оксиды
- •Оксиды (ЭхОy-2)
- •По какому признаку солеобразующие оксиды делят на три вида?
- •Кислотные оксиды
- •Основные оксиды-
- •Амфотерные оксиды
- •Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металлов.
- •Классификация кислот
- •Кислоты (НхАс)
- •Соответствие кислот и оксидов
- •Классификация оснований (Ме(ОН)x)
- •Соответствие оснований и оксидов
- •Амфотерные гидроксиды
- •Соли
- •Классификация солей
- •Номенклатура неорганических соединений
- •Основания
- •Номенклатура кислот
- •Оксокислоты. Названия некоторых оксокислот и
- •Номенклатура амфотерных гидроксидов
- •Каждому амфотерному гидроксиду можно дать название, как основанию, так и кислоте
- •Соли. Номенклатура.
- •Кислые соли
- •Основные соли
- •Двухкислотное основание образует одну нормальную и одну основную соль с кислотным остатком.
- •Номенклатура
- •Модель решения 1.Средние соли –
Классификация солей
Нормальные (средние)
NaCl, Na2SO4, Na3PO4
Кислые
NaHSO4, Na2HPO4, NaH2PO4Основные
MgOHCl, Al(OH)2NO3Двойные (смешанные)
KAl(SO4)2, Fe(NH4)2(SO4)2Комплексные
Na2[Zn(OH)4], K3[Fe(CN)6]
Номенклатура неорганических соединений
Оксиды
Название оксида
«Оксид» + название элемента в родительном падеже + валентность
элемента (римскими цифрами) Примеры: СО – оксид углерода (II)
СО2 – оксид углерода (IV) Fe2O3 – оксид железа (III) SO3 – оксид серы (VI)
Если элемент имеет постоянную валентность, ее в названии оксида не указывают Примеры: Na2O – оксид натрия
Al2O3 – оксид алюминия
Основания
Название основания
Гидроксид + название металла в родительном падеже+ валентность металла (римскими цифрами)
Примеры:
Fe(OH)2 – гидроксид железа (II) Fe(OH)3 – гидроксид железа (III)
Если валентность металла постоянная, то ее не указывают
Примеры:
Ca(OH)2 – гидроксид кальция NaOH – гидроксид натрия

Номенклатура кислот


Оксокислоты. Названия некоторых оксокислот и
кислотных остатков
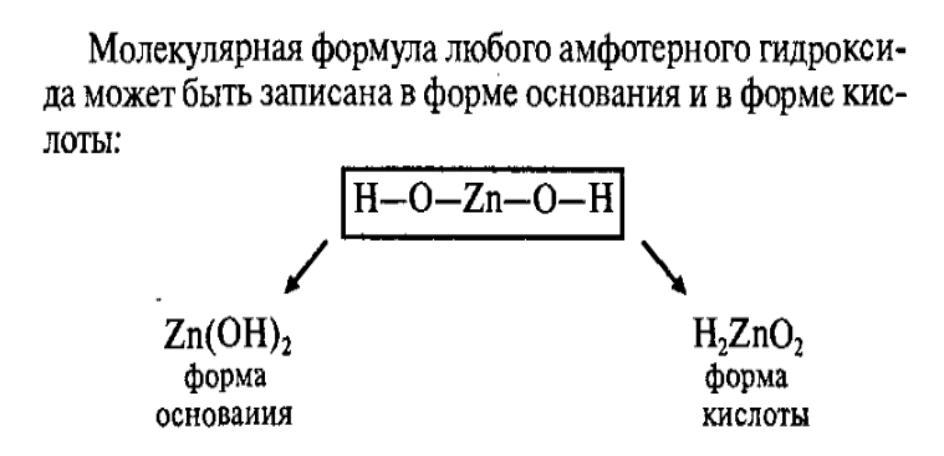
Номенклатура амфотерных гидроксидов
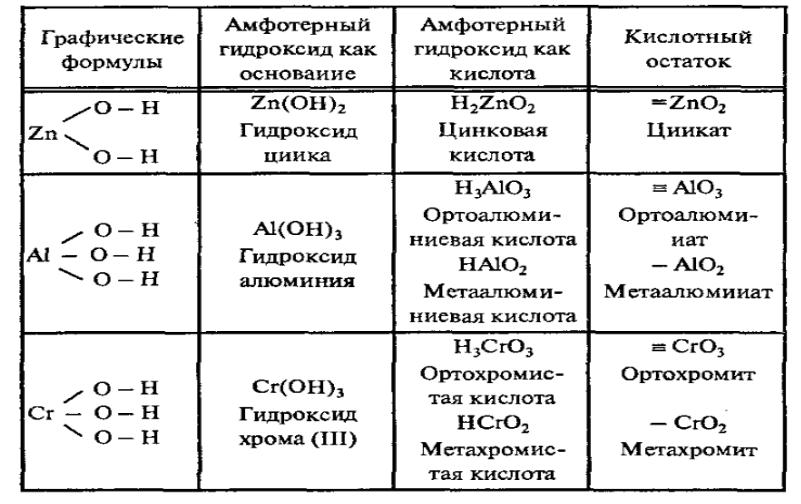
Каждому амфотерному гидроксиду можно дать название, как основанию, так и кислоте

Соли. Номенклатура.
Нормальные (средние) соли – это продукты
полного замещения атомов водорода в молекуле кислоты или гидроксидных групп в молекуле основания кислотными остатками..
В молекуле нормальной соли сумма валентностей металлов равна сумме валентностей кислотных остатков.

Кислые соли
– это продукты неполного замещения атомов водорода в молекулах
многоосновных кислот атомами металла.

