
- •Классификация и номенклатура неорганических веществ
- •Наука, включающая в себя химию и физику, изучает природу и свойства материи и
- •Вещества, изучаемые химией —
- •Вещества
- •Простые вещества
- •Сложные вещества
- •Оксиды
- •Оксиды (ЭхОy-2)
- •По какому признаку солеобразующие оксиды делят на три вида?
- •Кислотные оксиды
- •Основные оксиды-
- •Амфотерные оксиды
- •Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металлов.
- •Классификация кислот
- •Кислоты (НхАс)
- •Соответствие кислот и оксидов
- •Классификация оснований (Ме(ОН)x)
- •Соответствие оснований и оксидов
- •Амфотерные гидроксиды
- •Соли
- •Классификация солей
- •Номенклатура неорганических соединений
- •Основания
- •Номенклатура кислот
- •Оксокислоты. Названия некоторых оксокислот и
- •Номенклатура амфотерных гидроксидов
- •Каждому амфотерному гидроксиду можно дать название, как основанию, так и кислоте
- •Соли. Номенклатура.
- •Кислые соли
- •Основные соли
- •Двухкислотное основание образует одну нормальную и одну основную соль с кислотным остатком.
- •Номенклатура
- •Модель решения 1.Средние соли –
Классификация и номенклатура неорганических веществ
Литература:
1.О.С. Габриелян. Химия. Учебник для общеобразовательных учебных заведений., Москва, 2002 г.
2.Химия. Пособие-репетитор для поступающих в Вузы. Под редакцией А.С. Егорова. Ростов-на-Дону, изд. «Феникс»,
2003 г.
Наука, включающая в себя химию и физику, изучает природу и свойства материи и энергии в неживых системах.
• три фундаментальных вида материи:
• Вещество, обладающее определённой массой в состоянии покоя, представляет собой наиболее распространённый вид. Оно может состоять из частиц, молекул, атомов, а также их соединений, которые образуют физическое тело.
•Химия изучает вещество
•Физическое поле - это особая материальная субстанция, которая призвана обеспечивать взаимодействие объектов (веществ)
•Физическое поле – предмет изучения физики.
•Физический вакуум - является материальной средой с наименьшим уровнем энергии.
Вещества, изучаемые химией —
вещества, состоящие из атомов. Вещества, в которых выделение атомов невозможно или теряет физический смысл (например, плазма или звёздное вещество), к предмету рассмотрения химией не относят.
Состоящее из атомов вещество- основной объект изучения химии.

Вещества
Простые- |
Сложные- |
состоят из атомов |
состоят из атомов |
одного химического |
разных элементов |
элемента. |
|

Простые вещества
Металлы
Na,
Fe,
Al,
Zn…
|
|
Благородные |
|
|
|
|
газы |
Неметаллы |
|||
O2, |
He, |
||
H2, |
Ne, |
||
Cl2, |
Ar, |
||
S, |
Kr, |
||
P, |
Xe, |
||
C… |
Rn |
||
Сложные вещества
Бинарные соединения – это соединения, в состав которых входят два химических
элемента
Примеры
Гидриды – соединения водорода с металлами - ЭHх
Карбиды- соединения углерода с металлами Нитриды – соединения азота с металлами и неметаллами
например, нитрид бора, ВN или нитрид алюминия AlN Сульфиды – соединения серы с металлами и водородом Оксиды – соединения кислорода с металлами и неметаллами
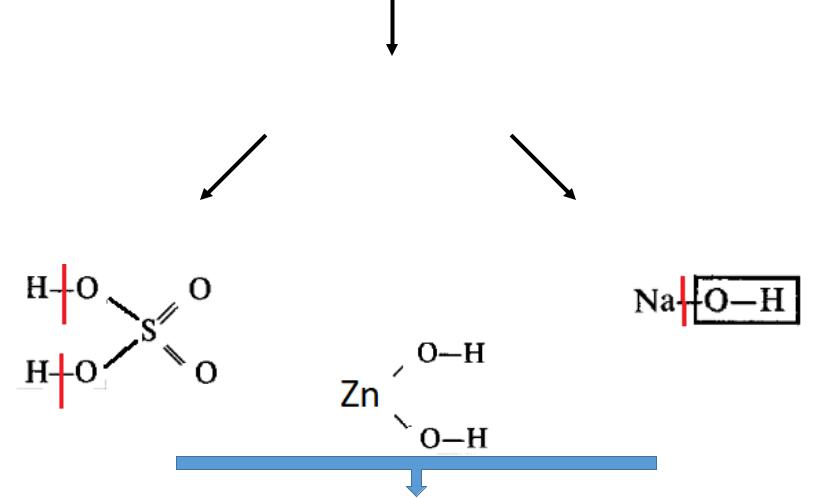
Оксиды
Гидроксиды
Кислоты  Основания Амфотерные
Основания Амфотерные
Соли
Оксиды (ЭхОy-2)
|
|
Солеобразующ |
||||||||
Несолеобразующ |
|
|
|
|
ие |
|
|
|
||
|
|
|
|
|
|
|||||
ие |
Кислотные |
|
|
Основные |
||||||
(СO, NO, N2O SiO) |
|
|
||||||||
|
|
|||||||||
Эти оксиды не образуют солей при |
|
Амфотерные |
|
|
||||||
взаимодействии с кислотами и |
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
||
основаниями |
Na2O |
+ |
HCl |
= |
NaCl |
+ H2O |
|
|||
Основной оксид |
кислота |
|
соль |
|
вода |
|||||
|
SO3 + |
NaOH = |
Na2SO4 + |
H2O |
|
|||||
Кислотный оксид |
основание |
|
соль |
вода |
|
|||||
ZnO |
+ |
|
NaOH |
= |
|
|
Na2ZnO2 |
+ |
2H2O |
|
амфотерный оксид |
основание |
|
|
соль |
|
вода |
||||
ZnO |
|
+HCl = |
|
|
|
ZnCl2 |
+ |
2 H2O |
||
амфотерный оксид |
кислота |
|
|
|
соль |
|
вода |
|||
По какому признаку солеобразующие оксиды делят на три вида?
• Основной оксид |
|
|
|
• Гидрат оксида – основание → |
соль |
||
• |
N a 2 O |
N a O H |
N a C l |
|
|||
• Амфотерный оксид—амфотерный гидроксид--- соль
ZnO Zn OH 2 H 2 ZnO2 Na2 ZnO2
ZnO Zn(OH )2 ZnCl2
• Кислотный оксид--- кислота--- соль
S 6 O 3 |
H 2 S 6 O 4 |
C a S 6 O 4 |
Кислотные оксиды
Оксиды неметаллов:
SO2
SO3
CO2
P2O5
SiO2
N2O3
N2O5
Оксиды металлов со степенью окисления +6, +7
СrO3 Mn2O7
