- •Тема 13. Физика атома. Водородоподобные атомы.
- •Опыт Франка и Герца.
- •Опыт Штерна и Герлаха
- •Пространственное распределение электрона в атоме водорода.
- •Спин электрона
- •Многоэлектронный атом. Правила распределения электронов по орбиталям. Принцип Паули
- •Связь распределения электронов по орбиталям с периодической таблицей Менделеева
- •Спонтанное и вынужденное излучение фотонов. Принцип работы квантового генератора и его использование.
Лекция 8.
Тема 13. Физика атома. Водородоподобные атомы.
Резерфорд в 1911 году исследовал рассеяние альфа-частиц при прохождении их через тонкие слои металлической фольги. Альфа-частицы образуются при естественном радиоактивном распаде некоторых тяжелых элементов и представляют собой ядра атомов гелия и имеют положительный электрический заряд, так как состоят из двух протонов и двух нейтронов. Резерфорд, пропуская альфа-частицы с большой кинетической энергией через металлические пластинки, установил, что большая часть частиц отклоняются от первоначального направления на небольшие углы.
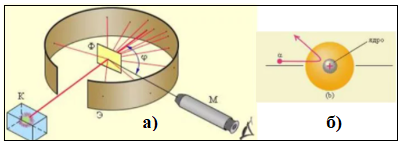
Рис.13.1.
Наряду
с рассеиванием на малые углы, было
обнаружено отклонение отдельных частиц
и на большие углы, доходящие до 1500.
Схема экспериментальной установки
представлена на рис. 13.1.а). Здесь К -
свинцовый контейнер с радиоактивным
веществом, Э – экран, покрытый сернистым
цинком, при столкновении
 - частиц с которым возникают вспышки, М
- микроскоп для наблюдения вспышек, Ф
- золотая фольга, φ – угол отклонения
направления движения
–частиц от первоначального направления.
На рис 13.1 б) показано отклонение частиц
на углы порядка 1500
.
- частиц с которым возникают вспышки, М
- микроскоп для наблюдения вспышек, Ф
- золотая фольга, φ – угол отклонения
направления движения
–частиц от первоначального направления.
На рис 13.1 б) показано отклонение частиц
на углы порядка 1500
.
Такое рассеяние было обнаружено и при прохождении альфа-частиц через одноатомные газы.
Установлено, что отклонения происходят вследствие кулоновского отталкивания от положительного заряда, сосредоточенного в очень малом объеме внутри атома. Для объяснения результатов рассеяния Резерфорд в 1911г. предложил планетарную модель атома. Схема модели представлена на рис.13.2. Согласно этой модели атом построен по типу Солнечной системы - в центре атома в очень малой области (10-13 м) находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома, а вокруг ядра под действием сил кулоновского притяжения двигаются по замкнутым орбитам электроны (примерный радиус орбит -10-10м). При этом суммарный заряд электронов равен по величине заряду ядра, поэтому в целом атом нейтрален.

Рис.13.2.
Согласно классической электродинамике электрон, двигающийся по орбите вокруг ядра с ускорением, должен испускать электромагнитные волны непрерывного спектра частот. При этом он теряет свою энергию и через малый интервал порядка времени жизни атома в возбужденном состоянии 10-8 с должен упасть на ядро, чего не происходит в реальности.
Ясно, что планетарная модель строения атома должна была интерпретировать получаемые экспериментальные данные. Но в конце 19 века Бальмером было обнаружено, что спектр излучения атомарного водорода в видимой области состоит из отдельных линий, расположенных в определенном порядке, то есть является линейчатым, а не непрерывным. В дальнейшем было установлено, что спектр водорода в оптической области состоит из нескольких серий частот излучения, наиболее известные из которых описываются соотношениями:
серия
Лаймана для ультрафиолетового излучения:
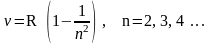 серия
Бальмера для видимого излучения:
серия
Бальмера для видимого излучения:
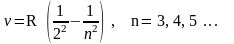
Обобщенная формула Бальмера – Ритца, которая описывает все линии, записывается так:
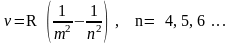 здесь
R-постоянная Ридберга, m
– номер серии 1, 2, 3, …., n
– номер линии в серии, причем n=
(m+1),
(m+2),
(m+3),…..,
и т.д. Отметим, что если m=3
– серия Пашена в инфракрасной области,
если m=4
– серия Брекета, если m=5
– Пфунда.
здесь
R-постоянная Ридберга, m
– номер серии 1, 2, 3, …., n
– номер линии в серии, причем n=
(m+1),
(m+2),
(m+3),…..,
и т.д. Отметим, что если m=3
– серия Пашена в инфракрасной области,
если m=4
– серия Брекета, если m=5
– Пфунда.
Для
каждой серии значение частоты √кр
=
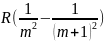 - называется красной границей серии
(минимальная частота серии).
- называется красной границей серии
(минимальная частота серии).
Изучение спектра поглощения для атомарного водорода показало, что он тоже имеет дискретный характер, описываемый соотношениями, записанными выше. Подобная дискретность спектров была обнаружена у всех одноатомных газов. Таким образом, планетарная модель атома требовала серьезных доработок.
Для объяснения спектров излучения и поглощения атомарного водорода в 1913г. Нильс Бор представил три постулата, которые не соответствовали законам классической механики.
1. Атом может находиться в стационарных состояниях, в этих состояниях электрон движется по определенным стационарным орбитам без излучения и без потери энергии. Эти орбиты называют боровскими орбитами.
2. При движении по боровским орбитам электроны имеет строго определенные (дискретные) значения
момента
импульса L:
Ln
= mvr
= n , n
= 1, 2, 3,……,
, n
= 1, 2, 3,……,
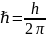 , h
= 6,62·10-34
Дж·с
, h
= 6,62·10-34
Дж·с
Квантовое число n является номером состояния атома и номером боровской орбиты электрона. В этих состояниях радиусы орбит электрона и его скорости различны, атом также имеет различные значения энергии. Обычно атом водорода находится в основном или невозбужденном состоянии n=1 с наименьшим значением энергии, состояния с n = 2, 3, 4 имеют большие энергии и называются возбужденными.
3.
При передаче атому энергии он переходит
в какое-либо возбужденное состояние с
n = 2, 3, 4, . При всех переходах, в соответствии
с законом сохранения, энергия кванта
излучения или поглощения e
электромагнитной волны точно равна
разности энергий начального и конечного
состояний атома: e
= hν
= En
–Em,
, при этом величины ( ,
,
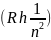 назвали энергетическими термами.
назвали энергетическими термами.
Теория Бора не отвергает полностью законы классической физики при описании поведения атомных систем. В ней сохранены представления об орбитальном движении электронов в кулоновском поле ядра. Поэтому теорию Бора иногда называют полуклассической.
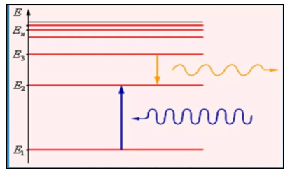
Рис. 13.3 |
На рис.13.3 представлена схема поглощения и испускания квантов энергии. Создание Бором теории, позволило ему рассчитать на основании 2 постулата, а также закона Кулона, и формул кинетической и |
потенциальной энергий электрона, взаимодействующего с ядром, значения энергии электрона с заданным значением квантового числа n. Схема энергетических уровней, а также переходы между уровнями, соответствующие сериям спектра водорода, представлены на рис. 13.4.

Рис. 13.. 4