
- •Сущность титриметрических методов анализа
- •Рабочие растворы в титриметрии (исходные приготовленные).
- •Мерная посуда в титриметрии, подготовка посуды к анализу.
- •Титр раствора. Нормальность, молярность, процентная концентрация.
- •Опишите процесс титрования. С какой целью проводят титрование.
- •Точка эквивалентности. Эквивалент. Эквивалентная масса.
- •Классификация титриметрических методов анализа по способу титрования (прямое, обратное, титрование заместителя).
- •Сущность кислотно-основного титрования (основная реакция, которая лежит в основе метода; рабочие растворы; способы фиксирования точки эквивалентности).
- •Требования к кислотно-основным индикаторам.
- •Интервал перехода индикаторов.
- •Индикаторная ошибка титрования.
- •Применение индикаторов для фиксирования точки эквивалентности (т.Э)
- •Сущность и классификация методов осаждения.
- •Аргентометрия: сущность, способы фиксирования точки эквивалентности.
- •Способы фиксирования точки эквивалентности в методах осаждения:
- •Способ просветления (метод Гей-Люссака);
- •Способ равного помутнения;
- •Рабочие растворы в комплексонометрии
- •Металлоиндикаторы (мурексид, эриохром черный-т)
- •Сущность и классификация методов редоксиметрии
- •Перманганатометрия: сущность, рабочие растворы, способы фиксирования точки эквивалентности.
- •В какой среде наиболее целесообразно проводить перманганатометрические определения, ответ обоснуйте с помощью редокси-потенциала.
- •Опишите определение окислителей, восстановителей и веществ, которые не обладают ярко выраженными ни окислительными, ни восстановительными свойствами.
- •Иодометрия: сущность
Титр раствора. Нормальность, молярность, процентная концентрация.
Титр - число граммов или миллиграммов растворенного вещества, которое содержится в 1 см3 раствора и обозначается как Т.
Нормальность раствора обозначает число грамм-эквивалентов данного вещества в 1 литре раствора или число миллиграмм-эквивалентов в 1 мл раствора.
Молярная концентрация - количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л.
Процентная концентрация - число единиц массы растворенного вещества, содержащихся в 100 единицах раствора.
Грамм - эквивалентом вещества называется количество граммов вещества, численно равное его эквиваленту. Для сложных веществ - это количество вещества, соответствующее прямо или косвенно при химических превращениях 1 грамму водорода или 8 граммам кислорода.
Опишите процесс титрования. С какой целью проводят титрование.
Титрование - постепенное смешивание веществ до полного окончания реакции. Обычно в титриметрическом анализе используются растворы веществ. В ходе титрования раствор одного вещества постепенно приливается к раствору другого вещества до тех пор, пока вещества полностью не прореагируют.
Это аналитический метод, предназначенный для количественного определения отдельного вещества (анализируемого компонента), растворенного в образце.
Точка эквивалентности. Эквивалент. Эквивалентная масса.
Точка эквивалентности (т.Э.) – момент окончания титрования, когда взаимодействующие вещества полностью и в эквивалентных количествах прореагируют между собой.
Эквивалентом элемента (молярной массой эквивалента элемента) называется такое количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Эквивалентной массой называется масса 1 эквивалента вещества.
Классификация титриметрических методов анализа по способу титрования (прямое, обратное, титрование заместителя).
Прямое титрование заключается в том, что раствор определяемого вещества А титруют стандартным раствором титранта В. Способом прямого титрования титруют растворы кислот, оснований, карбонатов и т.д.
Обратное титрование применяют в тех случаях, когда прямое титрование не применимо: например, из-за очень низкого содержания определяемого вещества, невозможности определить точку эквивалентности, при медленном протекании реакции и т.д. В ходе обратного титрования к аликвотной части определяемого вещества А приливают точно измеренный объём стандартного раствора вещества В, взятый в избытке. Непрореагировавший избыток вещества В определяют титрованием стандартным раствором вспомогательного вещества С. По разности исходного количества вещества В и его количества, оставшегося после протекания реакции, определяют количество вещества В, вступившее в реакцию с веществом А, исходя из которого и рассчитывают содержание вещества А.
Косвенное титрование или титрование по заместителю. Основано на том, что титруют не само определяемое вещество, а продукт его реакции со вспомогательным веществом С.
А + С D
Вещество D должно образовываться строго количественно по отношению к веществу А. Определив cодержание продукта реакции D титрованием стандартным раствором вещества В, по уравнению реакции рассчитывают содержание определяемого вещества А.
Методы определения титра вещества (пипетирования и отдельных навесок).
Способ пипетирования. Навеску вещества растворяют в мерной колбе, потом отбирают пипеткой часть раствора – этот отобранный объем называют аликвотой. И подвергают эту аликвоту дальнейшему анализу.
Способ отдельных навесок. Берут отдельно близкие по массе навески исследуемого вещества и после их растворения в произвольном объеме воды, каждую из них целиком отдельно титруют.
Стандарт-титры (или фиксаналы).
Фиксанал – раствор или сухое вещество, запаянное в ампулу, с точно известной концентрацией.
Как правило, количество вещества эквивалента в ампуле равно 0,1 моль/л.
Растворение содержимого фиксанала в мерной колбе позволят сразу получать титрованный раствор, это значительно сокращает время на приготовление титрованного раствора.
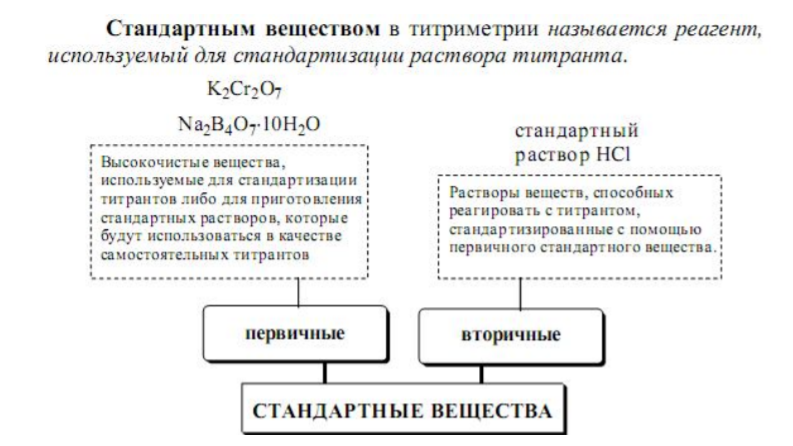
Требования к веществам для приготовления исходных растворов.
К стандартам предъявляются определенные требования.
Они должны иметь:
1. большую молярную массу, так как это снижает ошибку при взвешивании;
2. постоянный состав, отвечающий определенной формуле и не
изменяющейся при хранении, высушивании, взвешивании;
3. они должны легко очищаться кристаллизацией;
4. быть устойчивыми к окислению, не поглощать влагу и СО2 из воздуха.
Классификация титриметрических методов анализа по основной реакции.
Кислотно-основное титрование, в основе которого лежит реакция нейтрализации.
Реакция нейтрализации - реакция взаимодействия кислоты и основания между собой с образованием соли и слабо диссоциирующего вещества (воды).
Окислительно-восстановительное титрование, основанное на окислительно-восстановительных реакциях.
Окислительно-восстановительные реакции (ОВР) – это реакции, при протекании которых происходит изменение степени окисления химических элементов, входящих в состав реагентов. Степень окисления – условный (формальный) заряд атома в химическом соединении, который находят, считая химические связи в соединении чисто ионными.
Комплексонометрическое титрование, основанное на реакциях комплексообразования.
Комплексные соединения или координационные соединения — это соединения, которые образуются в результате присоединения к данному иону, называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами.
Кислотно-основное титрование
