
Большой практикум / Белки и ДНК / 1 Выделение и анализ плазмидной ДНК
.pdfФедеральное государственное автономное образовательное учреждение
высшего образования «СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт фундаментальной биологии и биотехнологии
Базовая кафедра биотехнологии
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
Выделение и анализ плазмидной ДНК из бактериальных клеток
Преподаватель |
|
|
|
С. В. Маркова |
||
|
|
|
подпись, дата |
|
инициалы, фамилия |
|
Студент |
|
|
|
|
|
|
|
номер группы, номер зачетной книжки |
подпись, дата |
|
инициалы, фамилия |
||
Красноярск 2021
Цель работы: знакомство с методами выделения ДНК, получение экспериментальных навыков выделения и анализа плазмидных ДНК.
Задачи: выделение плазмидной ДНК из кишечной палочки E. coli на примере экспрессионной плазмиды pUC18 или pET22b+, содержащего вставку чужеродного гена, оценка качества полученного препарата с помощью электрофореза в геле агарозы, определение концентрации ДНК.
Материалы и оборудование:
1.Термостатируемый шейкер-инкубатор Exella E-24, «New Brunswick» для выращивания клеточных культур;
2.Система документирования гелей «Bio-Rad» с трансиллюминатором;
3.Микроцентрифуга для пробирок «Eppendorf» 5417R с ротором для микропробирок 1,5-2 мл;
4.Источник постоянного тока и мини-камера для горизонтального гель-электрофореза с заливочным столиком «Bio-Rad»;
5.Микроволновая печь;
6.Наборы из трех автоматических пипеток на 2-20 мкл, на 20-200 мкл и на 100-1000 мкл «Gilson»;
7.Лабораторный шейкер-вортекс «Вортекс V-1» фирмы Биосан;
8.Термостат модель KB53, «Binder»;
9.Мерные стаканы и колбы, одноразовые пластиковые пробирки и наконечники для пипеток;
10.Стационарная культура E. coli, содержащая рекомбинантную плазмиду;
11.Буферы и реагенты для выделения плазмидной ДНК;
a.Раствор №1 для выделения плазмидной ДНК;
b.Лизоцим сухой;
c.Раствор №2 лизирующий;
d.Раствор №3 нейтрализующий, 3М CH3COONa pH 4.75 (Ацетат Na);
e.Этанол 100% для осаждения ДНК;
f.Этанол 75% для промывания ДНК;
g.Раствор ТЕ для растворения ДНК;
h.Раствор фермента РНКаза А для расщепления РНК, 10 мг/мл;
12.Буферы и реагенты для проведения агарозного электрофореза;
a.TAEX50;
b.Бромистый этидий;
c.Краска для нанесения ДНК в гель;
d.Маркеры молекулярного веса DNA Ladder NEB: 1 kb and 100 bp.
Задача №1. Выделение плазмидной ДНК
Ход работы:
1.Культуру E. coli, содержащую рекомбинантную плазмиду, центрифугировать в 2 мл или 1,5 мл пробирках при 5000 rpm 3 мин. Культуральную среду вылить, осадок осушить;
2.Ресуспендировать осадок в 100 мкл раствора №1 (25 мМ Tris-HCl pH 8.0, 10 мМ EDTA, 50 мМ глюкозы, РНКаза А) с лизоцимом (на кончике шпателя на 10 мл), инкубировать 5 мин при комнатной температуре;
3.Добавить 200 мкл свежеприготовленного лизирующего раствора №2 (0.2 М NaOH, 1% SDS). При приготовлении 10 мл раствора 1 мл 10% SDS и 200 мкл 10 М NaOH). Инкубировать с мягким перемешиванием с перевертыванием пробирки до полной прозрачности, но не более 5 мин (важно!);
2
4.Добавить 200 мкл 3 М NaOAc pH 4.75 для нейтрализации (раствор №3), смешать переворачиванием и инкубировать не более 5 мин, периодически помешивая;
5.Центрифугировать на максимальных оборотах 2 мин (16000 rpm), потом перемешать переворачиванием и продолжить центрифугирование еще 6 мин;
6.Приготовить чистую пробирку с 1 мл 100% этанола. Весь супернатант осторожно, не разрушая белковый осадок, прилить к 1 мл этанола, перемешать на вортексе и центрифугировать 5 минут на максимальных оборотах. Старую пробирку с белковым осадком выбросить. После центрифугирования образуется белесый осадок, содержащий плазмидную ДНК и остатки РНК. Супернатант от осадка нуклеиновых кислот вылить;
7.К осадку нуклеиновых кислот прилить 1 мл 70% этанола для промывки осадка от солей, перемешать на вортексе, затем центрифугировать 2 минуты на максимальных оборотах. Большая часть осадка, скорее всего, останется прилипшей на стенке пробирки;
8.Супернатант вылить, остаток спирта удалить пипеткой, осадок осушить на воздухе 10 мин и растворить в 80 мкл ТЕ (10 мМ Tris-HCl pH 8.0, 1 мМ EDTA).
Задача №2. Анализ полученных препаратов плазмидных ДНК с помощью горизонтального электрофореза в геле агарозы
Ход работы:
1.Приготовить буфер 250 мл TAE (40 мМ Трис-ацетат, 2 мМ ЭДТА, pH 8.0) для электрофореза разведением стокового раствора TAEX50;
2.Приготовить 1% гель агарозы на ТАЕ-буфере;
a.Для 100 мл геля взять 100 мл H2O, добавить 2 мл TAEx50 и высыпать в буфер навеску 1 г агарозы. Навеску взвешиваем, насыпая агарозу через край в пластиковую плашку для взвешивания;
b.Расплавить агарозу в микроволновой печи (~2 раза по 30 сек с интенсивным перемешиванием между). Проконтролировать визуально однородность расплава;
c.После остывания до умеренно горячего состояния (едва терпит рука) добавить бромистый этидий до 0,025 мкг/мл (2,5 мкл бромистого этидия на 100 мл расплава геля);
d.Залить гель в форму до толщины ~5 мм. Для этого выровнять заливочный столик с помощью уровня, зажать между резиновыми стенками подложку для геля, вставить гребенку для формирования лунок в геле. Подождать до полной полимеризации 20 мин;
e.Вынуть гель вместе с подложкой и гребенкой и вставить все в прибор для электрофореза. Налить в прибор приготовленный TAE буфер так, чтобы он был выше геля на 2-3 мм;
f.Придерживая подложку вниз, вытащить гребенку строго вверх, не перекашивая по сторонам;
3.В объеме не менее 15 мкл нанести 1 и 4 мкл полученного препарата рядом с 500 нг маркерной ДНК (например, 2 мкл 1 kb DNA Ladder NEB) в лунки приготовленного 1% геля агарозы. Образцы перед нанесением смешивают с 1 мкл буфера для нанесения и электрофорезным буфером так, чтобы наносимый объем составил 10-15 мкл, для равномерного распределения ДНК по толщине геля;
4.Провести электрофорез в течение 40 мин при напряжении 100 В;
5.С помощью системы видеодокументации получить фотографию геля в проходящем УФ-свете при длине волны 260 нм, для чего:
a.Включить компьютер и 2 кабеля системы видеодокументирования Gel Doc X фирмы «BioRad»;
b.Запустить программу Quantity One 4.5_6, открыть в ней в раскрывающемся меню Gel Doc X. Инструкция по использованию находится в папке прибора;
c.Сделать скан геля согласно указаниям. После открывания скана геля сохранить его в формате
JPG;
3
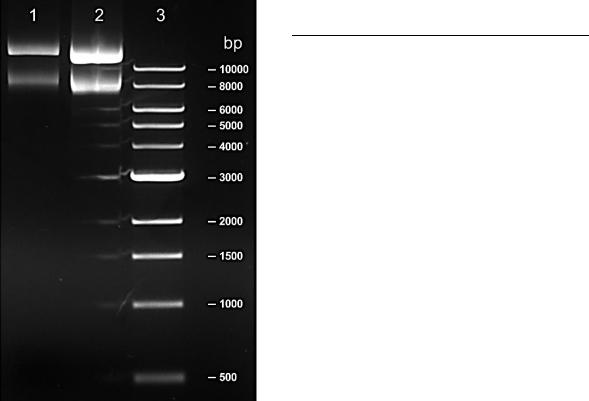
6.Идентифицировать полосы плазмидной ДНК в полученном препарате. Оценить суммарное количество плазмидной ДНК во внесенной в гель пробе путем сопоставления интенсивности свечения полос полученного препарата с интенсивностью свечения стандартной ДНК. После этого пересчитать количество полученной ДНК на общий объем препарата;
7.Записать вывод о качестве и количестве полученного препарата плазмидной ДНК.
Анализ полученных результатов:
Таблица 1 – Молекулярный вес
Рисунок 1 – Визуализация плазмидной ДНК в 1% геле агарозы, окрашен бромистым этидием. 1 – 1 мкл образца, 2 – 4 мкл образца, 3 – маркер молекулярного веса 1 kb DNA ladder.
RF |
Mw (kbp) |
|
|
Sample 1 (1 µl) |
|
|
|
0,19 |
10,63 |
0,26 |
8,07 |
|
|
Sample 2 (4 µl) |
|
|
|
0,21 |
10,04 |
0,27 |
7,63 |
|
|
Standarts |
|
|
|
0,23 |
10,00 |
0,27 |
8,00 |
0,33 |
6,00 |
0,37 |
5,00 |
0,42 |
4,00 |
0,49 |
3,00 |
0,60 |
2,00 |
0,68 |
1,50 |
0,80 |
1,00 |
0,97 |
0,50 |
|
|
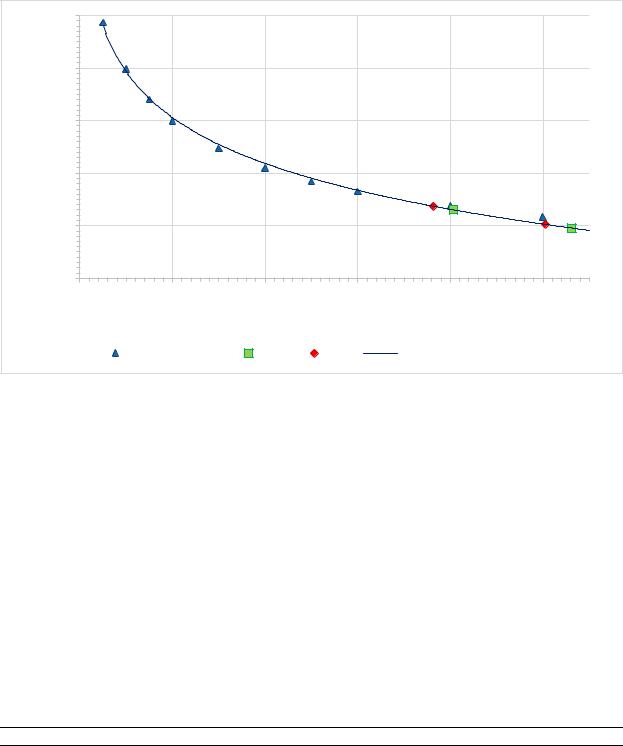
Был проведен электрофорез в 1% агарозном геле, получена электрофореграмма (Рис. 1). Построен калибровочный график на основе маркеров длин ДНК (Рис. 2) и выполнена логарифмическая аппроксимация в соответствии со стандартами. Результаты аппроксимации молекулярного веса представлены в Таблице 1.
4
1,00 |
|
|
|
|
|
|
y = -0,252ln(x) + 0,7864 |
|
|
||
0,80 |
|
|
|
|
|
0,60 |
|
|
|
|
|
RF |
|
|
|
|
|
0,40 |
|
|
|
|
|
0,20 |
|
|
|
|
|
0,00 |
|
|
|
|
|
0,00 |
2,00 |
4,00 |
6,00 |
8,00 |
10,00 |
|
|
|
Base Pairs, kbp |
|
|
|
Стандарты |
1 |
2 |
log-аппроксимация |
|
Рисунок 2 – График аппроксимации зависимости молекулярного веса от пройденного пути
На треках 1 и 2 с препаратом плазмидной ДНК расположено по 2 бэнда. Верхние бэнды содержат более длинные молекулы ДНК, и их свечение более интенсивно, чем свечение нижних. По всей видимости, первый бэнд на обоих треках представляет собой релаксированную форму плазмидной ДНК (open circular), а второй – суперскрученную (covalently closed circle).
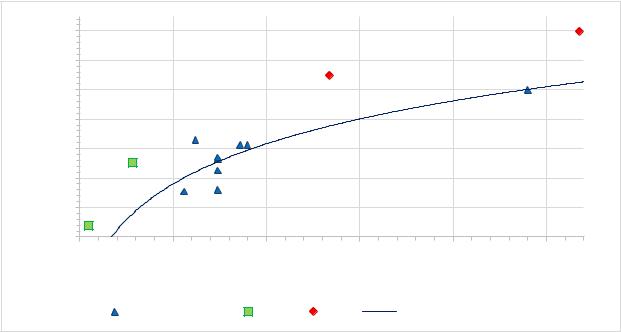
Оценка суммарного количества плазмидной ДНК во внесенной в гель пробе путем сопоставления интенсивности свечения пробы и стандартов проводилось при помощи программы ImageJ. По полученным значениям интенсивности свечения был построен калибровочный график с помощью заведомо известных количеств стандартных образцов. Интенсивность свечения маркера с массой 125 нг (Mw=3kb) принималась за 1,0.
Таблица 2 – Отношение массы к интенсивности свечения
Стандарты
Мол. вес, кб |
10,0 |
8,0 |
6,0 |
5,0 |
4,0 |
3,0 |
2,0 |
1,5 |
1,0 |
0,5 |
Интенсивность |
0,76 |
0,73 |
0,81 |
0,77 |
0,65 |
1,00 |
0,81 |
0,83 |
0,66 |
0,37 |
Масса, нг |
42,0 |
42,0 |
50,0 |
42,0 |
33,0 |
125,0 |
48,0 |
36,0 |
42,0 |
42,0 |
Образцы |
№1 |
|
|
|
|
№2 |
|
|
|
|
Мол. вес, кб |
10,63 |
|
8,07 |
|
10,04 |
|
7,63 |
|
||
Интенсивность |
0,75 |
|
0,54 |
|
1,20 |
|
1,05 |
|
||
Масса, нг |
19,26 |
|
7,44 |
|
138,86 |
|
71,88 |
|
||
5
|
1,20 |
|
|
|
|
|
|
1,10 |
|
|
|
|
|
Интенсивность |
1,00 |
|
|
|
|
|
0,90 |
|
|
|
y = 0,2253ln(x) - 0,0863 |
||
|
|
|
|
|||
0,80 |
|
|
|
|
|
|
0,70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0,60 |
|
|
|
|
|
|
0,50 |
|
|
|
|
|
|
5,00 |
30,00 |
55,00 |
80,00 |
105,00 |
130,00 |
|
|
|
|
Масса, нг |
|
|
|
|
Стандарты |
1 |
2 |
log-аппроксимация |
|
Рисунок 3 – График аппроксимации зависимости массы от интенсивности свечения |
||||||
По результатам расчетов суммарное количество плазмидной ДНК было внесено
a)на дорожку с 1 мкл образца в количестве 26,7 нг;
b)на дорожку с 4 мкл образца в количестве 210,7 нг.
Впересчете на объем препарата концентрация ДНК составляет
a)в образце с 1-й дорожки 26,7 нг/мкл;
b)в образце со 2-й дорожки 52,7 нг/мкл.
Расхождение можно объяснить неточностью кривой аппроксимации и измерения интенсивности свечения.
Вывод: было проведено выделение и последующий анализ плазмидной ДНК. В результате анализа были получены следующие результаты:
1.Анализируемый препарат плазмидной ДНК, по всей видимости, представляет собой смесь двух форм плазмидной ДНК – релаксированной (oc) и суперскрученной (ccc);
2.Молекулярный вес исследуемых образцов составил 10,63 и 8,07 килобаз (1- й трек, 1-й и 2-й бэнд), 10,04 и 7,63 килобаз (2-й трек). Вероятно, первый бэнд на обеих дорожках соотвествует димерной форме плазмидной ДНК (за счет их большего размера);
3.Суммарное количество внесенной в гель плазмидной ДНК составило 26,7 нг на первый трек, и 210,7 нг на второй. В пересчете на общий объем внесенного препарата, концентрация ДНК в образце с 1-й дорожки составила 26,7 нг/мкл, со 2-й – 52,7 нг/мкл.
6
