
Лебухов ФХ методы исслдния292-325
.pdf
312 ЧАСТЬ I. ТЕОРИЯ: ФИЗИКО ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Тонкослойная хроматография находит применение при исследовании некоторых видов пищевых продуктов на безопасность, например для выявления токсинов (аф латоксинов, микотоксинов, патулина и др.) в арахисе, зер новых, овощах, фруктах, напитках; для определения пе стицидов (ДДТ и др.) в растительных и животных продук тах, гистамина как показателя порчи рыбы. Кроме того, ТСХ часто сочетают с газовой хроматографией, электро форезом и другими методами.
6.4. ХРОМАТОГРАФИЯ НА БУМАГЕ
По механизму разделения различают распределитель ную, адсорбционную, осадочную и другие виды бумаж ной хроматографии (БХ). В распределительной жидкость жидкостной хроматографии бумага, приготовленная из специальных сортов хлопка, исполняет роль носителя не подвижной жидкой фазы (НФ), в качестве которой часто выступает адсорбированная вода. В таком случае гидро фильная бумага используется для нормально фазовой хроматографии. Растворителями (ПФ) являются спирты (метанол, этанол, н пропанол, бутанол), простые эфиры (этиловый, метиловый), кетоны (ацетон, ацетилацетон), эфиры органических кислот (метилацетат, этилацетат), пиридин, хлороформ. Чаще используются смеси раство рителей. Так, для разделения неорганических неполяр ных веществ употребляют системы:
ацетон : HCl : H2O (в различных соотношениях);
H бутанол, насыщенный НCl (различной концентра ции);
H бутанол : 0,1М HNO3 : ацетилацетон.
Для разделения некоторых органических веществ ис пользуют метод обращенных фаз. В этом методе для при дания бумаге гидрофобного характера ее импрегнируют (пропитывают) нафталином, парафином, раствором кау чука, силиконом и др. Такая бумага служит носителем для неполярных растворителей в качестве НФ. В качестве ПФ применяют смеси кислот с низшими спиртами.

Глава 6. Методы хроматографического анализа |
313 |
Рис. 6.7
Виды бумажной хроматографии
Обращенно фазовая бумажная хроматография исполь зуется, например, для разделения и идентификации по линасыщенных жирных кислот при изучении состава липидов, выделенных из животных тканей. Бумагу про питывают 5% ным раствором силикона, в качестве ПФ используют 85% ный раствор уксусной кислоты.
Разделение веществ в распределительной БХ осуще ствляется благодаря различию в скоростях движения ком понентов при многократном повторении актов экстракции и сорбции. Скорость перемещения компонентов зависит от их коэффициентов распределения (как и в методе экст ракции).
По направлению движения элюента (ПФ) различают восходящую, нисходящую и радиальную (круговую) хро матографию (рис. 6.7). Если элюент движется по бумаге вверх, метод называют восходящей (а) бумажной хрома тографией; при его движении сверху вниз — нисходящей (б) бумажной хроматографией. Очень быстро можно осу ществить хроматографический анализ методом радиаль ной (в) бумажной хроматографии, в котором использует ся бумажный круг (г) с фитилем, опущенным в элюент.
Иногда при сложном составе пробы не удается разде лить ее компоненты с помощью одного растворителя. Тог да применяют двумерную хроматографию. В угол квадрат ного листа хроматографической бумаги наносят раствор

314 ЧАСТЬ I. ТЕОРИЯ: ФИЗИКО ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Рис. 6.8
Двумерная хроматография
пробы и хроматографируют сначала в одном элюенте, за тем, повернув хроматограмму на 90 , — в другом. Первый элюент производит предварительное разделение компо нентов пробы, второй — окончательное (рис. 6.8).
Для хроматографии на бумаге используют стеклянные герметизированные камеры. Внутри камеры в верхней (нисходящий вариант) или нижней ее части (восходящий вариант) помещают сосуд для подвижной фазы (лодочку).
Радиальную хроматографию можно осуществить в чаш ке Петри. Детекцию зон, идентификацию и количествен ное определение в БХ проводят так же, как и в методе тон кослойной хроматографии.
Методом распределительной жидкостной бумажной хроматографии успешно анализируют смеси катионов в неорганическом качественном анализе, смеси аминокис лот и других органических кислот, пептидов, пестицидов, фенолов, красителей, синтетических поверхностно актив ных веществ.
6.5.
ЭЛЕКТРОФОРЕЗ
Метод анализа, основанный на способности заряжен ных частиц к передвижению во внешнем электрическом поле, называют электрофорезом (греч. phoresis — пере несение). Электрофорез относится к методам разделения без превращения веществ, на основе заряда частиц. По тех нике выполнения метод аналогичен хроматографии.
Нередко под электрофорезом понимают перемещение коллоидных частиц или макромолекул (в отличие от ионо

Глава 6. Методы хроматографического анализа |
315 |
фореза — перемещения неорганических ионов малого размера).
Передвижение частиц при электрофорезе зависит от ряда факторов, основными из которых являются: напря женность электрического поля; величина электрическо го заряда; скорость и размер частицы; вязкость, рН и тем пература среды; продолжительность электрофореза.
Электрофорез можно проводить как в свободном ра створе (фронтальный электрофорез), так и на носителях (зональный электрофорез). Последний вариант более пред почтителен, так как носители способствуют стабилизации электрофоретических зон. В качестве носителей исполь зуют: фильтровальную бумагу, силикагель, крахмал, ок сид алюминия, поливинилхлорид, агаровый или полиак риламидный гель и др. Электрофоретическое разделение осуществляют на бумаге, в тонком слое сорбента, колонке или в блоке, который часто формируют из суспензии крах мала в подходящем электролите.
Аппаратура для электрофореза выполняется по еди ной схеме: источник тока, камера для электрофореза, два электрода, соединяющих камеру с источником тока, и приспособление для сбора и идентификации разделенных веществ (последний блок в некоторых случаях отсутству ет). Для электрофореза используются как готовые наборы аппаратуры (универсальный прибор для иммуноэлектро фореза и электрофореза белков на бумаге и крахмале, на бор для электрофореза в полиакриламидном геле венгерс кой фирмы «Реанал»), так и наборы, составляемые экспе риментатором из отдельных приборов.
На рисунке 6.9 представлена схема прибора для элек трофореза на бумаге. Электрофоретическая камера состо ит из двух кювет, в которые помещают графитовые элект роды и раствор проводящей жидкости (буферный раствор). Выше кювет располагается подставка для носителя бума ги. Смесь веществ, подлежащих разделению, наносят на бумагу, пропитанную проводящей жидкостью. Бумагу подсушивают, помещают на подставку, концы погружа ют в кюветы, затем камеру плотно закрывают крышкой. После пропитывания бумаги проводящей жидкостью под
316 ЧАСТЬ I. ТЕОРИЯ: ФИЗИКО ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Рис. 6.9
Схема прибора для электрофореза
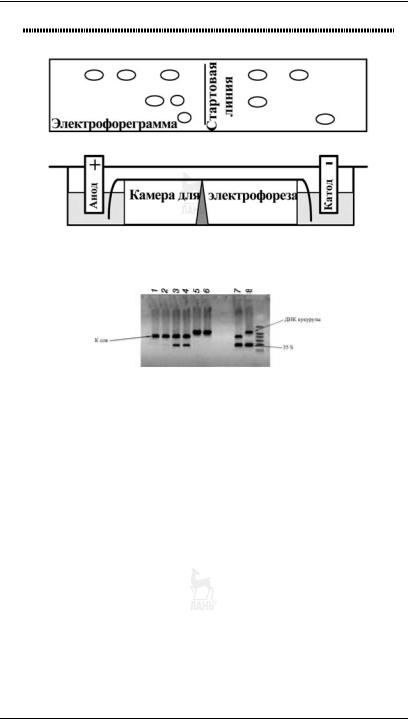
Рис. 6.10
Электрофореграмма образцов на наличие генетически модифицированных ингридиентов
с помощью тест системы «АмплиСенс®ПЛАНТ,СКРИН»:
1, 2 — соевая мука, не содержащая ГМ сои; 3, 4 — соевая мука, содержащая ГМ сою; 5, 6 — кукурузная мука, не содержащая ГМ кукурузы; 7 — положительный контроль ПЦР ГМ сои 40 3 2; 8 — положительный контроль ПЦР ГМ кукурузы MON 810; ок — отрицательный контроль выделения ДНК; к — отрицательный контроль ПЦР.
ключают электрический ток. По окончании электрофоре за бумагу подсушивают. Качественную и количественную оценку осуществляют, применяя методы, используемые в бумажной хроматографии, например, проявление бел ков с помощью красителей, метод денситометрии.
Важной областью применения электрофореза являет ся анализ белков сыворотки крови, аминокислот, гидро лизатов белков, нуклеиновых кислот и т. п. В кислотном буферном растворе аминокислота находится в виде кати она NH3+...СООН, который перемещается к катоду, в то время как в щелочном буфере аминокислота превращает

Глава 6. Методы хроматографического анализа |
317 |
ся в анион NH2...СОО– и движется к аноду. В изоэлектри ческой точке аминокислота находится в растворе в виде биполярного иона NH3+...СОО– и в электрическом поле не передвигается.
Ввиду того, что отдельные белки и аминокислоты име ют различные изоэлектрические точки, при определенном значении рН они передвигаются с разной скоростью. Под бирая буферные растворы для установления определенной скорости движения и растворимости веществ, можно ис пользовать электрофорез для их разделения. Метод позво ляет разделять вещества, различие которых в изоэлект рической точке составляет до 0,02 единиц рН. Градиент рН в 0,02 единицы часто достигают прибавлением амфо литов, представляющих собой готовую смесь алифатичес ких полиаминополикарбоновых кислот.
Электрофоретическое разделение белков широко ис пользуется для оценки качества мяса и мясных продук тов, для дифференцирования видов мяса и рыбы. Метод также применяется для выявления немясных добавок (белков молока, сои, яиц) в мясных продуктах. С помо щью электрофореза в полиакриламидном геле можно оха рактеризовать изменение белков в процессе созревания сыров: электрофорез в агарозном геле, окрашенном бро мистым этилом, используют для детекции генетически модифицированных ингредиентов в пищевых продуктах (рис. 6.10).
В настоящее время используют высокоэффективный капиллярный электрофорез — метод разделения и ана лиза компонентов сложных смесей. При анализе этим ме тодом пробу небольшого объема вводят в кварцевый ка пилляр, заполненный электролитом. К капилляру при кладывают напряжение от 10 до 30 кВ. Под действием электрического поля компоненты пробы начинают дви гаться по капилляру с разной скоростью, зависящей от их структуры, заряда и молекулярной массы, и, соответствен но, в разное время достигают детектора (фотометрического или спектрофлуориметрического). Полученная электро фореграмма представляет собой последовательность пи ков, по которым, как и в хроматограмме, можно иденти

318 ЧАСТЬ I. ТЕОРИЯ: ФИЗИКО ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
фицировать и количественно определять конкретное со единение.
Метод обеспечивает очень высокую эффективность раз деления, поэтому широко употребляется не только для вы явления близких по строению веществ (белков, пептидов, аминокислот, витаминов, наркотиков, красителей, ионов металлов, анионов), но и для контроля качества, техноло гического контроля и идентификации лекарственных пре паратов и пищевых продуктов. Капиллярный электрофо рез используют для анализа витаминов А, Е, K, D, B1, B2, B6, B12, С, никотинамида в диетических продуктах, опре деления сульфат , хлорид , йодид ионов в молочных про дуктах.
6.6.
ГЕЛЬПРОНИКАЮЩАЯ (МОЛЕКУЛЯРНО СИТОВАЯ) ХРОМАТОГРАФИЯ
Гельпроникающая хроматография (ГПХ) представля ет собой метод разделения молекул, основанный на раз личии их размеров.
Неподвижной фазой в ГПХ является растворитель, находящийся в порах геля, а подвижной — сам раство ритель, т. е. и подвижную и неподвижную фазу представ ляет одно и то же вещество или смесь веществ. Гель на полимерной основе (декстран, полиакриламид, иные при родные и синтетические полимеры). Различают мягкие, полужесткие и жесткие гели. Принцип разделения моле кул в ГПХ состоит в том, что молекулы анализируемых веществ распределены между неподвижным растворите лем в порах сорбента и растворителем, протекающим че рез слой неподвижной фазы. Молекулы, которые имеют размеры, позволяющие им проникать в поры сорбента при движении вдоль колонки, часть времени теряют на пре бывание в порах. Молекулы, превосходящие поры по раз мерам, не проникают в сорбент и вымываются из колонки со скоростью движения элюента. Молекулы, которые про никают в поры всех размеров, движутся наиболее медлен

Глава 6. Методы хроматографического анализа |
319 |
но. Снижение скорости движения веществ вдоль колонки тем больше, чем в большее число пор способны диффун дировать распределяемые частицы.
Таким образом, при помощи ГПХ можно разделить смеси веществ в зависимости от размеров их молекул. Выход веществ из колонки происходит в порядке умень шения их молекулярной массы. Так можно разделить по липептиды, белки и другие макромолекулы.
Гельпроникающая хроматография на колонке исполь зуется для очистки пестицидов, а также жирораствори мых витаминов перед их определением методом ВЖХ.
6.7.
ГАЗОВАЯ И ГАЗОЖИДКОСТНАЯ ХРОМАТОГРАФИЯ
В газовой хроматографии (ГХ) в качестве подвижной фазы используют газ (азот, гелий, водород), называемый газом носителем. Пробу подают в виде паров. Неподвиж ной фазой служит либо твердое вещество — сорбент (га зоадсорбционная хроматография), либо высококипящая жидкость, нанесенная тонким слоем на твердый носитель (газожидкостная хроматография). Рассмотрим вариант газожидкостной хроматографии (ГЖХ). В качестве носи теля применяют кизельгур (диатомит) — разновидность гидратированного силикагеля; его часто обрабатывают реагентами, которые переводят группы Si–OH в группы Si–O–Si(CH3)3, что повышает инертность носителей по от ношению к растворителям. Таковыми являются, напри мер, носители «хромосорб W» и «газохром Q». Кроме того, используют стеклянные микрошарики, тефлон и другие материалы.
Неподвижную жидкую фазу наносят на твердый носи тель. Эффективность разделения в газожидкостной хро матографии зависит главным образом от правильности выбора жидкой фазы. При этом полезным оказалось ста рое правило: подобное растворяется в подобном. В соот ветствии с этим правилом для разделения смеси двух ве ществ выбирают жидкую фазу, близкую по химической

320 ЧАСТЬ I. ТЕОРИЯ: ФИЗИКО ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Рис. 6.11
Блок схема газового хроматографа
природе одному из компонентов. Подготовленный носи тель помещают в спиральные колонки, имеющие диаметр 2–6 мм и длину до 20 м (набивные колонки). С 1957 г. при меняются предложенные Голеем капиллярные колонки диаметром 0,2–0,3 мм и длиной в несколько десятков мет ров. Жидкая фаза наносится непосредственно на стенку капилляра, которая исполняет роль носителя.
Применение капиллярных колонок способствует по вышению чувствительности разделения многокомпонен тных смесей.
Анализ методом ГХ выполняют на газовом хромато графе (рис. 6.11). Газ носитель из баллона пропускают с постоянной скоростью через хроматографическую систе му. Пробу вводят микрошприцем в дозатор, который на грет до температуры, необходимой для полного испаре ния хроматографируемых веществ. Пары анализируемой смеси захватываются потоком газа носителя и поступают в хроматографическую колонку, температура которой под держивается на требуемом для проведения анализа уров не (она может быть неизменной или по необходимости меняться в заданном режиме). В колонке анализируемая смесь делится на компоненты, которые поочередно посту пают в детектор. Сигнал детектора фиксируется регист ратором (в виде пиков) и обрабатывается вычислительным интегратором.
В ГХ используют детекторы, которые преобразуют в электрический сигнал изменения физических или физи

Глава 6. Методы хроматографического анализа |
321 |
ко химических свойств газового потока, выходящего из колонки, по сравнению с чистым газом носителем. Суще ствует множество детекторов, однако широкое примене ние находят только высокочувствительные и универсаль ные. К таковым относятся: катарометр (детектор тепло проводности); пламенно ионизационный детектор (ПИД), в котором водородное пламя служит источником иониза ции органического соединения; детектор электронного захвата (ЭЗД); термоионный детектор (ТИД), обладающий высокой селективностью к органическим веществам, со держащим фосфор, азот и серу. Интерес к этому детекто ру заметно возрос в связи с заменой хлорсодержащих пе стицидов фосфорсодержащими ядохимикатами, которые используются в сельском хозяйстве и попадают в пищевые продукты. Катарометр позволяет определить концентра ции веществ в пределах 0,1–0,01%, ПИД — 10–3–10–5%; ЭЗД — 10–6–10–10%. Современные детекторы определяют даже пикограммы (10–12 г) вещества в пробе.
Качественный и количественный анализ в методе ГХ производят так же, как и в ВЖХ.
Газожидкостная хроматография находит широкое применение для разделения, идентификации и количе ственного определения сложных многокомпонентных си стем, таких как нефть, биологические жидкости, пище вые продукты, парфюмерно косметические изделия и мно гие другие. Метод отличается высокой чувствительностью, экспрессностью; для анализа не требуется большого ко личества исследуемого образца.
Среди разнообразных хроматографических методов газовая и высокоэффективная жидкостная хроматография являются самыми перспективными для решения сложных задач, связанных с качеством пищевых продуктов. Так, с применением этих методов возможны:
определение химической природы веществ, обуслов ливающих характерный аромат свежих продуктов;
контроль состояния продуктов в процессе обработки и хранения;
объективная оценка показателей, характеризующих качество исходного сырья и готовых изделий;
