
1 курс 1 семестр / Химия / Biochemisry.Obmen_veschestv
.pdf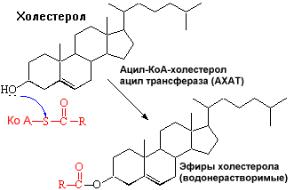
Вотличиерегуляторногодействиярецепторов кЛПНПнаобменхолестеролавклетках, скэвенджер-рецепторыпродолжают транспорХСвклебезторможенияиркуп вать принципуобратнойсвязи.Темса акрофагиым превпенисращаютсякле.Ихобразованиекиые рассматриваеткакначальныйэтапатеро. склерозая
МетаболизмлипопрвысокойплотноститеиновЛПВП( ). |
|
ЛПВПсинтезируютсявклетках |
|
печеникишечника.СразупослесекрецимеютЛПВПвплоскихддисков,содержащихФЛ. |
|
|
|
Белковымкомпоненихявляеапотсяом |
|
-А.Изтканиклемембранйточныхнанихпоступает |
|
холестерол.Поддействифермлецитиннтам |
|
-холестеролацилтрансферазыЛХАТ()из |
|
неэтерифхолестержирнцикислотыфосфатидилхолинаванноголайобразуютсяЭХС.В |
|
|
|
результатечастицыЛПВПсозревают,принифорглобулым.ЗаЭХСтемяпереносятсяна |
|
|
|
ЛП, П,обломкиНПХМспомощьюпидтранспортирующегобел |
каЛПБ()илиапо |
D. |
|
|
Жировоеперерождениепечени |
|
|
Жировоеперерождениепечени |
–этонакоплениевгепатоцитахтриацилглицеролов,которые |
|
|
неокисляютсяневыводятсяизпечени.Причины:действиегепатотоксическихядов |
|
|
|
(алкоголь,четыреххлуглероди ристый |
|
ругие),хроничзаболеванияпечени,скиеопухоли |
|
печени,атакжедефицитб ,холиналковпродуктахпитания.Принедостаткехолина, |
|
|
|
аминоки,особенномети, лнижаетсясинтезниналецитинов, повышасинтезТАГ, тся |
|
|
|
таккакуэтихсоединенийестьобщий |
|
предшественникпроцессесинтеза |
–фосфатидная |
кисл.Крто,притагомеблковомголоданиипеченинарушас ЛПОНПнт, етсяз |
|
|
|
необходдлявыведесинтезированныхмыхнейияТАГ. |
|
|
|
Вещества,предупржировоерерождениеждающиепечени,называютс |
|
я |
|
липотропныфакторами |
.Книмотнхо,месялин,тсеринсяионин.Крт,длягоме |
|
|
предупжипреовогождрерпеченинияждеважальвнпродуктахиячиепитания |
|
|
|
витаминов-синтергистов –В 12 ифолки,неслеводлябходимыхтыйреакцмет влированияй |
|
||
синтезехолецитиновина. |
|
|
|
Глава16ОСОБ. ПЕРЕВАРИВАНИЯННОСТИ |
|
||
|
ВСАСЫВАНИЯБЕЛКОВ |
|
|
Челвосполняетвекпотребностиоргам нокислотахзсчмабелковогопитания.В |
|
|
|
желудочно-кишечномтрактебелкирасщепляютсядосвободаминокислот,которыеых |
|
|
|
всасываютсявенознуюкровьипослепоступлениявпеченьтранспортируютсявдругие |
|
|
|
органыиткани,гдеонивключаютобменвеще. ствя |
|
|
|
Более95%всазотаорганизмугопоставляютаминокислоты. |
|
|
|
Знаминокислотчениедляорганизмапреждевсегоопределяетсяте |
м,чтоонииспользуются |
||
длясинтезабелковпептид.Кро,агомеинокислотывявляютсяпредшественниками |
|
|
|
многихбиологактвеществи:вныхдофаминачески,нор, ре,гистаминаал, ина |
|
|
|
серотонина,трипта,гортриймонинатироксинадтиронинав.Ам |
|
инокислотынеобходимы |
|
длясинтезапуриновыхпиримидиновыхнуклеотидов,глюкозы,кетоновыхтел,гема,холина, |
|
|
|
тауринамногихдругихсоединений. |
|
|
|
Знаниеособпенностейревбелков,атакжериучастияэтомнияпроцессе |
|
|
|
протеолитическихферментжелудочнв |
|
о-кишечноготрактанеобходидляп ниманияо |
|
патоген,диагностлезченияболеванийжелудочноки |
|
-кишечноготракта. |
|
71
Рольбелковпитаниичеловека.Понятиепищевойценностибелк.Аз тистыйв |
|
||||
|
|
|
|
баланс |
|
Обменелковза центральноеимавсто |
|
метаболическихпроцессах,которыепроходятв |
|||
живоморганизме.Этообуслоразнообразием,вленоажностьюуникальностьюфункций, |
|
|
|||
которыевыпобе. лкиняют |
|
|
|
|
|
Ворганизмечеловтечсутокпримкан400егберасплкрноаминокислотыв дается, |
|
||||
нотажекоел |
|
ичествобелкасинтезируется. |
Приэтомнеобратиморасп¼ч даетсясть |
||
аминокислот,котд бытьлжнараявосполненазасчетпищевыхаминокислот.Засутки |
|
|
|||
взрослыйчелд получлженвекгбелков0,7ирасчемассызтьнакг1 тела.Белковое |
|
|
|||
голоданиевызыв |
аетсерьезныенаруш.Этосвязанотем,чтонияорганизмечелмогутвека |
|
|||
синтетолькозаменироватьсяамин,мыевркнезаменимыеислакмяобязательноты |
|
|
|||
должныпоступатьвсиставепродуктпитания.Длябиолюбыхвсинтезабелковнеобходим |
|
|
|||
толькополн |
ыйнаминокислотбор. |
|
|
||
Белкиявляютсяглавнымиазотссоединдержащими.Дляоцбелковогоенобияки енаи |
|
|
|||
испольпонятиеазоти« уетбаланс». тыйя |
|
|
|
|
|
Азотистыйбаланс |
|
–этос отназота,котшениепорыйвступилорганизмвсоставе |
|
||
продуктовпитания,азоту, |
|
которыйвыводитсяорганизма. |
азотистое |
||
Дляздоровоговзрослчеловекапринормальномгорежимепитхарактернония |
|
||||
равновесие. |
|
|
|
|
|
При |
положиазотистомбалансеельном |
количествопоступиазотапревшегоышает |
|||
количествовыведенн.Полазжительныйобтистыйго |
|
|
алансхарактерендляпе оста,иода |
||
такжедлявыздпозаборовсле. левания |
|
|
|
||
При отрицаазобалансетистомельном |
,наоборот,количествовыведенногоазота |
||||
превышаколичествопоступившего.Таз баланстистыйотмечприа, ренииется |
|
|
|||
голодании,длите |
льныхзаболеваниях,такжедлясостояний,характеризующихсяусиленным |
|
|||
распадбелк. омв |
|
|
|
|
|
Переварибелковжелудочноание |
-кишечномтракте.Рольжелудочногосокана |
||||
|
|
|
начальномэтапепереварибелкования |
|
|
Вротпоотсутствуютйлостифе,рментыасщепляющие |
|
белки,поэтомупереваривание |
|||
белковлокалжелудкеикишечникезовано. |
|
|
|
||
Вжелудочномсокесодержатсясолянаякислотаферменты,необходимыедляначального |
|
|
|||
этапапереварибелков. ания |
|
|
|
|
|
Желудочныйсокпредставсобобесцв, лопалесцирующуюяетегкатнуюжидк |
|
ость |
|||
плотностью 1,007г/см |
3 ирН1,5 |
– 2,5Втечениесуток. человекаобразуется1,5 |
– л2,5 |
||
желудсока.Онсостчнна99оитго |
|
|
– 99,5%изводыи1 |
– 0,5%плостаткатного. |
|
Вжелудочномсокесодержатферпеп( ,реннинентыс,гастрикся ,желат); иназа |
|
соли; |
|||
гастромвн( уфактортренниймукопротеиныКастла); сли,котораязащищает |
|
|
|||
слизистуюоболжелудкаодействиячкупротеолитическихферментов;азотсодержащие |
|
|
|||
вещестмочев( ,мочевкаи)слотана. я |
|
|
|
|
|
Вобкладочныхклеткахжелудкасинтезируетсясол |
|
янаякислота,котораясекретируетсяв |
|||
положелудкаисоздаеттьвнейнеобходимуюкисл.С кислтностьлянаядлябходимата |
|
|
|||
всасывжелеза,длян буханияденатурациибелк,онасоздаетвптзначениемальноерН |
|
|
|||
длядействпепс.Кртио,янгомеаа |
|
|
еобходимадляобразовапепсиизпепсиногена. ая |
||
Благодарясолянойкислотевжелудкенепроисходятгнилостныебродильныепроцессы. |
|
|
|||
Известныследующиенарушенсолянойпродукциивслотыжелудке: |
|
|
|||
гиперхлоргидрия –повышенняпродукция;
гипохлоргидри я - пониженнаяпродукция;
анацидитас –полноеотсутствиесолянойкислоты;
ахилия – отсутствиежелудочсоксолянойкислотыпепсинам Приполнойахиливрезультатеитотальнойрезекциижелудкаможетвозникнуть
злокачественнаяпернициознаяанемия, |
вызваннаядефицитомтаминаВ |
12,потомучтов |
72
этомслучаенепродуцивнутреннийуется |
факторКастла |
–гастромукопротеин,необходимый |
||
длявсасыванвитаминаВ я |
|
12. |
|
|
Крномермальныхкомпонентовжелудочногосока,существуютпатологические |
|
|||
компоненты, |
которыеотсуздоровтствуютчел,нпоовекагояляютсяпринекоторых |
|
||
заболеваниях.Книмотносятся:кровь,желчныекислоты,летучжирныекислоты,молочная |
|
|||
кислота.Например,молочнаякислотаобнаруживжелудочномсокепражелудкаикеется, |
|
|||
когдаврако |
выхклеткактивируетсянаэробныйхгликолиз. |
|
||
Протеолитическиеферментыжелудочно |
-кишечноготр:актмеханизмивация |
|||
|
|
|
действия |
|
Переварибелкование |
–этоферментативныйгидролпептсвямолекулахдныхзей |
|
||
белков,результатекотооб свогоазуются |
ободныеаминокис.П реварибелотыкование |
|||
осуществляпомощьюпротфермеолитическихтся,принклассутовадлежащихгидролаз |
|
|||
(пептидгидролазы,пептидазы)Вначале. этиферментысинтезируютсявнеактивнойформе |
|
|||
(проферментыилизимогены),апотом,впроце |
|
ссепищеварения,активируютсяпутем |
||
частичногопротеолиза |
–гидролизаоднойпептиднойсвязиотщеплениемингибирующегоN |
- |
||
концевогопептида.Врезультатечастичногопротеолизаизменяетсяконферо, ентаация |
|
|||
формируеегоактивныйцен. сяр |
|
|
|
|
Местосинтеза |
|
проферментслизистая( оболочкажелу, одвжелка)имудочнаяезасто |
|
|
ихактивацииполость( желуд,полостьтонкойишкиа)пространственноразделены.Это необходдлязащитыжелупомодкажелезыотаудтоперевариваниячной.
Преждевременнаяактива цияпроферментовпроисходитприязвеннойболж знилудка (активипе),приостромпанкреатуетсяактив( трдругиетеруютсяпсин панкрфе)рментыатические.
|
|
|
|
|
Протеолитическиефе ментыазделяютсянаэкзопептидазыэндопептид |
|
азывзависимости |
||
|
||||
отместавоздействиянамолекулусубстрата. |
|
|
|
|
Пептидазы,которыегидролизуютпептидсвязьконамицевойую,нокислотыазываются |
|
|
|
|
экзопептидазами:аминопепткарбоксипептидазы, , |
|
-,трипептидазы. |
||
Эндопептидазыгидролизуютпептисвязи,удаленыеоткомолныецовб. лкакулы |
|
|
|
|
Эндопепявляютсяпепсхимотрипсин, идазами, ,эластаза. |
|
|
|
|
Взависимостиотналичиясер,ц стеинадругойбоаминоквактцентреивнслотым |
|
|
|
|
феразличаютментасериновые,цистеиновы |
еидругиепротеазы. |
|||
73
|
Всепептидазыявляютсяферментами |
относительнойспецифичностью |
|
:онирасщепляют |
|
|||
всеб,нолкикаждыйэтихзферментовгидролизуетпептидныес ,образованныеязилишь |
|
|
|
|
||||
определеннымиаминокислотами. |
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Эндопептидазы |
|
|
|
|
|
Пепсин |
|
|
Гидролизует пептидныесвязи,образованныекарбоксильными |
|
|
||
|
|
|
|
группаароматичаминокислотФ(,Тире),такжескЛейх |
|
|
|
|
|
|
|
|
Глу |
|
|
|
|
|
Трипсин |
|
|
Гидролизуетпептидныесвязи,образованныекарбоксильными |
|
|
|
|
|
|
|
|
группамиосновныхаминокислотЛиз(Арг) |
|
|
|
|
|
Химотрипсин |
|
Гидролизуетпептидные |
связи,образованныекарбоксильными |
|
|||
|
|
|
|
группаароматичаминокислотФ(,Тире, ск)рих |
|
|
|
|
|
Эластаза |
|
|
Гидролизуетпептидныесвязи,образованныекарбоксильными |
|
|
|
|
|
|
|
|
группамиснебольшрадикаламиокислотГл(,Ала,Сер) |
|
|
|
|
|
|
|
|
Экзопептидазы |
|
|
|
|
|
|
|
|
|
|
|||
|
Карбоксипепти |
|
ОтщепляетнейтральныеаминокислотыС |
|
-концапептидов |
|
||
|
да-заА |
|
|
|
|
|
|
|
|
Карбоксипепти |
|
ОтщепляетосновныеаминокислотыС |
|
-концапептидов |
|
||
|
да-заВ |
|
|
|
|
|
|
|
|
Главнымферментомжелудочногосокадетейгруднвозрастаявляетсяреннингохимозин( ). |
|
|
|
|
|||
ОптимумрНдляреннина |
|
|
– 3,5 – С5,0. |
помощьюэтогоферментаикатионовкальция |
|
|
|
|
происходитствораживаниемолока,тоестьпреобрпутемчастичзовапротеолизаногоие |
|
|
|
|
||||
растворимыхбелмолокаазеиновнерас.Этормозитворимыедальнейшеепродвижение |
|
|
|
|
||||
белковпожелудочно |
-кишечномутракту,что |
увеличивавремядляперевариб тлкования |
|
|
||||
желудке. |
|
|
|
|
|
|
|
|
|
|
|
|
Всасываниеаминокислот |
|
|
|
|
|
Максимальнколичествоаминокислоткрнаблюдаетсявиужечерез30 |
|
|
– 50минутпосле |
|
|||
приемапищи. |
|
|
|
|
|
|
|
|
|
Аминокислотывсасываютсямикроворсэпителслизоболочкитонкогонкахстойя |
|
|
|
|
|||
кишечника.Этоактивныйпроцесс,требующийзатратэне.Тргиианспоминокислотчерез |
|
|
|
|
||||
клеточныемембраныосуществляется |
помеханизмувторично |
- |
активного транспорта.В |
|
||||
соответствиисэтимеханактперевеществаизмомвныйодночерезгомембрану |
|
|
|
|
||||
осуществляетсязасчетэнеградгииконцентрацииентадругоговещ.П ствареносчикимеет |
|
|
|
|
||||
специфическиеучасткисвязываниядлядвухтиповвеществ.Присасыванииаминок слот |
|
|
|
|
||||
используетсяэн |
ергияградиентаконцеио ,котоврсацииияоздаетсяработой |
|
|
|
|
|||
мембранного фермента |
Na+,K+-АТФазы.ВданномслучаеэнергиягидролизаАТФвначале |
|
|
|
||||
трансфовэнерансмембраругиюградиентаконцетсяио ,кнтоврациитгоиярая |
|
|
|
|
||||
ибудет исподлятранспортаьзоватьсяаминокислот. |
|
|
|
|
||||
|
Взависимостиотструктаминокисуществурыпятьтиппереносчиковл :длят |
|
|
|
|
|||
нейтральныхаминскороткойуглеводороднойкислцепью,длянейтральныхаминокислот |
|
|
|
|
||||
длиннойуглеводорцепью,дляоснамиодвнойых |
|
нокислот,длякислыхаминокислотдля |
|
|||||
пролина.Каждыйпереносчикимеетучасткисвязыванияаминокислотойиономнатрия. |
|
|
|
|
||||
Пройдячерезмембрану,аминокислотаотделяпер,екатионтсяносчиканатрия |
|
|
|
|
||||
выкачиваетсяизклеткипомощью |
|
|
Na+, K+-АТФазы. |
|
|
|
||
|
Существуетидругаясистематранспоаминокислотчерклеточныетамембраныз |
|
|
- |
|
|||
|
гамма -глутамильнийцикл |
.Внемпринимаютучастиешестьферментовтрипептид |
|
|
|
|||
глутатионгамма( |
-глутамилцистеинилглицин). |
|
|
|
|
|||
|
Гларольвэнуютойранспосистемеигмембраносвяаеттной |
|
|
занныйфермент |
γ- |
|||
глутамилтрансфераза.Ферменткатализируетперенос |
|
γ-глутамильнойгруппыот натиона |
|
|||||
74
транспортируемуюаминокислоту.Затемкомплекс |
γ-глутамиламинокислотапоступаетвклетку. |
|
Далееспомощьюещепятивнутриклферментовпроисходитточных |
освобождениеиз |
|
дипептиаминоксвободресойзатринслотытранспортаезчемолекулыной |
|
|
глутатиона. |
|
|
Небколнерасщепленныхьшоеичествобелковдипептидоввсасываютсякишечник |
|
|
путемпиноцитоза |
.Вэнтероцитахонигидрдоамл протезуютнокисялот |
олитическими |
ферментализосо. ми |
|
|
Повсасываниялеаминокдиффундикишечникаслотызвпоркровотоктальныйуют, |
|
|
печеньиобщийкровоток.Свободныеаминок,отлотбелкови,слотычиенеимеютвидовой |
|
|
специфичнос,поэтомуявляютсяант.игенами |
|
|
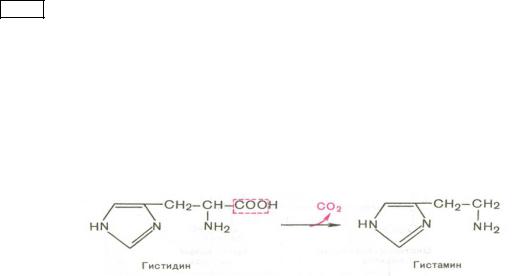
Гниениебелковтолстомкишечнике.Образованиекрезола,фенола,скатолаиндола |
|
|
Нерасщепленныенааминокислотыбелкивдальнейшподвергаюгнитолсмниютомся |
|
|
кишечнике.Этомногоэтапныйпроцесс,вкоторомучаствуютферментымикрофлтолстогоры |
|
|
кишечника.Поддействфермиекроорганизмовнтовбелкивначалераспадаютсядо |
|
|
аминокислот,которыедалееподвезаминидекарбоксилированиюргаются, , |
|
|
окислению,метилированвосстановлению, другпреобразованиям.Врезультатеэтих |
|
|
реакциймогутбразов |
атьсятоксичвещ. ескиетва |
|
На,пдействодримферммиекроорганизмовнтовраспадаютсябоковыецепи |
|
|
триптофанатирозина,впоследствииобразуютсятоксины: |
крезол,фенол,скатолииндол. |
|
Тирозин →Крезол →Фенол |
|
|
Триптофан →Скатол →Індол |
|
|
Далеестоко |
мкровионипоступаютвпечень,гдепомощьюспециальферментных |
|
систобезвреживаюм,послечеговыводяорганизмасмочойтся. |
|
|
Уздоровогочеловинтеканбсивненевеллкния,нопрстьзаболеванияхка |
|
|
желудочно-кишечноготракта,приинфекцио |
нныхзаболепонав,чтоанияхышаетсяприводит |
|
кинторганизмаксикации. |
|
|
НарушениепереварибелкоКвашиоркор. ания
Нарушениепереварибелковможетбытьвызваноанияразличнымипричинами.Напр, мер онопроисходитпринарушсинтезакрецииниисолянойкислоты,приактивностизкой протеолитическихпищеварительнферментов,принарушениивсаскишечникеываниях продуктовгидролизабелков.
Прибелковомголоданиивозниксиндромкв ет.шиоОнвствнекоторыхкорачается странах Африки,Азии,ЮжнойАмерики.
Квашиоркорхарактеризуетсяусиленнымпадомобственныхбелковвследствие белковогоголода,такжеугнеиятение мсинтезабелковорганизме,чтонегативно сказываетсякакнапротеканиивсехметаболическихпроцессов,такнапроцессы переваривания,котакжеорыенарушаютсярезультадефицитасоо ветствующих ферментов.
|
Глава17ОБЩИЕ.ПУТИПР ОБРАЗОВАНИЙ |
АМИНОКИСЛОТ: |
|
ТРАНСАМИН,ДЕЗАМДЕКАРБОКСИЛИРОВАНИЕ. НИРОВАНИЕ |
|
||
Ворганизмечеловекаживосущетриныхстсвободвуеточникааминокислот: ых |
|
||
аминокислотыпищи; ,нокислотыобразующиврезультатерасщеплениясобственныхся |
|
||
белков;иаминокислоты |
,котмсинтезироватьсярыегут |
–заменамин.Всемыеонкислоты |
|
состфондамивляют,необходимыйокислотдлябиосинтезапептид,белк, ов |
|
|
|
низкомазотлекулярныхсоединенийдержащих. |
|
|
|
Аминокисломогутвключаметаболическиепроцессыься,врезультатек |
отонирых |
||
потеряютамино |
-либокарбоксильгруппы.Распадамидонкыеокислотнечныхпродуктов |
|
|
(диоксиуглерода,во,аммиакаы)сопровождаетсявысвобождениемэнергии. |
|
||
75
Всеаминокислотыпринимаютучастиевпреобразтрехтип:трансаминированиианиях, |
|
|
|||
дезаминированиидекарбокс.Изученэтпроцихлиеобходиморованиинессовтолькодля |
|
|
|
||
понимметамболизман.нокислотя |
|
|
|
|
|
Изменениеактивностифермен,учасреакцияхвующихтрансаминирования, |
|
|
|
||
дезаминидекарнаблюдаетсябоксованпризаболелирования |
|
|
нияхпечени,сердца, |
||
скелетныхмышц,нервнсистемы.Поэтомуопределеимеетйихакт клвностинико |
|
|
|
- |
|
диагностическоезначение. |
|
|
|
|
|
Ферменты,катализирующдекарбоксилированияреакциитрансаминирован я |
|
|
|||
амин,имеютокдтожекоферментслот |
|
|
–производн оевитаминаВ |
6,который |
|
используетсявкомплекснойтерапииприлечениинарушобмаминокислотен. ий |
|
|
|
|
|
Реакциитрансаминированированияперели окислот |
Трансаминированиеаминокислот |
–этореакции |
|||
|
|
|
|||
межмолперенаминогруппыкуляртса гокисл |
|
|
отынаальфа |
-кетокислоту,в |
|
результатекоторыхизисходнойальфа |
|
-кетобразуетсякислотыноваяаминокислота,исходная |
|
||
аминокислотапревальфращ ется |
-кетокислоту. |
|
|||
Всеаминок,крометреонинализинаслоты,могутвступатьреакциитрансаминирования. |
|
|
|||
Реакциитрансаминированияявляютсяобрат,онкатализируютсямымиферментами |
|
|
|
||
аминоилитранс.Этифераминазамилокментывцитоплазмезованы |
|
|
|
|
|
митохондрияхклеток.Аминотрансферазы |
|
–этосложныеферменты,ихкофермявляетсянтом |
|
||
пиридоксальфосфат –производноевитамина |
|
В6. |
|
||
Впроцессекатализаальдеггруппапиридоксднаявначалевзаимоднйсьфосфатвуета |
|
|
|
||
альфа-аминогруписходаминок,чтпйркпоявлениюйводслотыш оснффования |
|
|
|
||
–промежуточногопродуреакции.Далеевнемтапроисходит |
|
|
перемещениедвойнойсвязи.В |
|
|
результатепослегидобразуютсяующегоролизановальфа |
|
|
-кетокислота |
||
пиридоксаминфосфат. |
|
|
|
|
|
Следующэтапреакцхарактеризуетсяперейимещениеминогруппыот |
|
|
|
||
пиридоксаминфосфатанаисходнуюальфа |
|
-кетокисл,чтопривпоятудит |
влениюновой |
||
аминокислотывновьпиридоксальфосфата. |
|
|
|
|
|
Биолрореакцийгическаяльтрансаминирования |
|
: перераспределение1) аминногоазота |
|
||
синтеззаменаминокислот; мыхисп2) льзованиебразовавшихсяальфа |
|
|
|
-кетокислотдля |
|
синтезаглюкозы,кетоновыхтел,жир |
|
ныхкислот, олест,тоестьпереключениеола |
|
||
метабпутейсолическихбмеаминокиснаобменуглевлио;пидовт 3) |
|
|
|
|
|
энергетичесблагодаряфункциядальнейшемукат льфаболизму |
|
|
-кетокислотвцикле |
||
трикарбоновыхкислот. |
|
|
|
|
|
Вклиническойпрактике |
большзначениеимеетопределеактивностиие |
|
|||
аспартатаминотрансферазы (АсАт) |
иаланинаминотрансферазы АлАт( ): |
|
|||
Аланин+ |
α-Кетоглутарат ↔Пируват+ГлутаматАлАТ) |
( |
|
||
Аспартат+ |
α-Кетоглутарат ↔Окса+ГлутаматоацетатАсАТ) ( |
|
|||
Этосвязаностем,чторазныхтканяхиорганахактивнотличаетсяьаминот.рансфераз |
|
|
|
||
АктивностьАсАТпреобладаетсердце,АлАТ |
|
|
–впечени.Посравнениюорганами |
|
|
ткактивностьнямиобоихферментовсывороткекровиочень.Одзкаяпринакорушени |
|
|
и |
||
целостностиклеточныхмембранферментывбольшихколичествахпопадаюткровь,что |
|
|
|
|
|
сопровождаетсяповышениемихактивности.Поэтоприинфармуиспользуетсяктеарда |
|
|
|
||
нарядругимис иагностическимиметодопределенактивностиАсАТ, остроме гепатите –АлАТ.Прихроническихзаболевпечениповышеанияхктивобоихнаость ферментов.
76
|
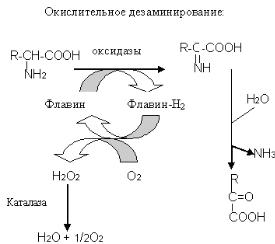
Дезаминированиеаминокислот |
Дезаминированиеаминокислот |
–этореакции,котоха акыеотщеплениемеризуютсяот |
аминокиаминогруппыввидесвободноголаммиакат.В |
отличиереакций |
трансаминирова,результатедезаминируменобщеекьшаетсияличествования |
|
амин,потомучтокислотаминогруппыаминокислотнепереносятсянаальфа |
-кетокислоту,а |
преобразуютсяваммиак. |
|
Сущнесколькопутейтвуетдезаминированияаминок |
ислот:окислительное; |
восстановительное;гидролитическвнутре;дезаминирвследстоваиенниемолекулярной |
|
|
перегрупидезампмеханиоровкинированиедег. хмудратации |
|
|
Учеловекаивысшихмлекопитающихпреокислительноебладаетдезаминирование. |
|
|
Реакциясо |
стоитиздвухэ :аповдегидр1) амиснобрвокислотыазованием |
|
неустойчивогопромежутпродуктачного |
–иминокислоты; |
|
2)взаимодействияимин ,результдойкислкототыбральфаогоазуютсяте |
- |
|
кетокислотасвободныйаммиак. |
|
|
Альфа-кетокислоты спользвбиосинтезеуглеводовются,липидовилиокисляютсяцикле |
|
|
|
||
трикарбоновыхкислот.Изаммпеченипочкахакаобразуютсямочевисоламмония, на |
|
|
|
||
соотве,ковыводятсяорыественноорганизмамочой. |
|
|
|
|
|
Реаокислительногоциидезаминиркатали вания |
|
зируютоксидазы |
L- і D-аминокислот.В |
||
тканяхиорганахприф зиологическзначенрНакт оксидазывныяхшьх |
|
|
D-аминокислот |
||
(коферментФАД)Но.вклеткахмлекопитающихнет |
|
D-амин,поэтбикислотмулогическая |
|
||
рольэтихферменепонятна.Оксидазытов |
|
L-аминокислоткофермент( ФМН)малоактивны |
|
||
приф зиологическзначенирН,таккакдлниоптяхрНравенихмум10,0. |
|
|
|
|
|
Вмитохондрияхклетокопределяетактивноферментаглутаматдегидрогеназысять,или |
|
|
|
||
оксидазы L-глутаминовойкислоти.Коферменты |
–НАДиНАДФ,опт |
имумрН |
– 7,4. |
||
Глутаматдегидрогеназа –этоолигомерферме,состоящийизсубъединицый6 .це |
|
|
|
||
олігомернийфермент,якийскладаєтьсязсубодиниць6 . |
|
|
|
|
|
Ферментактивенмультифор. мерной |
|
|
|
|
|
L-Глутамат+НАД |
+ +Н |
2О → α-Кетоглутарат+ |
NH3 НАДН++ |
+ |
|
Глутаматдегидрреакцияиграеточеньважнуюрольвзаимосвгеназнаяметаболзизма аминокислотобщегопутикатаболиз.Максиактивнэтогмаферментальнаяотмечсть ется впечени.Онаповышаетсякровиприструктурныхпораженияхгепатоцитов.
Трансдезамин(епрямоеировдезамаминокислотнированиеи )
Этопроцесс,которыйобъединяетреакциитрансаминирования,проходящиеучастием альфа-кетоглутарата,ипоследующдезаминированиеокислитгелутаматаьное.
77
1)Аминокислота+ |
α-Кетоглутарат ↔ α-Кетокислота+Глутамат; |
|
|
||||||
2)Глутамат+Н |
2ОНАД+ |
+ → α-Кетоглутарат+ |
NH3 |
+НАДН+ |
+ |
|
|||
Врезультатепервойаминотрансфере миногкциилюбыхаминокислотразной,уппыкроме |
|
|
|
|
|
|
|||
треонинализина,включаютсясоставглутамата,которыйдальнейшемподвергается |
|
|
|
|
|
|
|||
прямомуокислительдезаминированиюглутаматдегомуреакц идрогеназной |
|
|
|
|
|
|
|||
преобразуетсявальфа |
-кетоглутиамми.Образующиесявкезультатере льфакций |
|
|
|
|
- |
|||
кетокислотымогутиспользоватьсинтезеглюкожирных, ки,саменлотяаминокислотмых |
|
|
|
|
|
|
|||
либорасщеплятьсядоконечныхпродуктов |
|
|
|
–диоксиуглеродаводы,чтос провождается |
|
||||
высвобождениемэнергии. |
|
|
|
|
|
|
|
|
|
Глиикетогеогенныеаминокис.Использованиеныеуг еводородногоотыскелета |
|
|
|
|
|
|
|||
Безазотостаткиаминокислот,стыетоестьал фа |
|
аминокислот |
-кетокислоты,котообрвазуютсяые |
|
|||||
|
|
|
|
|
|
||||
результатереакцийтрансаминдезаминированияили , спользу |
|
|
|
|
|
ювтканяхсяиорганах |
|
||
по-разному. |
|
|
|
|
|
|
|
|
|
Врезультатеспецифичесдлякаждойаминокислпутейихатаборазуютсялизматы |
|
|
|
|
|
|
|||
ацетил-КоА,альфа |
-кетоглутарат,сукцинил |
-КоА,фумаратиокса.Благодаряоацетатэтим |
|
|
|||||
веществамаминокгутислотылючатьсявобщийконечны |
|
|
|
|
|
йпутькатаболизма |
–цикл |
||
трикарбкисл.Онипоновыхстепеннобудутрасщеплятьсядоуглекислогогазаводы,что |
|
|
|
|
|
|
|
||
сопровождаевысвобождениемэнергии,коаккумулитораясявидемакроэргическихуется |
|
|
|
|
|
|
|||
связейАТФ. |
|
|
|
|
|
|
|
|
|
Кромеасщепления,углеводскелетымородные |
|
|
|
гутпреобразовыватьсяглюкозу, |
гликоген, |
||||
кетоновыетела,жирныекислоты,холестерол.Взависимостиоттого,какбудетиспользоваться |
|
|
|
|
|
|
|||
углеводородскелетаминокис,ихраздеыйляютот |
|
|
|
|
глиикетогенные. |
|
|||
Гликогенныеаминокислоты |
|
включаютсябиосинтезглюкозы.Изэтихаминокислот |
|
|
|
||||
образуютсяпируват,оксалоацетат, |
|
альфа-кетоглутарат,сукцинил |
-КоА,фума.Пиируват |
|
|||||
оксалоацетатявляютсяисходнымисубстратамидля |
|
|
|
|
глюконеогенеза. |
Альфа-кетоглутарат, |
|||
сукцинил-КоАифумаратмогутмет |
|
аболизировреакцияхциклтрикарбоновыхкитьсялот |
|
|
|||||
окс,адалееоксалоацетатаиз ,благфосфоенолпдаряреакц, ируваткиназной |
|
|
|
|
|
-в |
|||
пируват,после |
чего – вглюкозу. |
|
|
|
|
|
|
||
Издвадцатиминокислотбольшинсотноситсягликогенным.Непосредственнво |
|
|
|
|
|
ов |
|||
пирувпреобразуютсяланин,серин,глицин,цистеин;воксалоацетат |
|
|
|
|
|
–аспартат;вальфа |
- |
||
кетоглутарат –глутамат,пролин,ар,гинин;стидинвсукцинил |
|
|
|
|
-КоА –валин, |
метионин, |
|||
изолейц,треонин;вфумарат |
|
|
–фенилаланинтирозин |
|
. |
|
|
||
Ккетогенным принадлежатаминокисл,углеводоскелетотпорыходныйеобразуетсяв |
|
|
|
|
|||||
ацетоацетатиацетил |
|
-КоА,изкоторыхуглнесинтезируютсяводы.Этотакиеаминокислоты |
|
|
|
|
|||
как фенилалантриптофан,тирозин, ,лейц, золизинейцин. |
|
|
|
|
|
Средиэтихшести |
|
||
аминокислоттольколе |
|
йцинлизинявляютсяисключительнокетогенными,потомучтоих |
|
|
|
|
|||
безазотистыйостатокможетнепосреобразовыватьсядственноацетоацетатиацетил |
|
|
|
|
|
-КоА. |
|||
Фен,тирозинлаланизолейцин, тр являютсяптофанодновременигликоге, ннымио |
|
|
|
|
|
|
|||
кетогенными,потому |
|
чтооднастьтомовуглеродаихмолекулможетпереходитьвпируват |
|
|
|
|
|||
(гликогеннфункция),адругая |
|
|
– вацетил |
|
-КоАкетогенная( функция). |
|
|
||
|
|
|
Глюкозо-аланциклновый |
|
|
||||
Глюкозо-аланциотражаклновыйвзаимосвязьобменомждутуглевпр( оцессыдов |
|
|
|
|
|
|
|||
гликолглюконеоген)иметзааболиминокислотр(етрансаминированиязакциимом). |
|
|
|
|
|
|
|||
Врезультатегликолизавскелетныхмышцахобразуетпируват.Онможетспользоваться |
|
|
|
|
|
|
|||
следующимобразом: окисляться1) ваэробныхуслдконечныхвияхпродуктов |
|
|
|
|
|
–диоксида |
|||
углеродаиводы,чтос провождаетсявысвобождениемэнергии; восстанавливаться2) лактат |
|
|
|
|
|
|
|||
(анаэробныйглик)споследующлизпостулактатав ленечесиминнегемьтззом |
|
|
|
|
|
|
|
||
глюкозывреакцияхглюконеогенезаглюкозо( |
|
|
|
-лактатныйцикл);врезультате3) |
|
|
|||
78
трансаминировпреобрскелетныхамышцниязовгликогеннуюываминокислотухться |
|
|
|
аланин,котораядалеепоступаетвпечень,гдеопятьврезультатетрансаминирования |
|
|
|
превпируваращаедляегоиспотвсяглюконеогенезеьзованияглюкозо( |
|
-аланц)и.клновый |
|
Синтезированнаяпечениглюкозапоступкровь,ткиорганыниет,в числеомв |
|
|
|
скелетныемышцыиголовноймозг,длядальнейшегоиспользования. |
|
|
|
|
Декарбоксиламинокированиеслот |
|
|
Декарбоксиламинокислотрование |
–этоотщеплениеаминокислоткарбоксильной |
группы |
|
ввидедиоксиуглерода.Реакцииек рбоксилированиянеобратимы. |
|
|
|
Сущчетыреразновидностиствуедекарбоксилированияакций: |
|
|
|
1) |
α-декарбоксилирование,результатекотооб биогоазуютсяамингеные |
|
|
диоксидуглерода; |
|
|
|
2) |
ω -декарбоксилирование, |
оторомучаствуютдик минокислотырбоновые; |
|
3)декарбоксилирование,связантра саминированиемое.Егопродуктамиявляются альдегиноваяами;днокислота
4)декарбовследстконсилированобразованиемолекуленсацииухие.Напр, мер
δ-аминолевулиновойкис |
лотыизглисукцинилцина |
-КоАвсинтезегема. |
|
|
|
||
Наиболеехарактернымдлячеловекаиживотныхявляется |
|
|
α-декарбоксилирование.Его |
||||
катализируютдекарбоксилазыаминокислот |
|
|
–сложныеферменты,коферментомкоторых |
|
|
|
|
являетсяпиридокс.Вовремяальфосфаткции |
|
|
междуаминокислпиридоксальфосфатомтой |
|
|||
образуетсяшиффпоследующимоснованиеразрывомсвязи |
|
|
|
“С –СООН” |
иобразованием |
||
диоксидауглерода. |
|
|
|
|
|
|
|
Пиридоксальфосфатявляетсякоферментомнетолькодек рбоксилазми,нокислот |
|
|
|
|
|||
аминотрансфераз.Типкатализи |
|
руемойре,аимкцииспецифнно,зависитот чность |
|
|
|
||
апоферментов. |
|
|
|
|
|
|
|
Декарбоксилазы L-аминокислотличаюпоабс лютнойтносительнойсясубстратной |
|
|
|
||||
специфичности. |
Глутаматдекарбоксилаза,ферментсабсолюсубстратной |
|
|
|
|||
специфичностью,катализируетобразование |
|
|
γ-аминомаслянойкислоты |
|
ГАМК( )изглутамата. |
||
ГАМКявляетсятормозныммедиатоцентральнойнервнойсистемыом. |
|
|
|
|
|
|
|
Синтез γ-аминомаслянойкислотыГАМК( ): |
|
|
|
|
|
||
α |
|
β |
γ |
γ |
β |
α |
|
H OOC — CH(NH2)— CH2— CH2—COOH %→ CH2(NH2)— CH2— CH2—COOH + CO2 |
|||||||
Специфическая гистидиндекарбоксилазакатализируетобразование |
|
гистаминаизгистидина |
|||||
вклеткахсоединткани.Г сетаминкретируетсяльнойвкровьприповрежденияхтканей |
|
|
|
|
|
||
(травмы,ожоги)Этот. биогенаминявляетсямедиаторомыйвоспаал.леОнргииия |
|
|
|
|
|
||
вызываетрасширпокраснениеесосудов,от, еккожи;стимулируетсекрец |
|
|
|
|
июслюныи |
||
желудочногосока;снижаетртериальдавление,ноповнышаетутричерепное;способствует |
|
|
|
|
|||
сокращениюгладкоймускулатулегких,чтоприводитиступамыудушья. |
|
|
|
|
|
|
|
Синтез гистамина:
Декарбоксром минокислотилазаческих |
|
катализируетдекарбоксилирование |
|
триптофана, 5 |
-окситриптофана3,4 |
-диоксифениДОФА( )В.резуэтихреакцлальт нтеийна |
|
образуютсябиогенаминые |
триптамин,серотонин(5 |
-окситриптамин),дофамин. |
|
79
Триптоблсосудосуживающимминдаетдействием.
Синтез серотонина:
Серотонин,крсосудосуживающегомедействия,являетсямедиаторомвоспаления аллергии.Вголомовнзгеномыполняетфункциютормедиатораозного.
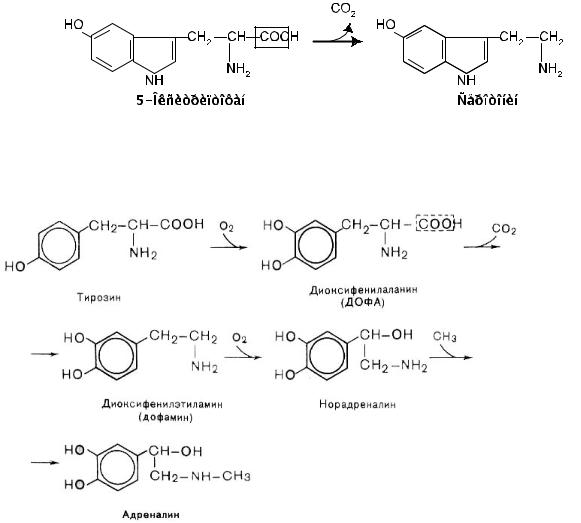
Синтез дофамнорадреналина, :
Дофамин –этонейромесреднголовногоотдеиатормозгала.Недостаточноек личество |
|
|
этогобиогенамивбазнгангогольныхмозгаияховного,кот роежетзникнутьв |
|
|
результатесниженияактивностидекарбоксароматическихам ,являетсялазынокислот |
|
|
факторомпатогенезаболезниПаркинсона. |
|
|
Дофаминявляпретсядшмедиаторанервствесистемыноникрадреналинайгормона |
|
|
мозгслнадпочечниковвогоя |
–адреналина. |
|
Аминокислотыподвекарбоксилировргаютсяподдействиембактерианиюльных |
|
|
ферменттолстогок в |
ишечникавпроцегниения.Всселедсэтогообразуютсявиеоксические |
|
аминыкадаве,путресц,агм.Кадаверинтинобразуелизина,путсяресцин |
–из |
|
орнитина,агматин |
–изаргинина. |
|
Инактивацияобезврежбиогенам ваниеновых |
|
|
1)окислительноедезаминир ованиебиогенаминовспо итохондриальныхощью ферментовмоноаминоМАО( ),коферментомявляетсяторыхксидазФАД.Оникатализируют инактивпреимуществемоноаминовалифатическихцю ,адреорадреналина, , дофамина;
2)инактивацияпреимущественно адавер,путресц,гистаминапручастии цитоплаздиаминоокДАО()атичеДляреакции. необходимысидазихатионымеди;
3) метилирадреналина,норвспомощьюдреналинаниеS |
-аденозилметіоніна(SAM). |
Ферменты - метилтрансферазы;коферменты |
–производные витамфолкиновислев тый |
В12. |
|
80
