
1 курс 1 семестр / Химия / Biochemisry.Obmen_veschestv
.pdf
Нетолькобиологическ ийкатализатор,новсещества,участвующиепротекающих клеткереакциях,имеютсвоиназвания:
Вещество,вступре,аназываетсяющеекцию субстрат,аобразующеесяврезультате реакции – продукт.
Чтобыпрохимичзошлареакция,н скаяобходимы |
следующиеусловия: |
1)запасэнергиимолекулдолженбытьненижеэ ергетическогоба еакцииьераэнергия( , обладаякото,молреойакционноспособнакула);
2)молекудолжнысблизиться.
|
|
Классификацияноменклатураферментов |
|
|
|
||
ВначалеХХв.пр называтьдложили |
|
|
ферментыпоназваниюсубстрдобавлениемта |
|
|
||
суффикса |
«-аза» ( |
amylum —амилаза, |
lipos —липаза, |
protein —протеиназа)В. 1961г.Ме |
- |
||
ждунарСоветБи дныйхимиковпредл(IUB)положитьсжилназванияову |
|
|
|
|
|
||
классификацииферментов |
типхимическойреакции |
|
. Каждоферментуприсвоен |
|
|||
четырехзклассификационныйачныйомер,включающ,подподкласс, |
|
|
|
|
|
||
порядковыйномерподподклассе. |
|
|
|
|
|
|
|
Выделяютклассов6 ферментов: |
|
|
|
|
|
|
|
Iкласс – Оксидоредуктазы |
|
|
|
|
|
||
IIкласс |
– Трансферазы |
|
|
|
|
|
|
IIIкласс |
– Гидролазы |
|
|
|
|
|
|
IVкласс |
– Лиазы |
|
|
|
|
|
|
Vкласс |
– Изомеразы |
|
|
|
|
|
|
VIкласс |
– Лигазы |
|
|
|
|
|
|
1. Оксидоредуктазы —этоферменты,катализи |
рующиеокислительно |
-восстановительные |
|
||||
реакциисучадвсутиембстрхАВ.Репраткцииосизменениемвтекают |
|
|
|
степеней |
|
||
окисленияатомов,входящихсоставреагирующихеществ |
|
|
|
|
|
||
А |
|
red. +В ox |
↔ Аox +В red |
|
|
|
|
Например:
пируват лактат
2. Трансферазы —этоферменты,катализирующиереакциимежмолпереносакулярного функциональнгруппыотличной( атомавод)ссубродайАнасубстраттратаВ:
А -Х +В <–> А +В -Х.
Например:
АТФ""+"креатин""→"АДФ"+"креатинфосфат"
3. Гидролазыэтоферменты,которрасщеплениекатализируютвнутримолекулярных связейучастиемводы.Например,
R*–COO*–СН2*–*RI**+**Н2О****→*****************R*–COOH*+*OH*–CH*6RI*
Ацетилхолин +Н 2О |
<–> Холин |
+Уксуки.слотаная |
4. Лиазы — этоферменты,отщепляющиегруппысубстратовпонегидролитическому механизмуспоследующим образдвосвйныхиланприсоединениемязейи веществпо местудвойнойсвязи.
11
R"C$–COOH$$$$$$$→$$$$$$$$$$$$$R$–C$H$O$+CO2$
5.Изомеразыкатализируютпревращеразличныхтиповоптгеометрических, я
позициизомеров,тонныхесть |
превпредращо молекулынойлахния. |
L –аминокислота→ |
D –аминокислота |
6. Лигазыкатализсоедвухмолекулинениеруют,сопряжеиспользованиемэнергииное АТФилидругихмакроэргсоединений. ч ских
COOH6CH26CH(NH2)*6COOH*+*NH3**+*ATФ***→*COOH6CH26CH(NH2)*–CONH2***+*АДФ*+*Н3*РО4***
Глютаминовая*кислота**************************************амин*глютаминовой*кислоты*
Например, |
алкогольдегидрогеназапоклассификацииферментовКФ(,ЕС), |
|
имеетномер |
|||
КФ1.это1.1.1. : |
окси,действуеторедуктазанаОН |
|
-группудонорасНАДвкачествекцептора |
|
||
спервымпорядковымномеромсвоеподподклассе. |
|
|
|
|
||
|
|
Простыеисложныеферменты |
|
|
||
Посложнстроенбелковоймолекупростыестивыдеяфермляют,состоящиенты |
|
|
|
|
||
толькоизаминокислот,сложные,имещёющиебелковыйкомпонент. |
|
холофермент.Белковыйкомпонентназывается |
|
|||
Сложныйферментназывается |
|
|
|
|||
апоферментом. Неб елкомпонентвыйимеетразличныеназвания,зависимостиотго |
|
|
||||
структуры: |
|
|
|
|
|
|
1Органический. небелковкомпонентназываетсяй |
|
|
-разависимостиномуотпрочности |
|
||
связисосвоимапоферментом: |
– простетическойгруппой |
|
|
|||
а)есливязьпрочная |
|
примером( прост |
етическойгруппы |
|||
являетсяфлавинаденинмононуклеотид,илиФАД) |
|
|
– коферментом например(, |
|||
б)еслинебелковыйкомпонентлегкодиссоциирует |
|
|
||||
никотинам,илНАД)идадениндинуклеотид |
|
|
|
|
||
Необходпомн,чтовжорганизмахтьвыхмонебелковыкомпонентамиферчащентов |
|
|
|
е |
||
всегоявляютсякоферментныеформыводорастворимыхвитаминов. |
|
|
кофактором. |
|
||
2Неорганический. небелковкомпонентназывается |
|
|
|
|||
Чащевсегоролик фактвыступаютиметалловныров( |
|
|
Mg2+, Mn2+ , Zn2+) |
|||
|
|
|
Структураферментов |
|
|
|
Белковаяприродаферментов |
|
объясняетосо иоленнкатализаторовгическихсти.В |
|
|||
отличиеобычныххимическихкатализаторов,белковыеполимерывзаимодействуют |
|
|
|
|
||
субстратомневсейповерхностью,небольшимучастком,которназактивнымваетсяй |
|
|
|
|
||
центромАЦ(). |
|
|
|
|
|
|
Активныйцентр |
фермента |
–этоуникальнаякомбинацияаминокислотных |
|
|||
оста,косвязываетсяораяковсубстратиконтросуществляетлхмируемомическую |
|
|
|
|
||
реакцию. |
|
|
|
|
|
|
Активныйцентрнаходитсяаб стчем,когдабольшинствояниифункциональных |
|
|
-, NH3+). |
|||
группаминокислот,в |
|
нёмнаходитсявдиссоциированойфоримеютзарядСОО( |
|
|||
Благэтферментодарямуобеспечиваетвысокоэффективныйислотно |
|
|
-основнойкатализ. |
|||
Активныйцентрфермеформинуровнетауетсяетичнойструктуры: |
|
|
|
|
||
аминокислотныеостатки,стоя |
щиевпервичнойполипептиднойцепидалекодруготдруга, |
|
|
|||
сближаются,образуяАЦ. Изменениестепенидиссоциациифункциональныхгрупп |
|
|
|
|
||
аминоки,входящихсоАЦс,изменениетавлотретичнойструктурыф приводитрмента |
|
|
|
|
||
разрушениюАЦпотферментативной |
|
|
актиможетвностиполинактивироватьостью |
|
||
фермент. |
|
|
|
|
|
|
|
|
|
|
|
|
12 |
Ключевыерегулятор( )фермеметаболическихнпроцессовтыыеимнтолькоют
активныйцентр,норегуляторныйцентраллостерический( )К.аллостерическому( allos –иной, другой)центферментау могутприсоедхимвеществаические.няПриэ изомьсяеняется пространсструкферм,а,тзначитяурав,енгокта,такивностькакизменяется
|
|
|
активныйцентр.Вещества,обладтакимиющие |
|
|
|
|
|
свойствами,называютэффек орами |
|
|
|
|
|
(модуляторами). |
|
|
|
|
|
Свойствафермен |
товкакхимических |
|
|
|
|
катализаторов |
||
|
|
|
1. Нерасходуютсявреакции. |
|
|
|
|
|
2. Неменяютнапреакциавлен. ие |
|
|
|
|
|
3. Невходятсоставконечныхпродуктов |
|
|
|
|
|
реакции,выходятизреакциинеизменномв. де |
|
|
|
|
|
4. Неизменяютсостояниеравновесия |
|
|
|
|
|
обреакцииатимой,толькоускоряютего |
|
|
|
|
|
наступление. |
|
|
реакции. |
|
|
5. Ускоряютлишьэнергетическивозможные |
|
|
Свойстваферментовкаккатализаторовбелковойприроды |
|
|
|||
|
|
8–1012раз). |
|||
1. Высокаямолеактивнускорятьуляфермен( онаягуреакциютыв10 |
|
|
|
||
2. Высокаяспецифичфермексубснсубс(остьовраспратнаяам |
|
|
|
ециф)ктичностьпу |
|
катализируемойреакцииреакционная( специфичность). |
|
|
|
|
|
3. Высокаячувствитферментовк специфическимльностьфизико |
|
|
-химическимфакторам |
||
среды:температуре,рН,ионнойсилераствора. |
|
|
|
|
|
4. Высокаячувствитхимическимр льностьагентам. |
|
|
|
|
|
5. Возможностьрегуляцииактивности. |
|
|
|
|
|
Приэтомвсегданеобходпомнролиакцентрамоиьвработеногофермента. |
|
|
|
|
|
|
Едизмеренияницыактивностиферментов |
|
|
||
Катал —эток личесфермента,кообеспороевопречиваетвращениемолясубстрата1 за1 |
|
|
|||
секунду. |
|
|
|
|
|
Стандартная единица(U) |
—эток |
личесфермента,копревращаетороевомкмоль1 |
|
|
|
субстратазаминуту1 , 1 Uнкаталнанокатал=( 16,67). |
|
|
|
|
|
Вмедицинеактивностьферментоввырчвсщежаютединицахгоактивностина |
|
|
|
|
|
1лбиологичежидкости. кой |
|
|
|
|
|
Удельнаяактивность |
—выража етсявединицахактивности,рассчитаннойнамг1белка. |
|
|
||
|
Влиятемпературынаактивностьиеферментов |
|
|
||
Биологкатализаческтемперамеютоптимальнуюорыдейс,козависитвияотраяу |
|
|
|
|
|
темперасреды,изковыдтоуфройеы.Напримеррментлен,для |
|
|
ферментоворганизмов |
||
теплокржи,вочистныхмвнчел,температурныйовекахоптимумсоставляет37 |
|
|
|
-38 С, |
|
длярастений – 25 С. |
|
|
|
|
|
Актхивностьмическихкатализаторовувеличиваетсяувеличениемтемпературысреды. |
|
|
|
||
Биологическиежекатализаторывбольши( |
|
|
нстве),наиболееактивнырайоне37 |
|
С,апри |
нагреваниидо80 |
-100 Сониполинактивостью.Проэтоипруютсясх,чтомудит |
|
при |
||
сильномнагр,белкифермен(вании)денатурируютсяы |
|
,разрушается4 |
-й, 3 -йи2 -йуровни |
||
структурнойорг,а,значит,изациираз |
|
|
рушаеиобразовантсяретичструктуройный |
|
|
активныйцентр. |
ВлияниерНнаактивностьферментов |
|
|
||
|
|
|
|||
ДлякаждогоферменхаракптзначениеимальноеернорНсреды,таккакрНвлияетна |
|
|
|
|
|
степеньдиссоциацииионизацфункциона |
|
льныхгруппаминокис,составлотяющих |
–NH3+ и, |
||
активныйцентрфермента.Уоднихферментактивномв центльшеб групп |
|
|
|
||
13
степеньионизацииихвысокаприреакциислойсредынапример( ,дляпепсинаоптимальный |
|
|
рН1,5),удругихфермен,на,оборотптимуов |
реакцсредывлияетнастепеньдиссоциацииионизац и |
мрНлежитвщелочнойсреде. |
Такимобразом, |
|
|
функциональгруппактивцентра,,з ,ачитнаогоакыхферментаивность |
. |
|
|
Специфферментов.Видыспецифичостьферментовости |
|
Специфичность –способн остьферментовкатализирпреодногоращениевать субстратаилигрупсходныхпостроениюсубстратов.
Выделяюттривспецифичностида.
1.Абсолютнаяспецифичность:одинферменткатализируетпревращениетолькоодн го
веществанап( ,уреазаимер |
–фе,рамент зрушающиймочевину). |
2.Относительнаягрупповая( )специфичность:ферменткатализируетоднотипные превгруппохащенияструктуреоыжихвеществна( пе, римерразрываетпсинпептидные связисамыхразличныхбелках)
3.Стереохимическаяспецифичность:ферментмож еткатализироватьпревращениетолько однизомеравеществаго.Длядругихизомтредругиеровбуютсяферментынапример( ,
образоипревращенияание |
L-и D-аминокислот). |
|
|
Специдействияфичносерментовобъясняютмодели2:модельЭ.Фишераключ« |
|
– |
|
за»имок |
дельД.Кошланда |
—модельиндуцированноговзаимодействия |
. |
СогласномоделиЭ.Фишерамежду(1890)ферменисубссуществуетратом |
|
||
пространственноесоответствиепотипуключ« |
–замок»Та. моденеаяпольучила |
|
|
экспериментальногоподтверждения.В |
соответствиимодельюД.Кошланда(1958) |
|
|
функциональныегруппыактивнцентферриентгоментатакобразоми,чтовованы |
|
|
|
отсутствиесубстратапространсструкфермистувенрыбслишьприблизительноныеаата |
|
||
соответствуютдругу.Строгаякомплемен |
тарностьвозникаеттолькопроцессе |
|
|
взаимодейферменсубрезультатестратаизмевияконенияформацииента |
|
||
субстратаиндуцированное( соответствие). |
|
|
|
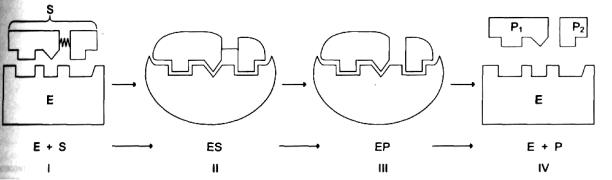
Механизмферментативногокатализа
Рис.2Этапы.2ферментативногоката |
лизавсоотвеоствиимодельюД.Кошланда |
. |
|
|||
1. |
Связываниесубстрата( |
S)сактивнымцентферм(омента |
E) |
-образованиефермент |
- |
|
субстратногокомплекса( |
ES). |
|
|
|
|
|
2. |
Внутримолекулярныеперестройкивфермент |
|
-субстратномкомплексе |
–образование |
|
|
активногофермент |
-субстратногокомплекса. |
|
|
|
||
3. |
Образованиекомплексаферм« нт |
-продукт» ( |
EP),вкоторомуменьшеносродство |
|
||
продуктаактивнопоследующимцентфе,рмсуентаотщеплениемпродукта( |
|
|
P)от |
|
||
активногоцентфе.рмента |
|
|
|
|
|
|
4. |
Выхпродреакцивногоизу тцентафервосстменаа |
|
|
ановлениеисходной |
|
|
конфео.рментаации |
|
Изоферменты |
|
|
||
|
|
|
|
|
||
Изоферметы -этомножественформыферме,каталноднутовыеитужезирующих |
|
|
|
|||
реакцию,ноотличающиесяпофизико |
|
-химичекинетическиммвойства.Этиразличия |
|
|
||
14
обусловлеразличкомбинациейаминокиойы |
слостатковтныхпервичнойструктуре |
фермента. |
|
Изоферментымогутразличаться: |
|
1)поорганлокализациин(ойаприферменты, гликолизавпеченимышцах);
2)повнутрилокализацмитохотимидин(леточн ядрайклеткиаза)н. др й
Изоферментытакжегутб |
разовыватьсяпутёмнекосвязыванияалентногоскольких |
|
|
разныхпоструктуреполипептидныхцепей,разнаякомбинациякоторыхдастразличные |
|
|
|
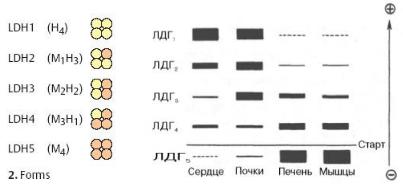
изоферменты.Так,лактатдегидрогеназаЛДГ(),состоитиз4 |
|
-хцепейдвухидов |
–НиМ.Изних |
возможнообразованиепят |
иизоферментов:Н |
4,Н 3М,Н 2М2,НМ 3,М 4.Н |
4 изоферментЛДГ |
преобладаетвмиокарде,М |
4 –впечени. |
|
|
Рис.2Изоферменты.3. лактатдегидрогеназысправа( |
–электрофорЛДГвплазмеграмма |
|
крови) |
|
|
Содержаниеизоферментныхформвплазмекровиизменяетсяпри |
заболеваниях |
|
сопровождающихсянекрозомразрушением( )клеточорганеллклетоктканиых,что |
|
|
исповкльзуетсяиническойпрактикедлядиагностики. |
|
|
Применеферментовклиническойлабориедиагностикеторной |
|
|
Внормевкрочеловекавсегдисо большойержится |
наборферментов.Любые,даж |
|
малейшие,скрытые,непроявляющиесяклинвидежалобчпациентаски,нарушения |
|
|
состоянияздоровьявсегсопровождатьбу утизменениемколиче/илиственногоя |
|
|
качественногосоставаферментовкрови.Именноп приэтпрофилакму |
тическихосмотрахв |
|
протоколахобследованобязательнымбольныхсчанализакетферментовивностися |
|
|
плазмыкрови. |
|
|
Планобследова,какихименноферментовукиянкретногопациентасоставляетлечащий |
|
|
врач.Оносновываетсязнанияхметаболизма |
|
своихпредповозможложеныхиях |
причинахнарушениясостоянияздоровья. |
|
|
Следуетпомнить,чтовсеферментыплазмкровиразделяютна: |
|
|
а)внутриклеточныелактатдег(,липаза,ам,кислдрогеназалазафосфатаза, я |
|
|
креатинфосфокиназа,аминотрансферазы); |
|
|
б) секреторныеобразуются( главнымобразомпечи екретируютсянивкровь |
|
|
(сывороточнаяхолинэст,фермсвертывающейнтысистемыразакрови); |
|
|
в)экскреторные( |
лейцинаминопептидазащелочная |
фосфатаза,которые синтезируютсяв |
печенивыделяютсяжелчью). |
|
|
Наибольшклиничзначениеимклеточныескоеютф .рментыМестомих |
|
|
функционирявляюразныеклеткиканейсяоварганизма.Вебольшихияколичествах |
|
|
клеточныеферментыприсутствуюткровикак |
|
езультатфизиологического,постоянно |
протекающегообновленияклеток.Приразличныхжезаболеваниях,сопровождающихся |
|
|
нарушениемцелостностиклеточныхмембран,значительноусилвыходклетокваетсяэтих |
|
|
ферментови,соответствен,нарастаетихконцентрацо |
ияактивность( )кро.Этоявление |
|
используютдлядиагностикиповрежденияканевыхструктур. |
|
|
Вразныхтканяхприсутствуютразныеизоформырментов.Например, |
|
|
лактатдегидрогеназавпечени,вскелетныхмышцах,всердцевдругихорганахотличается |
по |
|
15
молекулярноймассеичувствитеингибит.Следьн,определениевстиамтель о |
|
|
изофермеспектраданферментавогтнсыворокровигопозволитнеолькоке |
|
|
диагналичзаболеванияостиропределить,но ,какименнойрганповрежден |
|
|
большейс |
тепени.Именнопоэтклетоферментымучастоазываютыемаркернымиили |
|
индикатоферме( диальными,печеночнымита другими). |
|
|
Вртаследуетчамкжепомнить,чтовышениеуровняактивн( )сывороточныхсти |
|
|
ферменневсегдаотражаеттоповреждлько |
ениекл мембточных.Умеренныйаност |
|
показатможетрегистрлейприусиклероватьсяобновлениянииточногорегенерация( п сле |
|
|
повреждений),припролиферативныхпроцессахопухолевый( рост),приусилениисинтеза |
|
|
ферментов,принарушемеханизмовихвывеях |
денияизсывороткикровигиперамилаземия( |
|
принарушениифильтрующейфункцпочек),пробструкциипутейвыведениярост( |
|
|
активнщелфосчнойвсывортифатазыкровиприхолестазетке). |
|
|
Глава3РЕГУЛЯЦИЯ. АКТИВНОСТИФЕРМЕНТОВ Регуляцияактивностиферментов
Изменскоростьхимическпроцвкл ссаткогожноапутямикимих:
1.Изменениколичествасубстрата( гуляцпроницаемостимембраны)я.
2.Изменениментаколичествафере( гуляциясинтезабелков).
3.Использованиемакт ингибиторовливаторовфер. ентов
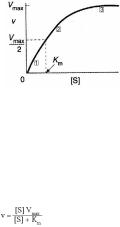
Влияниеконцентрациисубстрата
Исследованиевлияко субстратацентрацииияна |
|
|
активнферментапозволилостьмногомобъяснить |
|
|
механизмдействияфер.Припостояннойена |
|
|
концферментатрачскоростьреакциильная |
|
|
растетпропорциональноувеличен |
июконцентрации |
|
субстратареакцияпервого( порядкадлянизких |
|
|
концентсубстрата)Пвысоких. ацийконцентрациях |
|
|
скоростьреакциидо тигаетвоегомаксимального |
|
|
значения( |
Vmax)инезависитотконцентрациисубстрата |
|
(реакциянулевогопорядка)Этакривая. |
писываетсяуравнениетМихаэлиса |
-Ментен:, |
где Km-константаМихаэ,чисрлкнцентновисанасубстратая,пкоторойации
скоростьреакцииравнаполовинемаксимальной. |
|
Kmхарактеризуетсродствоферменсубстратудан .оЧемузначениеьшеК |
m,тем |
большесродствофермекдансубстратунтаиомуреакцияэффективнаужепризких |
|
концентрацияхсубстрата.ЕслиК |
mвысока,дляпротеканияреакциинеобольшиеходимы |
концентрациисубстрата. |
|
Влияактиватнскоростьиефермровеакциинтативной |
|
Активаторы –этовещества,увеличактферментовивностьающ,,следовательно,и |
|
скоростьхимическойреакции. |
|
Сущнесвидовколькотвуютактивацииферментов: |
|
1Актив. ионметаллов:циями |
|
а)металлы,встраиваяактивныйцентрфермента,сьтабилизируютего,чтоулу |
чшаетего |
работу; |
|
б)металлыобразуюткомплексысубстратом,кот связарыегутакцентромивнымься |
|
фермента. |
|
2Фосфорилир. дефосфковалентная( ванрилмодификация)ферментарование: |
|
присокфелрментудотщеплениебонениеферментаостаткафос |
форнойкислоты. |
16

3Необратимпутем. активиргидролчастванполипептиднойицепизафермента (частичныйпротеол)Напр. ,активацияхимозмер онкомрипсиногенакишечнике.
Рис.3Ак.1.тивацрипсияноге а |
|
|
|
фермеакциинтативной |
|
||
|
|
Влиянгибитнаскоростьиеров |
|
|
|||
Ингибиторы –этовещества,снижактивностьфермющиезамедляющиентов |
|
|
|||||
скоростьхимическреакц.Ингибированиеторможение(йх )бываетдвухтип:не братимоев |
|
|
|
||||
иобратимое. |
|
|
|
|
|
|
|
Необратингибиромвание |
|
проивтомслучаеходит,когдапо |
слевзаимодействия |
||||
ингибиторомсходнуюактивностьферментаневозможно |
|
|
|
восстановить. |
Поэтомупринципу |
||
созданыбоевотравляющиевещеинсектициды.тваПоступлениедаженебольших |
|
|
|
|
|||
количествтакихвеществкакинсектиц,течендлитвременидыскльного |
|
|
|
азываетсяна |
|||
жизнедеятчел,посинтезируютвкальностикановыемолфекулырментов,прис,яловии |
|
|
|
|
|||
чтонепоступитещёднаингибитоза.Этоделаетпроблемуэкологическойрачистоты |
|
|
|
||||
необычакту. айнольной |
|
|
|
|
|
|
|
|
|
|
|||||
Фермент – SH(акт.) |
+ ICH2 –COOH →HI + фермент S- CH2 –COOH(неакт) |
||||||
|
|
|
|
|
|
||
братимоеингибирование |
|
можетбыть |
неконкурентными . |
|
|||
Конкурентноеторможение |
|
возможно,когдаингибиторпохожсвоейстнауктуре |
|
||||
субстрат,иконкурируетнимзасвязьактивнымцентром. |
|
|
|
|
|
||
Взаимодействует активнымцентромтамолекула,которокажетнемуближея.Еслиэтоя |
|
|
|||||
молекулаингибито, нанекотороев блокируетемяафермент:чемсильнеесродство |
|
|
|
|
|||
ингибиторакактивнцентру,темд онмульшетамостаётся.Какпр, вилоктивнымцентром |
|
|
|
|
|||
чащесв |
язываетсятовещество,конценткотовыше. рогоация |
|
|
|
|
||
Есликонцентрацияингибиторабольшеконцентрациисубстрата([ |
|
|
I] > [S]),тореакциябудет |
||||
выглядетьтак: |
|
|
|
|
|
|
|
Эффеконкингибирурентнможетбытьснятдобавлениемваниягоизбытка |
|
|
|
|
|||
субстрата. |
|
|
|
|
|
|
|
Неконкурентныеин |
гибиторы непохструктуреожинасубстратичащевс го |
|
|
||||
связываюаллосцентфеерическимсяментаом |
|
|
|
или образуетсятройнойкомплекс |
|||
|
|
|
|
|
|
фермент-субстрат-ингибитор. |
|
|
|
|
|
|
|
Эффектингибиторовтакогонеипа |
|
|
|
|
|
|
|
можетбытьус увеличениемранён |
|
|
|
|
|
|
|
концентрациисубстрат |
а. |
Неконкурентное*торможение*
Рис.3Виды.2обратимого. ингибиферментовования
17
Торможеконечнымипродуктамиреакциииерегуляция( потипуобратнойсв) зи
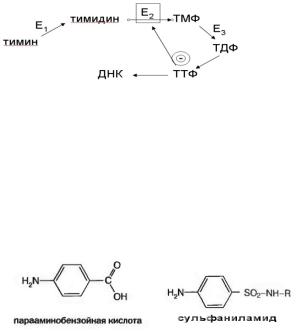
Вживоморганизмеметаболичпроцессычащвсегопредставлскиецепьюпротекающихны одназадругойреакций.Поэтомуважнесвоименнойшствомбиологическойсистемы являетсято,чток нечныепродукты,ингибируяключевойферментвсегопроцесса,могут регулисвоёобр.оватьазование
ИзбытокТТФтимидинтр( )ингибключевойфермеифосфатарует |
|
нтпроцесса |
– |
тим,итормозсинтездинкиназутемсамымсвой ДНК.Вопухолиэтотмеханизм |
|
|
|
утерян,иэтоодизпричинанерегулируемогостапухоли. |
|
|
|
Примерыиспользованияингибиторовмедицинскойпрактике |
|
|
|
Прилечениизаболеванийм кробнойэтиол |
|
огии:сульфаниламидныепрепараструктурно |
|
подобныпараамкислтормозятн ббразованиензфолкйнойи,слев тый |
|
|
|
необхдляростамикрдим.Приоотравленииорганйантэтиленгликолем(змовфр)даютзом |
|
|
|
вбольшихдозахпротивоядие |
—этиловыйспирт,иг |
рающийрольконкурентнингибитора. го |
|
Длялеченияподагрыиспользуюталлопуринол |
|
|
-необра тимыйингибиксан.тиноксидазыор |
|
Длялеченияалкоголизмаиспользуютэспер |
|
|
—необратимыйингибоксуксусноготордазы |
|
альдегида,чтормозитпревращениеальд |
|
|
егидавуксукислоту.Накапливающийсяную |
|
альдегидоказываетсильноетоксическоедействи.Прилечепандлякреатитаии |
|
|
||
предотвращенсамопереваривания« »железыприменяютконтрикал |
|
—необратимый |
||
ингибитферментовпротеолитичподжелезы.скихудочной |
|
|
||
Глава4КОФЕРМЕНТНАЯ. ФУНКЦИЯВИТАМИНОВ. |
|
|||
|
|
|
«Витаминыуказалинасвоёпр сутствие |
|
|
|
|
своимотсутствием»В.А.Энгельгардт( ). |
|
Особефункциностиферментовпределяютнирск ванияровсехститекания |
|
|
|
|
биохимичреакций,опрсостояниеделяютздоровьяких |
|
|
челов,качегожизникаство. |
|
Функциактивностьбольшинстванальнаяферментовопределяетсяихвз имодействием |
|
|
|
|
небольшимимолекулами |
–витаминами. |
Витамины – это органическиевеществаразличной |
|
|
химическприроды,поступв ргйпищейаюнизмвнебольшие |
|
|
ихколичествах |
|
необходимыедляжизнедеятчелов. ельностика |
|
|
|
|
Большойвклразвитиевитаминологиидвнес |
|
|
НиколайИвановичаЛунина |
(1853-1937). |
ПетербургскийпедиатрН.И.Лунинзанималсяразработкойсмесейдляискусственного |
|
|
|
|
вскармливанияноворожденных.Э |
|
тобылконв19,етогдакацужезнали,чтовсеорганизмы |
|
|
состоятизбелков,жиров,углеводминеральныхсолей.Этивжевещества,предполагалось, |
|
|
|
|
должнывходисоставпродуктовьпитания.Лунинпровеллаконичныеэксперименты: |
|
|
|
|
кормилмышейсмесьюэтих4 |
|
элементсоответствующихвпроп, орцияхтаковым |
|
|
материнскоммоло.Наакискусственномпитаниивсемышизаболевали.Стоиложе |
|
|
|
|
заболевшегомышонкапернастевеститвенноекармливание,каксимптомыболезни |
|
|
|
|
быстропроход.Лунпервыми(!)прнли |
|
|
едположил:вгруднмолсодержитсямещекекакой |
- |
то,неизвестныйтогданаукеэлемент.Лунинназвалегоквинтэ« »илио«ссенциейобой |
|
|
|
|
жизненнойсилой»Как.водится,коллегиосмеялисо докторскойскатеидажеляпени |
|
|
|
|
18
обвинилиегонетольконизкихкулинарн |
|
|
ыхспос,ноивпродвижениибностяхужетогда |
|
|
|
|
||
считавшейсянаучных« круга» темовитализма«льнойрии». |
|
|
|
|
|
|
|
||
Спустяочтилет30послеработН.И.Лунинаамериканецпольскогопроисхождения |
|
|
|
|
|
||||
КазимирФунк |
|
(1884-1967)выделилизрисовыхотрубейэтуквинтэссенци« |
ю»идажечастично |
||||||
расшифровалеестр.Онускт,чтоуруанэтвеществовилсодержитамин,потК.группыому |
|
|
|
|
|
||||
Функиназвалвыделенноеимвеществожизненным« амином» |
|
|
-витамином(vita |
-жизнь+ |
|||||
amine –аминогруппа). |
|
|
|
|
|
|
|
||
Мнпослеидругимигоисследователямибыл |
|
|
оустан,чтвитаминыовлпренодставляют |
|
|
|
|
||
собойгруппуразличныхводо |
|
|
-ижирорастворбиологактвеществвныхческичтомых |
|
|
|
|
||
далеконевсеонидержатаминогруппы.Темменее,терминвитамины« »оказался |
|
|
|
|
|
|
|
||
настолькозвучнымиудачным,чтоегосталиприме |
|
|
нятьковсемобнаруженвитами.А нымам |
|
|
|
|
||
таковыхужесегодняизвестноболее20. |
|
|
|
|
|
|
|
|
|
Чтожеобъедвсехэтпредставитняетхбиологактвие?вныхществчл ский |
|
|
|
|
|
|
|
||
Всеониявляются |
пищевымифакторами, |
органическимисоединениями,жизненно |
|
|
|
важными |
|||
длячеловекаочень |
|
малыхколичествахдляобеспечпротеканияэффективногореакций |
|
|
|
|
|||
метаболизма. |
|
|
|
|
|
|
|
|
|
|
«Пищевыефакторы» |
|
|
–следовательно,витаминынесинтезируютсяорганизме |
|
|
|
|
|
челоидругихвысшихекаживотных.Важноразнообрстьбалансирпитаниязногованного |
|
|
|
|
|
||||
определяется итем,чторазныепродуктыпитаниясодержатразноеколичестворазных |
|
|
|
|
|||||
витаминов. |
|
|
|
|
|
|
|
|
|
«Органическиесоединения» |
|
|
-следовательно,витаминыявляютсяпродуктом |
|
|
|
|
||
жизнедеятельностидругихпредставителейживогоорган( )м раческого |
|
|
–бактерий,растений. |
||||||
«Жизневажнно |
ые» -витаминыиспорганизмомльзуютсячеловекакачествесубстратов |
|
|
|
|
||||
длясинтеза |
|
коферментов |
–регуляторактивнмногихфермент,перенстив осчиков |
|
|
|
|
||
(«таксис»)про,электртоивновхимическонтофункцрыхвгруппиональных |
|
|
- |
||||||
ацильных,метильныхпр. |
|
|
Жирорастворимыевитаминыявляютсясубстрадлясинтомза |
|
|
|
|
||
гормоновидругихсигнальныхбиологактмолекул.вныхчески |
|
|
|
|
|
|
|
||
«Воченьмалыхколичествах» |
|
|
-следовательно,витаминынеисп рганизмомльзуются |
|
|
|
|
||
человеканикачествеисточникаэнергии(этойцельюп |
|
|
реимущественноиспользуютсяжиры |
|
|
|
|||
иуглев),нидляподыстроениясобственныхклеточныхструктурорганизмаотличие( |
|
|
|
|
|
|
|
||
белков,жиуглеводовров,витаминыневыполняютластическихфункций)Суточная. |
|
|
|
|
|
|
|
||
потребностьввитаминахдействительноничтожна |
|
|
-от5 -10мкгвитамин( D |
-кальциферол)до |
|||||
30-100мгвитамин( В |
7 илиН |
|
-биотин)Сопоставьте. сутпотребностьючнойбелках |
|
- 60-100 |
||||
г,иливуглеводах |
– |
|
|
|
|
|
|
|
|
500г. |
|
|
|
|
|
|
|
|
|
Различиявсутпотребночнойвитаминовопределяются,однтист,ихйазнойоны |
|
|
|
|
|
|
|||
рольюв |
протеканииразлбиохчныхреакцийметаболизмаических.Сдругойстороны, |
|
|
|
|
|
|||
потребнввитаминахбудутопределятьсястиособенностямифизиологическогосостояния |
|
|
|
|
|
||||
организма:возрассоо( таномошениема |
|
|
-икатаболическихреакций),состояниемздоровья |
|
|
|
|
||
(норма,бе |
ременность,периодвскармл,стадболе,выздоровливаини),физическойя ния |
|
|
|
|
||||
активн,пол. остьюм |
|
|
|
|
|
|
|
|
|
|
|
|
|
Метабвитамиорганизмелизмов |
|
|
|
|
|
1Поступление. ворганизмвсоставепродуктовпитания. |
|
|
|
|
|
|
|
||
2Всасывание. витаминовизкишечникакровь. |
|
|
|
|
|
|
|
||
3Транспорт. всвободной |
формеиливкомпсбелвтексека. мин |
|
|
|
|
||||
4Превращения. коферментныеформыучастиеметаболическихакцияхвсоставе |
|
|
|
|
|
||||
ферментов. |
|
|
|
|
|
|
|
|
|
Вздоровом,гармоническиразвивающорганпотрвитаминахзмебностимсяполностью |
|
|
|
|
|
||||
обеспеченыихпоступлениемпродуктам |
|
|
ипит.Тасостояниениякоехаракткак ризуют |
|
|
|
|
||
«нормовитаминоз». |
|
|
|
|
|
|
|
||
19
И,на,прнедотивстаточномбеспечениивитаминамиорганизмебудут |
|
|
|
|
|
|
|
||
регистнарпротеканияироватьсяушениябиохимическихреакций |
|
|
|
–нарушенияздоровья, |
|
|
|||
качестважизни.Постепенивыраженност |
|
ивитаминннедостаяточность |
|
(гиповитаминоз ) |
|||||
можетбытьумереннойбыстрая( физическаяутомляемость,сонлив,снижениекогнитивных |
|
|
|
|
|
|
|||
способнос,прочиесимплегкогонтомыдомогй)иливыркланже(иняическиной |
|
|
|
|
|
|
|
||
проявляющиесянарушенияздостро, ровьянужда |
|
|
ющиесявоказаниитерапевтических |
|
|
|
|||
мероприятий)Крайнюю. степевитаминннедостатьпринятообйкакзначатьости |
|
|
|
|
|
|
|
||
авитаминоз –состояорганизма,еслиегокорригировать |
|
|
–нелечить,способное |
|
|
||||
привестиксмертипац. ента |
|
|
|
|
|
|
|
|
|
Причиныдефв таминовциталег |
копонятьизапомнить,еслиподумать,какимобразом, |
|
|
|
|
||||
какойтраекторонидолжвконечномиитогепреывкоферментыратитьсявыполнитьсвою |
|
|
|
|
|
|
|
||
работу. |
|
|
|
|
|
|
|
|
|
Напервомместесредипричин |
|
–несбалансирпитание,недостаточноепоступлениеванное |
|
|
|
|
|||
витаминовспищей. |
Помните,витамины |
–пищевыефакторы,несинтезируютсяворганизме |
|
|
|
|
|||
человека. |
|
|
|
|
|
|
|
|
|
Другаячастаяпричинаразвитиягиповитаминозов |
|
|
–различныезаболеванияжелудочно |
|
|
- |
|||
кишечноготракта,приводящиенарушениямвсасыванвитаминов,поступающихпищейя. |
|
|
|
|
|
|
|||
На,пример |
|
патологиислизистойоболочкижелудкаснижсекрециявнутреннегоется |
|
|
|
|
|
||
фактораКастла,ч рмозитвсасываниекровьвитаминаВ |
|
|
12.Нарушаетсявсасывание |
|
|
||||
витамприусиленнойперистальтикеновразличныхотделовкишечн.На,прикамер |
|
|
|
|
|
|
|
||
длительнойдиарее, |
прид сбактериозах |
-нарушенияхмикпрофилясодержимогобного |
|
|
|
|
|||
кишечника,придлительнпримененпероральныханти,т.к.сапрофитнаябиотиковфлора |
|
|
|
|
|
|
– |
||
одинизпоставщиков« »оргачеловеканизмекоторыхвитаминов:К,Н,В |
|
|
|
|
12,фолиевой |
||||
кислоты). |
|
|
|
|
|
|
|
|
|
Гиповитаминозымогутразвиватьсяпринарушетранспортировкимехаихнизм в |
|
|
|
|
|
||||
сосудистомуруслуизкишечникаклеткам |
|
-местамметаболическогопревитаминращенияв |
|
|
|
|
|||
вкоферменты.Этапричигиповитаминозанаибоактуальнджирорастворимыхеея |
|
|
|
|
|
|
|||
витаминов,тран |
спкортребуеторыхпригидрофильныхмданиясвойствпутем |
|
|
|
|
|
|||
предваритсвязываниясоспельногоциальнымибелкамикрови.Естественно,любые |
|
|
|
|
|
|
|
||
заболевания,токсическиеповр бученижсопровождатьсяенияутнарушениямисинтеза |
|
|
|
|
|
|
|
||
этихранспортныхбелков,,сле |
|
довательно,кнарушениютранспортакровьювитаминов.И, |
|
|
|
|
|||
вконечномитоге,несмотрянадостаточноепоступлвитаминовпищейихниеэффективное |
|
|
|
|
|
|
|||
всасываниекишечнике,всеравноразвг повитаминозвается. |
|
|
|
|
|
|
|
||
Ещеоднапричинавитаминнойнедостаточности |
|
|
–на рушвреакцияхихпреобразования |
|
|
|
|||
вактивныеформы |
|
–вкофермен.Понятно,разэти ыаболическиепреобразования |
|
|
|
|
|
||
витаминовобеспечиваютсяспециальнымиферментами,тотакойгиповбудетиметьтаминоз |
|
|
|
|
|
|
|||
местопринарушенияхпроцесинтезаэтиамыхсовферм |
|
|
ентов –придефвгенетическомктах |
|
|
||||
аппаратеклеток. |
|
|
|
|
|
|
|
|
|
Говонарвушенобеспеченнявитаминамях,нельзязабыватьовозможности |
|
|
|
|
|
|
|||
развития гипервитаминозов –чрезмерновысокогонасыщенияорганизмавитаминами.Такие |
|
|
|
|
|||||
состояклиничвстррея скижчаются |
|
е,чемгиповитаминозынедлявсехвитаминов. |
|
|
|
|
|||
Описаныслучаигиперввитаминамозовпо А |
|
|
D.Причинамигипервитаминозов,как |
|
|
||||
пра,являютсяилопередозифармакопейныхепаратищевымиовкизлоуп требления |
|
|
|
|
|
|
|||
добавками.Лечениегипервитаминозовпрост |
|
ое –соответствующаякорацрекцияп .танияона |
|
|
|
|
|||
Одпринакоесвоевременнойдиагностикевозможнысмертельныеисходы,что,ксожалению, |
|
|
|
|
|
|
|||
имелоестовп слГево,рмаезультатеннойепииреализацииодуманной |
|
|
|
|
|
|
|
||
государственнпрограммыпрофилактикигиповий |
|
таминоза Dуноворожденных. |
|
|
|||||
Воснове |
классификациивитаминов |
|
лежиххимичетсвойскоетво |
–растворимость. |
|
||||
В севитамиклассифицируютна: ы |
|
В1 тиамин( |
|
В2 рибофлавин( ), |
|
В5 или |
|||
- |
водорастворимые:витамины |
-антиневритный), |
|
||||||
РР никоти( кислота,ниацин, оваяикотинамид |
|
|
-антипеллагрическй), |
В3 пантотеновая( |
|||||
кислота -антидерматитный), |
В6 пиридоксаль( ,пиридоксамин |
-антидерматитный), |
В7 |
или Н |
|||||
20
