
- •Лабораторнаяработа№1
- •Что такое гидролиз
- •Реакция образования сахаров при гидролизе растительного сырья разбавленными кислотами
- •Усредненный химический состав гидролизата:
- •Что относится к редуцирующим веществам в гидролизате.
- •На чем основан метод определения редуцирующих веществ (рв). Уравнение реакции
- •Установка для определения рв. (Описание эбулиостата)
- •Аппаратура.
- •Приготовление реактивов Фелинга.
- •Установка титра меднощелочного раствора.
- •Ход анализа
- •Лабораторнаяработа№ 2
- •Реакции образования органических кислот в гидролизате.
- •На чем основан метод определения летучих органических кислот (лок)?
- •Ход анализа.
- •7. Расчетная формула, результат анализа и расчет:
- •Результат анализа:
- •Лабораторнаяработа№ 3
- •Характеристика спирта по гост 55878-2013
- •Свойства этилового спирта
- •Применение технического спирта.
- •На чем основан метод определения
- •Ход работы.
- •Расчетная формула
- •Результат анализа
- •Лабораторнаяработа№ 4
- •Состав кормовых дрожжей
- •Применение кормовых дрожжей
- •4 На чем основан метод определения
- •5 Ход работы
- •Расчетная формула
- •Результат анализа
Лабораторнаяработа№ 2
Определениесвободныхисвязанныхлетучихорганическихкислот
Кислотный состав гидролизата. рН гидролизата.
Отбираемый гидролизат по окончании гидролиза имеет в своем составе следующие кислоты:
• Серная 0.4-0.7%
• Уроновые кислоты 0.1-0.3%
• Левулиновая кислота 0.1-0.3%
• Муравьиная кислота 0.03-0.1%
• Уксусная кислота 0.2-0.5%
• Пропионовая кислота 0.01-0.03
• Аминокислоты 0.02-0.04%
Для определения общей кислотности в гидролизатах предназначен метод, основанный на реакции нейтрализации минеральных и органических кислот едким натром до pH 5,6-5,8. Величину общей кислотности выражают в условных градусах кислотности и обозначают К ̊. 1 градус кислотности (1 К ̊) соответствует 1 мл 0,1 н NaOH, израсходованного на титрование 100 мл анализируемой жидкости.
Реакции образования органических кислот в гидролизате.
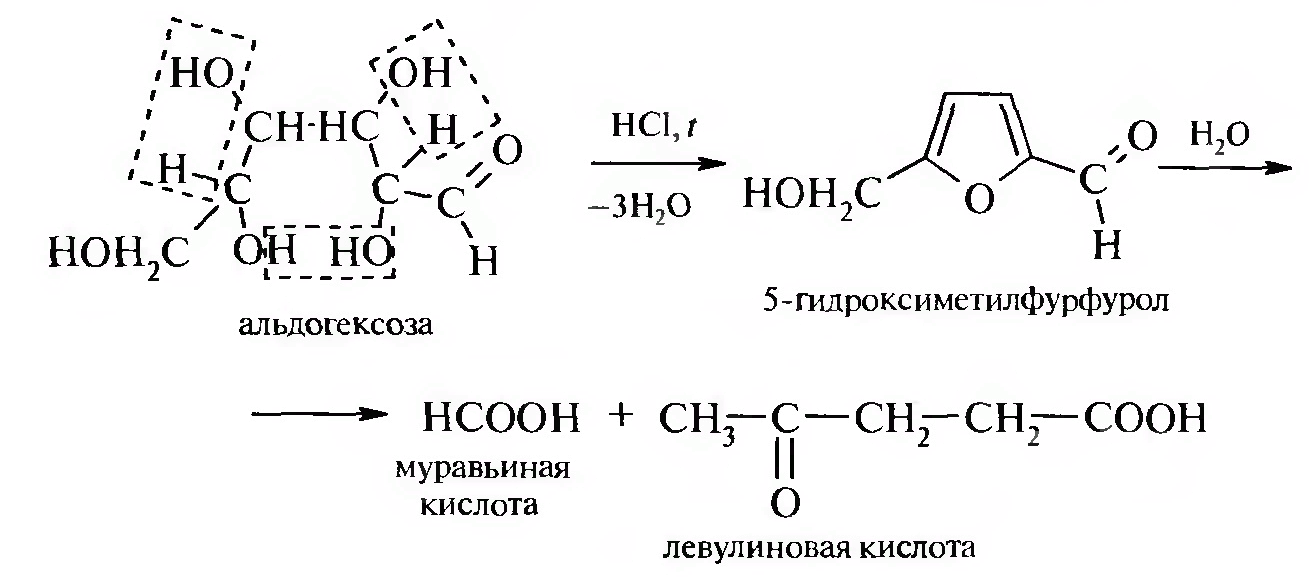
При распаде 5-гидроксиметилфурфурола в качестве основных продуктов образуются низкомолекулярные кислоты (муравьиная, левулиновая), а также высокомолекулярные продукты его поликонденсации.
На чем основан метод определения летучих органических кислот (лок)?
Для определения отдельно свободных летучих органических кислот, летучих органических кислот, связанных в соли, и суммы свободных и связанных летучих кислот, которые находятся в гидролизате, предназначен метод, основанный на реакции нейтрализации летучих органических кислот щелочью в присутствии индикатора фенолфталеина после их отгонки из анализируемого раствора. Свободные летучие кислоты отгоняют с водяным паром. Чтобы отогнать летучие органические кислоты, связанные в соли, перед отгонкой добавляют фосфорную кислоту. Соли слабых кислот вступают в обменную реакцию с фосфорной кислотой. Связанные органические кислоты становятся свободными, их отгоняют с паром и титруют.
Количество связанных кислот можно определять в отгоне титрованием или вычислять как разность между общим количеством летучих органических кислот и количеством свободных кислот. Аналогично общее количество летучих органических кислот можно определять в отгоне или вычислять как сумму свободных и связанных летучих органических кислот.
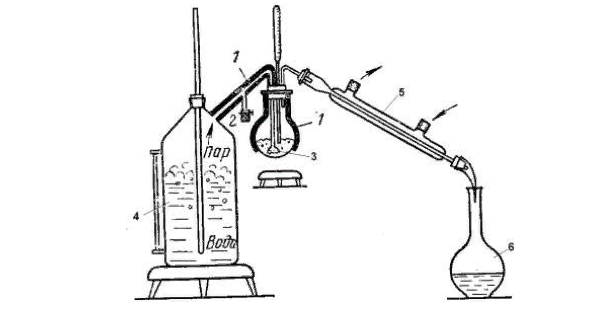
Рис. 3 Установка для отгонки летучих органических кислот с водяным паром: 1 – изоляция асбестом; 2 – зажим, 3 – барботер, 4 – паровик, 5 - холодильник, 6 – мерная колба.
Аппаратура. Установка для отгонки летучих органических кислот с водяным паром (рис. 3). Установки для титрования щелочью.
Реактивы. 1. Фосфорная кислота (Н3Р04) плотностью 1,12 г/см3. 2. Едкий натр, 0,1 н раствор. 3. Индикатор фенолфталеин, 1%-ный раствор в этиловом спирте. 4. Синие лакмусовые бумажки.
Ход анализа.
1. Определение свободных летучих кислот. Для отгонки летучих кислот из пробы в круглодонную колбу объемом 250 мл вливают 50 мл исследуемого раствора, укрепляют ее над электроплиткой и закрывают пробкой, в которую вставлены барботер, отводная трубка и капельная воронка (вместо термометра). Барботер соединяют с паровиком, но пар не пропускают, кран 2 открыт. Отводную трубку соединяют с холодильником. Для приема конденсата ставят мерную колбу вместимостью 500 мл. Когда содержимое колбы нагреется до 90–95°С (появятся первые пузырьки), закрывают кран 2 и отгоняют летучие кислоты с водяным паром. Отгонку считают законченной, когда синяя лакмусовая бумажка, смоченная каплей конденсата из холодильника, не изменит своего цвета.
Объем конденсата доводят до метки, прибавляя дистиллированную воду, перемешивают и анализируют на содержание кислот следующим образом. В коническую колбу объемом 250 мл вливают 100 мл конденсата и титруют 0,1 н раствором едкого натра в присутствии фенолфталеина до появления слабо-розовой окраски. По бюретке определяют количество раствора едкого натра, пошедшее на нейтрализацию кислот.
2. Определение связанных летучих органических кислот. После отгона свободных кислот из пробы, не разбирая установки и не отключая пара, ставят для приема конденсата другую чистую мерную колбу объемом 100 мл. В реакционную колбу через капельную воронку вливают 10 мл фосфорной кислоты плотностью 1,12 г/см3 и продолжают отгон до отрицательной реакции на кислоту по синей лакмусовой бумажке. Объем конденсата доводят до метки на колбе, прибавляя дистиллированную воду, перемешивают 100 мл конденсата и титруют 0,1 н раствором едкого натра.
3. Определение суммы свободных и связанных кислот. В реакционную колбу вливают 50 мл анализируемой жидкости, колбу включают в установку для отгонки с водяным паром, вливают через капельную воронку 10 мл фосфорной кислоты (плотность 1,12 г/см3), содержимое колбы подогревают, включают пар и ведут отгон кислот как описано выше. Собранный конденсат анализируют на содержание кислот, титруя 100 мл конденсата 0,1 н раствором едкого натра.
