shpora1
.doc|
1. Основные газовые законы. Определение молекулярных масс газообразных веществ. К
осн. газовому з. относится уравнение
состояния газа (уравнение
Менделеева-Клапейрона):
Газ, который подчиняется этому закону, называется идеальным. Закон Авогадро. В равных V-ах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул. Следствие1: одинаковое число молекул различных газов при одинаковых усл-х занимают одинаковый объем В
одном моле содержится
Для опр.отн.молекулярной массы в-ва обычно находят численно =ую ей мольную массу в-ва. Единица молекулярной массы - 1/12 часть массы молекулы углерода, условно принятой равной 12. Масса газообразных веществ опр.по з.Авогадро и уравнению Менделеева-Клапейрона. |
2. Основные стехиометрические законы. 1. З.постоянства состава: в-во имеет постоянный состав независимо от способа его получения. Пример. 2H2+O2=2H2O и 4NH3+3O2=6H2O+2N. 2. З.эквивалентов: в-ва вступают в хим. взаимодействие и замещают друг друга в соед.в весовых количествах пропорциональным хим. эквивалентам этих веществ.Хим.эквивалент - такое весовое кол-во в-ва, которое реагирует с 1.008 весовых частей H2 или 8 в.ч. О2. 3. З. простых кратных отношений: если два элемента образуют несколько соединений, то на одно и тоже весовое кол-во одного элемента приходится такие весовые кол-ва другого элемента, которые относятся между собой, как простые целые числа.Пример: H20/H2O2 , CO/CO2, N2O/NO/N2O3/NO2/N2O4/N2O5. 4. З. сохранения массы и энергии: в изолированной сист. сумма m-c и E-й постоянна. 5. З. Авогадро: в равных объемах всех газов при одинаковых давлении и температуре содержится одинаковое число молекул. В
одном моле содержится
|
3.З.хим.экв-ов. Молярные экв-ные массы сложных в-в. 3. Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов. Эквивалент – реальная или условная частица вещества, которая может замещать, присоединять или быть каким-либо другим способом эквивалентна одному иону водорода в ионнообменных реакциях или одному электрону в ОВР.
Пример.
Эквивалентная масса элемента - это масса 1 эквивалента элемента. Эквивалентная масса вещества - это масса 1 эквивалента вещества. Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты.
Пример.
Закон химических эквивалентов. Массы реаг.вещ-в пропорциональны их экв.массам. |
||
|
4. Волновые свойства электрона. Квантовые числа,s-, p-,d-,f-состояния электронов. Электронные орбитали. Атомные частицы обладают одновременно и корпускулярными, и волновыми св-ми. Луи де Бройль p=mv длина волны h/mv h-постоянная Планка 6.6 *1034 Дж*с. Волновые св-ва: дифракция и интерференция. Корпускулярные св-ва: электрон действует как частица, как единое целое. Движ.–пульсирующее. Сост.любого электрона в атоме может быть охарактеризовано набором 4 квантовых чисел: n, l, m, s.Гл.кв.ч.характеризует общий уровень эн.эл-на. Принимает знач. от 1 до 7 (соотв.буквенным обозначениям: k,l,m,n,o,p,q).Эл-е уровни подразделяются на подуровни. Эл-ны одного и того же подуровня различны по величине момента кол-ва дв-я mvr ( r – радиус орбиты).Число подуровней=числу уровн(макс.ч.подуровней–4).Побочное (орбитальное)кв.число хар-ет энергетич.сост. электрона на подуровне (l=n-1).Магн.к.ч.опр. ориентацию эл-го облака в пространстве (+3,+2,+1,0, -1, -2, -3).Спиновое к.ч. характеризует напр.вр-я электрона. (+1/2 и -1/2). Наиб.ч. эл-ов на подуровне вычисл.по формуле 2n2.макс.число – 32. Распр.эл-ов по уровням и подуровням изобр. с помощью электронных формул или ячеек. Пример: Mg-1s22s22p63s2. |
5. Принцип Паули. Емкость энергетических уровней и подуровней атомов элементов. Принцип Паули: в атоме не может быть 2 электронов с одинаковым набором всех 4 к.ч. У двух электронов могут быть попарно одинаковыми 3 числа, но они обязаны различаться по четвертому. Наибольшее
число электронов Z
в оболочке с главным квантовым числом.
Максимальное число электронов на одном уровне известных ныне электронов – 32. Ограничение принципа Паули: внешний электронный уровень атомов (кроме элемента №46 – палладий) может состоять максимум из двух подуровней – S и P. То
есть максимально возможное число
электронов на внешнем уровне отвечает
конфигурации
На s-2, на p(3орбиты)-6, на d(5орбит)-10, на f(7орбит)-14эл-ов. |
6. Связь периодич-го з. со строением эл-ных оболочек атомов. Пр. Клечковского. Энергетич. ячейки. Правило Хунда. Д. Менделеев открыл закон в 1869 году, сформулировав его: «Св-ва простых тел, а также формы и св-ва соединений элементов находятся в периодической зависимости от величины атомных весов эл-ов.»В 1869 было известно всего 63 эл-та, в наст.вр.– 109. Периодич.сист.– по сути изобр.периодич.закона. Период – послед-ть атомов с одинаковым числом эл.слоев.Электроны заполняют при застройке оболочек наиболее выгодные в эн-м отношении подуровни. 1-ое правилу Клечковского, последовательное заполнение электрон.орбиталей происходит от орбиталей с меньшим знач.суммы n+1 к большим знач.этой суммы. 2-ое правило Клечковского: при одинаковом знач.суммы заполнение происх.в напр.увелич. «n».Порядок заполнения атомных орбиталей: 1s2-2s2-2p6-3s2-3p6-4s2-3d10-4p6-5s2-4d10-5p6-6s2-5d1-4f14-5d2-10-6p6-7s2-6d1-5f14-6d2-10-7p6. Периодич.сист.полностью отражает прядок заполнения эл-ми эн.уровней атомов любых эл-ов.Правило Гунда: суммарный спин данного подуровня должен быть макс., т.е. электроны стремятся занять макс.число св.кв.сост.. |
||
|
7.Периодич.з.Д.И.Менделеева и периодич.сист. эл-ов: ряды, периоды, группы, подгруппы, порядковый номер эл-та. в 1869 сформулировав его: «Св-ва простых тел, а также формы и св-ва соед.эл-ов находятся в периодич.зависимости от величины атомных весов эл-ов.» В 1869 было известно всего 63 элемента, в настоящее время – 109. Периодич.сист.– по сути изобр.периодич.з.. В наст.вр.предложено несколько вариантов сист.,но мы рассмотрим более традиционную, предложенную Менделеевым.Она имеет 3 малых периода (1-3) и 4 больших (4-7). Период – последовательность атомов с одинаковым числом эл-ных слоев.Большие периоды содержать 2 ряда (четный и нечетный). Периоды нач-ся с активн.ме,по мере продвиж. ус-ся неметалл.св-ва, а завершаются галогеном и инертным газом.Эл-ты, которые осущ. переход от ме к неме,наз-ся переходными. Эл-ты группы проявляют одинаковую макс.валентность по кислороду, равную номеру группы.Элементы гл.подгрупп проявляют опр.валентность по водороду. В главных подгруппах по мере движ.вниз металл.св-ва усиливаются, побочных – ослабевают. |
8.Периодич.изм.св-в хим.эл-ов. Радиус атомов, ср-во к эл-ну, эн. ионизации, электроотриц-ть. Период – последовательность атомов с одинаковым числом эл-ных слоев. Большие
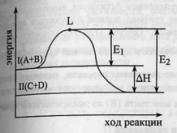
периоды содержать 2 ряда (четный и
нечетный). Периоды нач-ся с активного
ме, по мере продвижения усиливаются
неме св-ва,а завершаются галогеном и
инертным газом. Эл-ты, которые
осущ.переход от ме к неме,наз-ся
переходными.Радиус
атома
- расстояние м/у атомным ядром и самой
дальней из стабильных орбит электронов
в эл.оболочке этого атома. Увелич.с
увелич.порядкового номера элемента.
Эн.ионизации
– эн.которую необх. затратить на отрыв
электрона с нормального уровня и
удаление его на далекий уровень. Атом
при этом превращ.в положит.ион.можно
счит.мерой металличности: чем меньше
энергия, тем ярче проявляются
металлические свойства, и
наоборот.Эн.сродства
к электрону
– эн., которая выделяется при
присоед.лектрона к нейтральному
атому.Она очень мала и становится
заметной с элементов 5-й
группы.Электроотр.–эн.ионизации
+энергии сродства. Чем она больше, тем
вероятнее превращение атомов в
отрицат.ионы.
|
9.Образование химической связи. Энергия и длина связи. При взаимодействии атомов между ними может возникнуть химическая связь, приводящая к образованию молекулы/иона/кристалла. Чем прочнее связь, тем больше требуется затратить энергии на ее разрыв. При возникновении связи энергия выделяется, следовательно уменьшается потенциальная энергия системы электронов и ядер.
Потенциальная
эн. образующейся молекулы меньше
суммарной потенциальной эн.исходных
свободных атомов.Для характеристики
химической связи используются следующие
термины:Длина
связи
- межъядерное расстояние в невозбуждённой
молекуле (обычно 1-2 Ангстрема, 1А=
|
||
|
10.Ков.(атомная) св.. Метод валентных связей. Возбужденные состояния атомов. Валентность.
К.с.
возникает м/у элементами с одинаковым
или близким знач-ми эн.сродства к
электрону. Валентность атомов в
соединениях с к.св.опр.по числу
электронных пар(1пара–1ед.валентности).Для
оценки отн.зарядности элемента в
ков.соед-х (на самом деле никаких
зарядов в этих соед-х нет) прибегают
к приему: мысленно связь разорвать
,при разрыве связи в пределах периода
электрон смещается от левее стоящего
элемента к правее стоящего, а в пределах
гл.подгр.от ниже стоящему к выше.2
метода
объяснения механизма возн-ния ков.св.:
метод валентных связей (МВС) и метод
молекулярных орбиталей (МО).В основе
МВС лежит 3 положения: 1. Химическая
связь образуется двумя электронами
с противоположно направленными
спинами. При этом имеет место взаимное
перекрытие электронных орбиталей.
М/у атомами возникает зона повышенной
электронной плотности, к которой
притягиваются ядра с остальными
электронами.
2. Связь имеет ориентацию в направлении, обеспечивающем макс.возможное перекрывание орбиталей.3.Чем больше взаимное перекрывание эл-ных орбиталей, тем прочнее связь.Валентными являются неспаренные электроны. Их число можно изобр.c помощью эл-ной конфигурации атомов.При возб-и атомов (за счет притока эн.извне) имеет место «распаривание» электронов и переход электрона на более удалённый подуровень в пределах одного уровня. Распаривание одной электронной пары может увеличить валентность на 2 единицы. |
11.
Направленность ков.св.. Сигма и пи-связи.
Гибридизация атомных орбиталей.К.с.
возникает м/у элементами с одинаковым
или близким знач-м эн.сродства к
эл-ну.Перекрывание облаков при обр-нии
к.с. возможно только при опред.их
взаимной ориентации в пространстве
– отсюда направл-ть связей, приводящая
к опред. форме молекул. При этом обл.
перекрывания расп-ся опр-м обр-м по
отн-ю к взаимодейств-м атомам. 1.Молекулы
типа AA,
BB,
АВ.Характерен
для водорода, галогенов и соед.
«галоген+водород». Молекулы имеют
линейчатую структуру. Хим.св. действ.по
кратчайш.расстоянию(сигма-связь).2.Молекулы
типа A2B.Характерен
для
соед., образ-х элем-ми главной подгруппы
6-ой группы: Н2О, Н2S,H2O-валентный
угол 1050H2S-валентный
угол92033’
3.
Молекулы типаA3B.
Характерен для
соед., образ-х элем-ми гл.подгр.5-й группы
(N,
P,
As,
Sb,
Bi).Мол-ла
аммиака (NH3)
имеет форму пирамиду с треуг-м
основании.4.Молекулы
типа A4B.
Гл.подгр.4-й
гр.(Si,C,Ge,Sn,
Pb)Молекула
метана имеет форму тетраэдра (по
вершинам – атомы водорода, атом
углерода –в центре).5.
Молекулы типа AB3.Гл.подгруппа
3-ей гр.(B,Al,Ga,In,
Tl).
Мол-лаBCl3имеет
вид равностор.треуг-ка.6.Мол-лы
типа AB2.Хар-рен
для некоторых соед., образ-ми элем-ми
гл.подгруппы 2гр.. ВеCl2(линейн.структура,
угол–180).Если в мол-ле имеется кратная
связь м/у атомами (2-ная или 3-ная),то
только одна связь яв-ся
прочной-пи-связь.Остальные–сигма-связи.
Пример.Рассм.
мол-лу этилена (С2Н4).
неполная гибридизация
|
12.Ионная (электронная связь).
В
случае возникновения ионной связи
между атомами или группами атомов
преобладает электростатическое
взаимодействие. Она возникает
между атомами элементов, значительно
отличающихся по величине
электроотрицательности. Элементы, входящие в состав ионного соединения, всегда существуют в виде ионов, а не нейтральных атомов. Также нужно отметить, что полного разделения зарядов нет и имеет место частичная ковалентность.Валентность в ионных соединениях определяется по числу зарядов слагающих их ионов.Ионы проводят электр. ток в растворах и расплавах и являются проводниками второго рода.
|
||
|
13.Представление о методе молекулярных орбиталей.Основаны на том, что для каждого из электронных состояний молекулы как многоэлектронной системы полная волновая ф-ция составляется из произведений волновых ф-ций электронов (мол. орбита-лей) в соответствии с электронной конфигурацией системы, т. е. с учетом чисел заполнения (1 или 2). Числа заполнения при этом показывают, сколько электронов-один или два-занимают данную орбиталь, так что данная орбиталь входит в произведение один или два раза. Поскольку, согласно Паули принципу. полная волновая ф-ция системы электронов должна быть антисимметрична относительно перестановок индексов (номеров) электронов, ее представляют в виде определителя (или линейной комбинации неск. определителей), построенного из мол. спин-орбиталей и называемого о п р е д е л и т е л е м С л е й т е р а (Слэтера). |
14.Полярность
связи. Полярность молекул и дипольный
момент.Предположим,
что мы имеем соединение АB. Оба элемента
с большими знач-миэлектроотрицательности
(
l–плечо
диполя.Примеры полярных молекул-диполей:
|
15.Донорно-акцепторный
механизм ков.св.. Комплексные
соединения.Донорно-акцепторная
связь (ДАС) – разновидность ковалентной
связи. Выделяют соед.1-го
порядка(или
валентно-насыщенные соед.) Пример:
H2O, AgCl, NH3, HCl, KJ, CuSO4, FeCl3 и т.д. Реагируя
друг с другом дают соед.высшего
порядка (или компл.соед.).
Азот
в NH3
– донор, водород в HCl–акцептор.
Компл.соед.–соед.высшего
порядка, возн-е из соед-й1-го порядка
без образования новых электронных
пар, а за счет проявления хотя бы одной
ДАС. Предложено 2
теории возникн-я компл.соед-й.1-я–Полин–теория
вал-х св-й.
Комлексообразователь,координирующий
лиганды вокруг себя, имеет вакантные
орбитали.Т.е.образ-е компл.соед-1–результат
проявления ДАС,Вторая–Бете теория
кристаллического поля.Связь
в комплексах–электростатич-я,т.е.
взаимод. типа
«ион-ион»или«ион-диполь». |
||
|
16.Межмолекулярное взаимодействие. Водородная связь.Водородная связь наблюдается при взаимодействии атома водорода с атомами сильно электроотрицательных элементов–F,O,N,Cl,S.Природа этой связи до конца не изучена: проявление сил межмолекулярного взаимодействия, но характер сил – электростатический.В случае возникновения водородной связи водород ведет себя как двухвалентный элемент.Наличие водородных связей объясняет так называемые аномальные свойства воды:1. макс. плотность при температуре +4. 2. вода обладает наибольшей теплоемкостью из известных жидкостей.
При
нагреве воды значительная часть
энергии затрачивается на разрыв
связей, отсюда и повышенная
теплоемкость.Между молекулами в газах,
жидкостях и твердых телах действуют
одновременно силы отталкивания и
притяжения.Проявление сил отталкивания
– результат взаимодействия заполненных
электронных оболочек, эти силы действуют
на очень малых расстояниях и быстро
убывают с увеличением расстояния. |
17.Система. Фаза. Компонент. Параметры. Функции состояния: внутренняя энергия и энтальпия. Стандартные условия. Система - это тело или группа тел, находящихся в взаимодействии, которые мысленно выделены из окружающей среды. Бывают гомогенными (однородные) и гетерогенными (неоднородные). Изолированная система не имеет обмена веществом и энергией с окружающей средой. Закрытая – не имеет только массообмена. Открытая – имеет и энерго- и массообмен. Фаза - совокупность всех гомогенных частей системы, одинаковых по составу и всем физ. и хим. свойствам, не зависящим от количества вещества. Фазы отделены друг от друга поверхностями раздела, на которых все свойства фазы резко скачком меняются. Компоненты – сост-е части системы, химически индивидуальные вещества, составляющие данную систему и способные к самостоятельному существованию, будучи изолироваными от других частей системы. Состояние системы определяется набором переменных величин - параметров. Различают параметры интенсивные и экстенсивные. Интенсивные - не зависят от массы или числа частиц в-ва. (P,T), а экстенсивные - зависят (V, E).
Функции
состояния - это термодинамические
функции, значения которых зависят
только от состояния системы и не
зависят от пути по которому система
пришла в данное состояние. Изменение
функции состояния
Наиболее
важными функциями являются внутренняя
энергия
системы U и энтальпия
(теплосодержание)
Внутр. энергия – общий запас энергии : энергия поступательного и вращательного движения, энергия колебаний, внутриядерная энергия, за исключением кинетической энергии системы в целом и потенциальной энергии положения системы. Большое количество характеристик в химии зависят от условий, при которых они определяются. Наиболее общими и важными условиями являются температура и давление.
Стандартное
давление -
Стандартная температура – 298 К.
|
18.Первое начало термодинамики. Закон Гесса как следствие первого начала термодинамики. Термохимические расчеты. Существует множество формулировок первого закона:
В
изолированной
системе общий запас энергии сохраняется
постоянным.Поскольку
работа является одной из форм перехода
энергии, то, следовательно, невозможно
создание вечного двигателя первого
рода (машины, совершающей работу без
затраты энергии).Математическая
формулировка:
При протекании изохорического процесса:
При протекании изотермического процесса:
При протекании кругового процесса:
Термохимия – область физич.химии, занимающаяся изучением эн-х эффектов реакций.Если в уравнении указан ее энергетич-й эффект – это термохимическое ур-е.
V=const,
p=const,
Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции. Этот закон – прямое следствие первого закона термодинамики. С помощью закона Гесса можно вычислять теплоты различных реакций, не проводя самих реакций.
Например:
Вывод: теплота испарения одного моля воды равна 44 Дж. |
||
|
19.Стандартная энтальпия образования. Следствия из закона Гесса.Русский ученый Гесс (1840) дал формулировку основному закону термохимии: тепловой эффект реакции, протекающей при постоянном объеме или при постоянном давлении, не зависит от пути реакции (от ее промежуточных стадий), а определяется только природой и состоянием исходных веществ и продуктов реакции.Следствия из закона Гесса:1. тепловой эффект реакции равен разности между суммой теплот горения исходных веществ и суммой теплот горения продуктов реакции.Теплота горения – тепловой эффект реакции окисления данного соединения кислородом с образованием высших оксидов.Теплота образования – тепловой эффект реакции образования данного соединения из простых веществ.ю отвечающих наиболее устойчивому состоянию элементов при данных температуре и давлении. 2. тепловой эффект реакции равен разности между теплотами образования всех веществ, указанных в правой части уравнения, и теплотами образования веществ в левой части уравнения, взятых с коэффициентами перед формулами этих веществ в уравнении самой реакции.В настоящее время известны теплоты образования свыше 6000 веществ.Стандартные теплоты образования – величины теплот образования к температуре 298К и давлению 1атм. |
20.Зависимость
теплового эффекта химической реакции
от температуры (закон Кирхгофа).Температурный
коэффициент теплового эффекта процесса
равен изменению теплоемкости системы,
происходящему в результате процесса
(закон Кирхгоффа). Чтобы подсчитать тепловой эффект процесса при некоторой температуре Т2, нужно знать тепловой эффект процесса при Т1, а также характер изменения теплоемкости системы в интервале температур Т1-Т2. Обычно в роли Т1 выступает стандартная температура 298К.
|
21.Второе
начало термодинамики. Понятие об
энтропии. Расчет энтропии.Невозможен
самопроизвольный переход тепла от
менее нагретого тела более
нагретому.Невозможно
создание вечного двигателя 2го
рода(машины, которая периодически
превращает тепло среды при пост.температуре
в работу.Термодинамич-й КПД:
|
||
|
22.Объединенная
формула первого и второго начала
термодинамики. Свободная энергия
Гиббса и Гельмгольца.Первый закон.Теплота,
подведенная к системе, расходуется
на приращение внутренней энергии
системы и на работу системы над
окружающей средой. |
23.Зависимость F и G от температуры (уравнения Гиббса-Гельмгольца). |
24.Условия самопроизвольного протекания химических реакций.В химических системах вещества стремятся к минимуму внутренней энергии. Экзотермические реакции протекают самопроизвольно, так как вещества при их окончании достигают свой минимум внутренней энергии. Но также самопроизвольно протекают и эндотермические реакции - это растворение солей.Макросостояние системы тем более вероятно, чем большим числом микросостояний оно может быть описано.Условия самопроизвольного протекания реакций: 1. стремление системы к достижению минимального значения внутренней энергии 2. стремление системы к более вероятному своему состоянию.Но часто происходит столкновение этих двух определяющих факторов , и возникает состояние называемое химическим равновесием. Функция, которая учитывает оба этих фактора – энергия Гиббса.Самопроизвольно протекают те процессы , энергия Гиббса которых равна отрицательному значению.Если температура мала , то энтальпия равна энергии Гиббса и самопроизвольно протекают экзотермические реакции.Если высокая температура , то отрицательное значение имеет энергия Гиббса и реакции протекают самопроизвольно. Необратимые реакции протекают до полного израсходования одного из реагентов. Обратимые протекают во взаимопротивоположных направлениях .В состоянии химического равновесия система достигает своего минимального значения энергии и энергия Гиббса, как и константа химического равновесия, равна нулю.
|
||
|
25.Изотерма химической реакции. Стандартное изменение свободной энергии.
|
26.Константа
химического равновесия. Расчет Кр,
Кс, КмРассмотрим
гомогенную хим.р-ю: |
27.Зависимость константы химического равновесия от температуры (изобара и изохора химической реакции).
|
||
|
28.Принцип
Ле-Шателье.При
неизменных условиях химическое
равновесие в системе может сохраняться
сколь угодно долго. В случае же изменения
условий (концентрация, температура,
давление) одна из противоположно
направленных реакций может ускориться,
чем другая. После этого равновесие
сместится, и установится новое состояние
равновесия.Принцип
Ле-Шателье: если
на систему, находящуюся в истинном
химическом равновесии, оказывают
воздействие извне путем изменения
какого-либо из условий, определяющих
положение равновесия, то оно смещается
в направлении той реакции, протекание
которой ослабляет эффект произведенного
воздействия.1.
Влияние температуры.Повышение
температуры смещает равновесие в
сторону процесса, идущего с поглощением
тепла. |
29.Скорость
химической реакции. Закон действующих
масс. Константа скорости.Скорость
гомогенной
(однофазной) реакции зависит от природы
реагирующих веществ, их концентрации
и температуры.Скорость гетерогенных
(многофазных) процессов зависят от
размеров и состояния поверхности
раздела фаз.Примечание.
Гетерогенные – процессы, происходящие
на поверхности раздела соприкасающихся
фаз. (горение топлива, окисление
металлом кислородом воздуха).Закон
действующих масс.Справедлив
для гомогенных реакций.Формулировка:
при
постоянной температуре скорость
химической реакции пропорциональна
произведению концентраций реагирующих
веществ.Константа скорости обозначается
как
|
30.Молекулярность
и порядок реакции.Реакции
с точки зрения частиц классифицируются
по признаку молекулярности
или по признаку порядка
последних.Молекулярность определяется
по числу молекул, одновременное
соударение которых приводит к
химическому воздействию.Одномолекулярная
реакция.
Трехмолекулярная
реакция.
Порядок
реакции =сумме показателей степеней
у концентраций в уравнении, выражающем
зависимость скорости реакции от
концентраций реагирующих веществ.Реакция
|
||
|
31.Кинетическая
классификация по степени сложности.
Обратимые и необратимые реакции.По
степени сложности реакции подразделяются
на изолированные, параллельные,
сопряженные, последовательные
(многоступенчатые), обратимые и
необратимые.Изолированные
– при их протекании образуются продукты
только одного типа.Параллельные
– в ходе них взятые вещества одновременно
реагируют в двух или более направлениях
(образуются разные продукты).Пример.
Разложение бертолетовой соли
|
|
33.Энергия
активации химической реакции.
Аналитический и графический метод
расчета.С
ростом температуры происходит
перераспределение энергии между
молекулами так, что резко возрастает
число активных молекул, облаающих
некоторым избытком энергии (энергией
активации). Большая часть поступающей
в систему энергии тратится на ослабление
внутримолекулярных связей, что и
делает молекулы активными.С.
Аррениус
установил опытным путем зависимость:
|
||
|
34.Ск-ть
гетерогенной хим.реакции. Особенности
ее протекания.Гетерогенные
(многофазные) реакции происходят на
поверх-ти раздела соприкасающихся
фаз. относятся: горение топлива,
окисление металлов кислородом,
растворение газа в жидкостях.Ск-ть
реакций зависит от размеров и состояния
поверхности раздела фаз. Гетерогенные
процессы многостадийны. Кроме осн-го
процесса,обязательны стадии подвода
к этой поверх-ти исходных веществ и
отвода от нее продуктов реакции.Если
определяющей стадией является
хим.реакция на поверхности раздела
фаз, то процесс описывается законами
хим.кинетики
Если, как это обычно бывает, наиболее
медленно совершается подвод и отвод,
то процесс описывается законами
диффузии
. Повышение темп-ры на каждые 100
увеличивает коэффициент диффузии на
20%, тогда как скорость реакции
увеличивается в 2-4 раза.Диффузия
оказывает большое влияние на протекание
гетерогенных процессов.1й
закон диффузии.Масса
веществ
Ур-е
стационарной диффузии:
|
35.Инициирование
химической реакции. Катализ. Сущность
гомогенного и гетерогенного катализа.
Инициирование-наиб.энергоемкая
стадия цепной реакции,ее эн.ативации
опрэнергией разрываемой хим.св..
Катализ-Изменение
скорости реакции под действием
некоторых веществ (катализаторов)
Различают положит.катализ и антикатализ.
При катализе ск-ть реакции увелич-ся,
при антикатализе - уменьшается.
Вещества, увеличивающие скорость
реакции-катализаторы,уменьшающ.-
ингибиторы.
Как правило катализатор при реакции
не расходуется, ингибитор
расходуется.Существует также и
автокатализ
- в роли катализатора вытсупают продукты
реакции.Пример: FeO+H2=Fe+H2O
Катализаторы
не
влияют
на |
36.Дисперсные системы. Коллоидные растворы.Д.с.Это система из двух и более в-в,которые практически не смешиваются и не реагируют друг с другом. Состоят из двух и более фаз(тел)с сильно развитой поверхностью раздела.в грубодисперсных системах частицы имеют размер от 10-4и выше,в коллоидных системах от 10-7 до 10-5-10-4. Дисп.сист.: эмульсии(масло в воде), сустензии(глина в воде),коллоидные растворы. Коллоидные растворы -высокодисперсные системы частицы интенсивно участвуют в броуновском движении,заполняя вечь объем дисперсной системы. Коллоидные частицы способны рассеивать свет. |
||