
Биохимические методы исследования в медицине
.pdf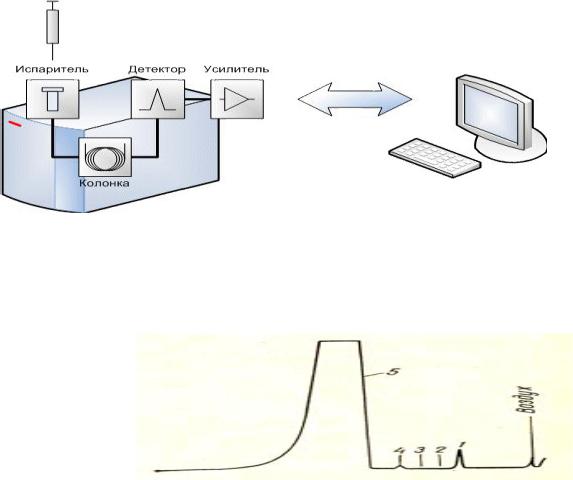
Газо –жидкостная хроматография (ГЖХ)
ГЖХ основана на физико-химическом разделении анализируемых компонентов, находящихся в газовой фазе. Разделение анализируемых веществ происходит в колонках (трубках), наполненных твердым пористым сорбентом. Пары анализируемых веществ, смешанные с газом-носителем, азотом или аргоном, движутся через колонку. Метод позволяет разделить и количественно определить вещества в сложной смеси даже в тех случаях, когда они сходны по химическим свойствам, а температуры кипения различаются на десятые доли градуса. Для анализа требуются очень малые количества вещества, а время определения обычно исчисляется минутами. Для каждого вещества в смеси определяют с помощью веществ – свидетелей время достижения детектора - «время выхода». На приборе записывается график, площадь пика соответствует содержанию вещества в пробе (рис.9).
Рис.9. Схема действия прибора ГЖХ
. На рис. 10 представлен анализ паров хлороформа, обнаруженных в нем примесей.
.
Рис.10. Типичная газовая хроматограмма хлороформа.
1 - н-гептан; 2 - метиленхлорид; 3 - 1,1 дихлорэтан; 4 - четыреххлористый углерод; 5 – хлороформ
11
Применение ГЖХ. Используется во многих областях медицины:
●в гигиене и экологии для определения содержания вредных примесей в воздухе, воде и пищевых продуктах; ●в токсикологии и судебной медицине для диагностики отравлений
техническими жидкостями (хлорпроизводными углеводородов, алкоголем и его суррогатами) и пестицидами самой различной структуры; ●в фармакологии и фармации для контроля качества препаратов,исследования метаболизма лекарственных средств,
● в клинической медицине при проведении бактериологических исследований, составлении метаболического профиля пациента
Микробные клетки в процессе метаболизма производят низшие карбоновые кислоты, набор кислот является «визитной карточкой» того или иного микроорганизма. Обычно баканализ занимает несколько суток. С помощью ГЖХможно проводить ускоренную (менее двух часов) идентификацию микроорганизмов по спектру специфических компонентов их мембран или специфическим продуктам пиролиза. Газохроматографическое определение спектра карбоновых кислот цикла Кребса внесло большой вклад в понимание интимных процессов внутриклеточного метаболизма при различных патологических состояниях. Методом ГЖХ определяют увеличение содержания ацетона, гептанона-2 и других кетонов при сахарном диабете.
Диагностическим показателем цирроза печени служат ароматические кислоты, Накопление фенилуксусной кислоты свидетельствует о некоторых заболеваниях нервной системы.
Для контроля состояния ожоговых больных определяют производные углеводов - маннитол и лактулозу
4. Метод электрофореза
Электрофорезом называют движение заряженных частиц в растворе под действием электрического поля. Электрофоретический метод в биохимии - это способ разделения молеку, имеющих разный заряд. путем помещения их в электрическое поле. Раствор белков наносят на бумагу. пластинку, обрабатывают растворителем с определенной величиной рН, подключают к полюсам. В поле постоянного электрического поля начинается движение белков, образуются отдельные зоны. В результате разделение фиксируется с помощью электрофореграммы, которая по внешнему виду не отличается от пластинки при хроматографии (рис11)..
12
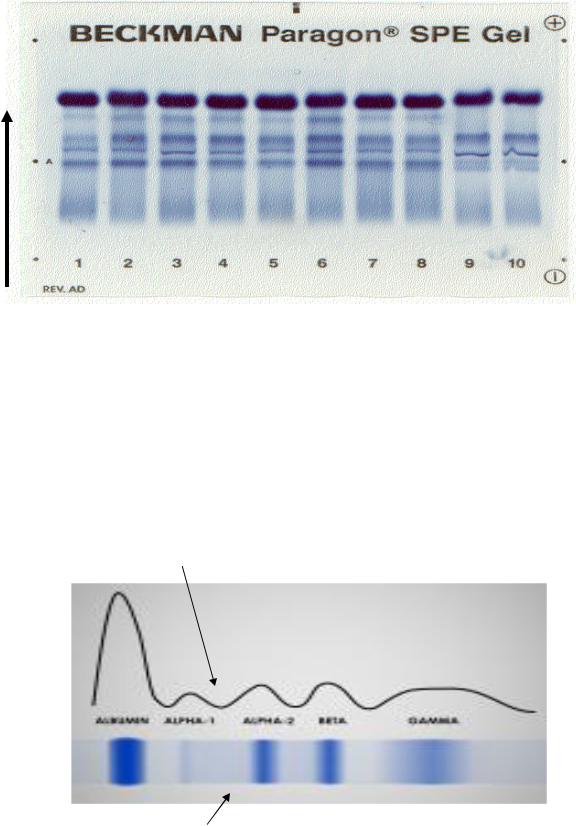
Рис. 11. Электрофореграмм 10 различных образцов. Стрелка указывает движение от линии старта к финишу.
В современном приборе совмещены технологии электрофореза, оптическая денситометрия, позволяющая определить содержание разных белков в крови. На рис 12 можно увидеть электрофорерамму обоазца, кривую денситометрии и ее изображение на экране прибора. Врач получает распечатку результатов исследования (табл. 2, 3).
Кривая денситометрии
Электрофореграмма белков крови ( раэделение смеси белков на фракции)
13
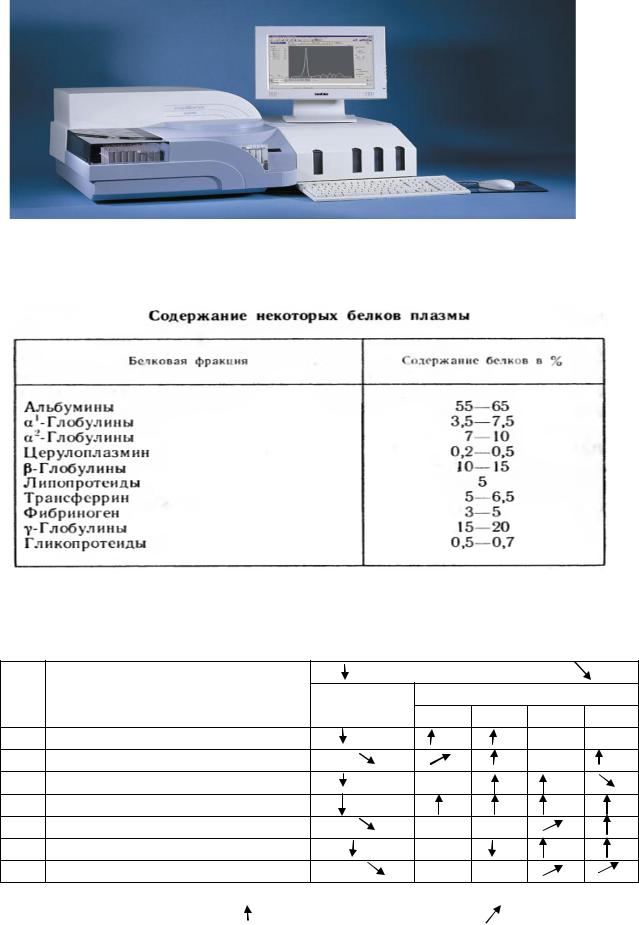
Рис.12. Современный прибор для проведения электрофореза
Таблица 2. Референсные значения содержания белков плазмы
Таблица 3. Изменения соотношения белков (диспротеинемии) при различных |
||||||||||
заболеваниях |
(https://yandex.ru/images/search?text) |
|
|
|
|
|
||||
№ |
Протеинограмма |
|
Фракции белков, изменение |
|
|
|||||
№ |
соответствует состоянию |
|
Альбумин |
Глобулины |
|
|
||||
|
|
|
|
|
|
а1 |
а2 |
β |
|
γ |
1 |
Острое воспаление |
|
|
|
|
|
- |
|
- |
|
2 |
Хроническое воспаление |
|
|
|
|
|
- |
|
|
|
3 |
Патология почек |
|
|
|
- |
|
|
|
|
|
4 |
Злокачественное образование |
|
|
|
|
|
|
|||
5 |
Гепатит |
|
|
|
|
- |
- |
|
|
|
6 |
Цирроз печени |
|
|
|
- |
|
|
|
|
|
7 |
Обтурационная желтуха |
|
|
|
- |
- |
|
|
|
|
Примечание |
- значительное снижение ( |
); умеренное снижение |
( |
) : |
||||||
значительное |
повышение ( |
); |
умеренное повышение ( |
); |
|
|
||||
нормальное значение (-). |
|
|
|
|
|
|
|
|
||
|
|
|
|
14 |
|
|
|
|
|
|
5. Иммуноферментный анализ (ИФА)
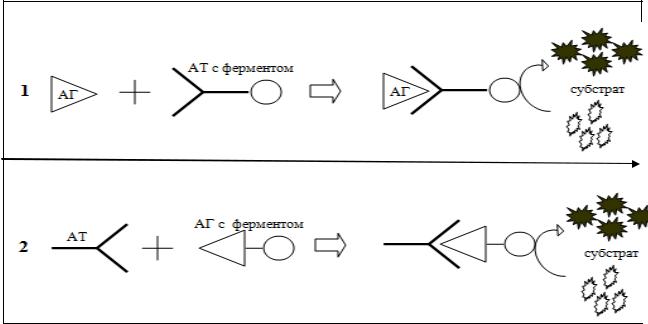
Иммуноферментный анализ (метод) — выявление антигенов с помощью соответствующих им антител. Антитела конъюгированы (связаны) с ферментом - меткой (пероксидазой, бета-галактозидазой или щелочной фосфатазой). Конъюгированные антитела содержатся в иммунной сыворотке. После соединения антигена с антителом, присутстующим в иммунной сыворотке, в смесь добавляют субстрат/хромоген. Фермент реагирует с субстратом, изменяется цвет продукта реакции — интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. Можно изменить методику, и пометить ферментом не антитело, а антиген (см. рис 13).Распространен твердофазный ИФА. Один из компонентов иммунной реакции (антиген или антитело) сорбирован на твердом носителе, напр., в лунках планшеток из полистирола. Компоненты выявляют добавлением меченых антител или антигенов. При положительном результате изменяется цвет хромогена. Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем промывания.
1) Для выявления антигенов 2) Для выявления антител Рис.13 . Основной принцип ИФА.
1.ИФА применяют для диагностики:
●вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекций, гепатита В, ●определения гормонов, ферментов, лекарственных препаратов и других
15
биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях (1010-1012 г/л).
6. Оптические методы исследования
Большинство клинических лабораторных методов исследования основаны на оптических методах.
Оптические методы исследования классифицируют в нескольких направлениях.
1.Классификация по объектам исследования Методы исследования биопробы и жидкости
Методы, предназначенные для исследования организма 2.По спектральным характеристикам оптического излучения
Фотометрические
Спектрофотометрические 3. По виду взаимодействия веществс излучением
Адсорбционная фотометрия Люминесцентная фотометрия Эмиссионная фотометрия Нефелометрия
Фотоколориметрия и спектрофотометрия основаны на молекулярно-
абсорбционном спектральном анализе, используют измерение ослабления светового потока, происходящего вследствие избирательного поглощения света анализируемым веществом (системой).
В основе люминесцентного анализа лежит зависимость интенсивности свечения вещества при поглощении внешней энергии, вследствие этого возниают вторичное излучение - флуоресценция, хемилюминесценция,
Рефрактометрический анализ основан на зависимости показателя преломления света от природы и концентрации вещества.
.
Спектроскопические методы анализа
В основе лежит способность атомов и молекул вещества испускать, поглощать или рассеивать электромагнитное излучение. Изменение взаимодействия света с веществом связано с качественным и количественным составом вещества.
Оптический диапазон шкалы электромагнитных волн включает излучение в интервале длин волн от 400 до 1100 нм.
Этот интервал разделяют на три области длин волн (см. табл.).
16

Область спектра |
Длина волны λ.нм |
Ультрафиолетовая (УФ), |
200÷400 |
Видимая |
400÷760 |
Инфракрасная |
760÷1100 |
Абсорбционный метод основан на измерении ослабления мощности (интенсивности) потока излучения при прохождении его через поглощающую среду. При прохождении монохроматического (одной длины волны) излучения через раствор , происходит ослабление потока излучения в связи с поглощением энергии частицами данного вещества. Понижение интенсивности подчиняется объединённому закону Бугера- Ламберта-Бера, согласно которому интенсивность излучения при прохождении через вещество уменьшается в степенной зависимости от концентрации «c» и величины слоя вещества «l»:
I=I0•10-ε lc
I0- интенсивность падающего излучения,
I- интенсивность прошедшего излучения,
ε- молярный коэффициент поглощения, характерный для данного вещества, зависит от длины волны, температуры, давления.
Величина I/I0 = 10-εlc называется пропусканием Т, характеризует выраженную в процентах часть излучения, прошедшую через раствор, Мера непрозрачности слоя вещества для световых лучей обозначается как оптическая плотность D (D= ε lc ) = lg (I/I0),
.Для определения концентрации вещества ( с х) в исследуемом растворе необходимо иметь стандартный раствор (сст) с известной концентрацией (раствор сравнения).
с х = с ст • Dх/ Dст
17

Рис. https://yandex.ru/images/search?img_
18

Приложение
Цвет определяется воздействием на зрительный аппарат всех световых лучей видимого участка спектра за вычетом поглощенных. Этот цвет называют дополнительным к спектральному. Если избирательно поглощаются световые лучи, имеющие максимальное поглощение при λ = 400-435 нм, соответствующие спектральному фиолетовому цвету, то тело имеет зеленовато-жёлтый дополнительный цвет если λ = 435-480 нм - жёлтый
и далее – оранжевый, красный, пурпурный, фиолетовый, синий, зеленоватосиний, синевато-зелёный, зелёный.
Если λ<400 нм, т.е. поглощение происходит в УФ-области спектра, тело кажется бесцветным.
При λ> 760 нм поглощение происходит в ИК-области, и тело также кажется бесцветным.
Цветовая таблица
УФ - спектры коферментов НАД+ и НАДН
19
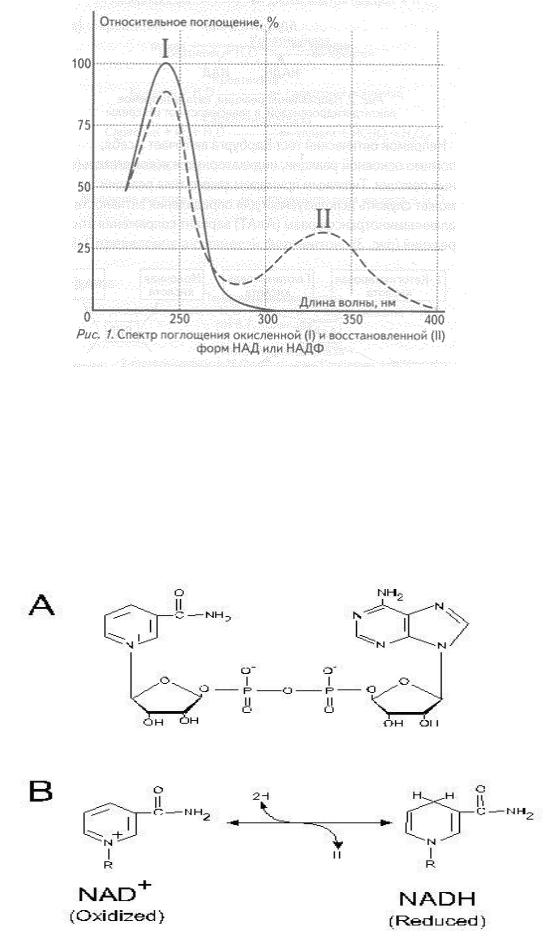
https://yandex.ru
Отличия в оптической плотности на длине волны 340 нм позволяет определить изменение (увеличение/ уменьшение ) концентрации НАДН в процессе реакции, оценить активность фермента, изучить кинетику ферментативной реакции.
20
