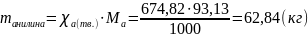Задачи Крюкова / Растворы электролитов 8
.docxЗадание 1. Раствор HCl имеет ионную силу 0,24 моль/кг. Вычислите ионные силы растворов CuSO4 и H2SO4 c такой же концентрацией.
Решение:
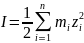
Найдём m:
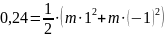
Откуда
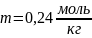
Теперь вычислим ионные силы растворов CuSO4 и H2SO4:
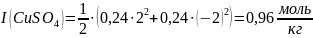
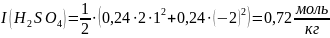
Ответ:
I(CuSO4) = 0,96
 ; I(H2SO4)
= 0,72
; I(H2SO4)
= 0,72
Задание 2
Константа диссоциации уксусной кислоты равна в воде при 298 К равна 1,75∙10-5. Чему будут равны концентрация ионов гидроксония и рН раствора, если к одному литру 1 М раствора уксусной кислоты добавить 8,2 г ацетата натрия. Раствор считайте идеальным, изменением объема при добавлении ацетата натрия можно пренебречь.
Решение:
Диссоциация уксусной кислоты выглядит следующим образом:
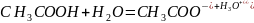
При смешивании уксусной кислоты и ацетата натрия образуется буферный раствор.
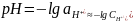
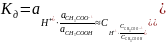
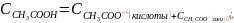
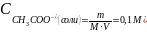
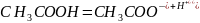
1 0 0
α α α
1- α α α
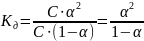
Отсюда
,
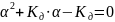
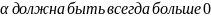 ,
поэтому
,
поэтому
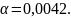 Этим можно пренебречь
Этим можно пренебречь
Учитывая всё выше описанное , найдём pH:
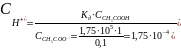
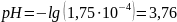
Ответ: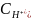 =
=
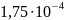 ;
;
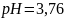
Задание 3.
Твёрдая фаза какого состава и в каком количестве (в кг) выкристаллизуется при охлаждении раствора фенол-анилин массой 70 кг, содержащего 80 мол.% анилина, от 300 до 270оС? Какой состав будет иметь раствор при конечной температуре? Изобразите схематично кривые охлаждения растворов следующего состава: 21% анилина (эвтектика), 40% анилина, 100% фенола.
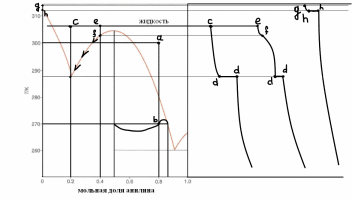
Первая фигуративная точка (а) находится в области жидкого расплава анилина с фенолом. Вторая фигуративная точка (b) , полученная пересечением изотермы T=270K с линией , проведённой из оси составов с массовой долей анилина 80% . Она расположена в гетерогенной области , состоящей из кристаллов и жидкого расплава соединения, полученного из фенола и анилина.
Выкристаллизуется соединение анилина и фенола по правилу рычага:
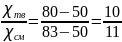
Рассчитаем среднюю молярную массу смеси:
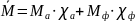 , где
, где
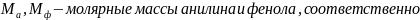 ;
;
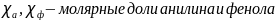 .
.
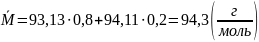
Общее количество молей смеси:
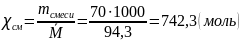
В таком случае количество выкристаллизовавшихся молей анилина:
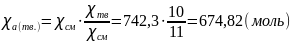
Откуда,
масса выкристаллизовавшегося анилина