
Задачи Крюкова / Растворы электролитов 7
.docxЗадача 1.
В 100 г воды содержится 0,05 моль MgSO4, 0,01 моль AlCl3, 0,02 моль (NH4)2SO4. Рассчитайте ионную силу этого раствора.
Дано:
m(MgSO4)=0,05 моль/г=0,005 моль/кг
m(AlCl3)=0,01 моль/г=0,001 моль/кг
m((NH4)2SO4)=0,02 моль/г=0,002 моль/кг
Решение:
Ионная сила раствора рассчитывается по формуле:
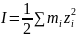
где mi – моляльность, а zi – заряд иона.
Подставим значения:
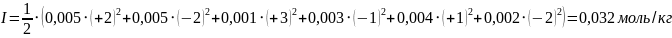
Ответ: 0,032 моль/кг.
Задача 2.
Рассчитайте среднеионные коэффициенты активности для водных растворов NaCl при температуре 25оС при моляльностях: 0,001; 0,002; 0,005; 0,01; 0,02 моль/кг. Экспериментальные данные: 0,9649; 0,9519; 0,9275; 0,9024; 0,8712. Графически подтвердите применимость предельного закона Дебая-Хюккеля для данной задачи.
Дано:Xm, моль/кг |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
γ+-эксп |
0,9649 |
0,9519 |
0,9275 |
0,9024 |
0,8712 |
t=25ºC
Решение:
Ионная сила раствора рассчитывается по формуле:
где mi – моляльность, а zi – заряд иона.
Подставим значения для каждого случая:
m, моль/кг |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
I, m |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
Рассчитаем логарифм коэффициента активности и сам коэффициент активности по формулам:
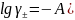 ,
где А25º=0,509;
,
где А25º=0,509;
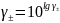
m, моль/кг |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
I, m |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
lgγ+- |
-0,0161 |
-0,02276 |
-0,03599 |
-0,0509 |
-0,07198 |
γ+-расчет |
0,963616 |
0,948936 |
0,920467 |
0,889406 |
0,84726 |
Сравним данные полученные расчетным методом с данными эксперимента и построим их графики:
m, моль/кг |
0,001 |
0,002 |
0,005 |
0,01 |
0,02 |
γ+-эксп |
0,9649 |
0,9519 |
0,9275 |
0,9024 |
0,8712 |
γ+-расчет |
0,963616 |
0,948936 |
0,920467 |
0,889406 |
0,84726 |
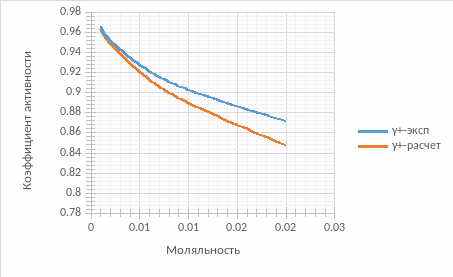
По графику видно, что значения приблизительно совпадают. Причем при меньших значениях моляльности первое приближение Дебая-Хюккеля дает меньшую погрешность, но при росте концентрации отклонения возрастают.
Задача 3.
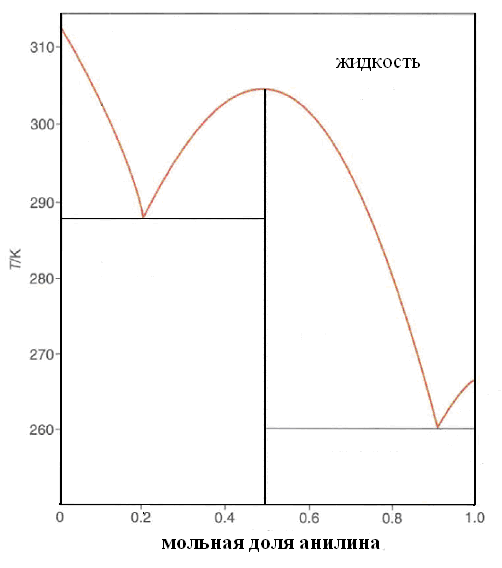 Твёрдая
фаза какого состава и в каком количестве
(в кг) выкристаллизуется при охлаждении
раствора фенол-анилин массой 10 кг,
содержащего 70 мол.% фенола, от 310 до 290
оС? Какой состав будет иметь
раствор при конечной температуре?
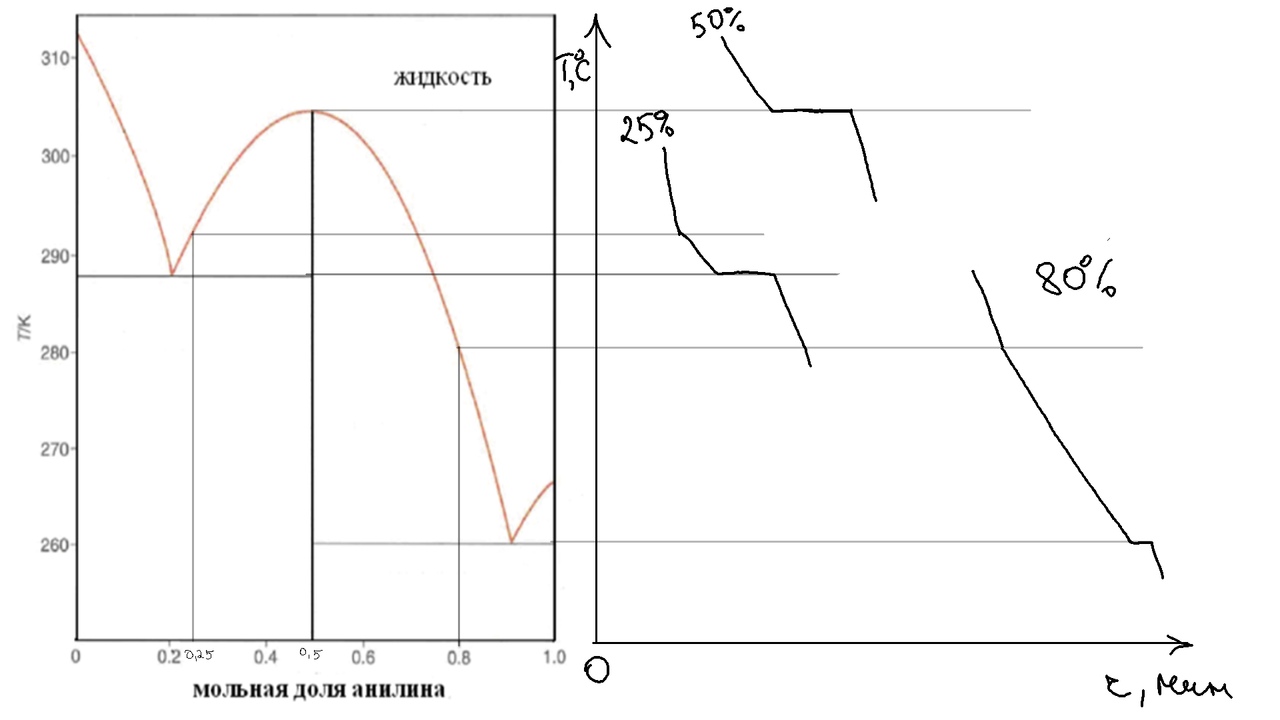
Изобразите схематично кривые охлаждения
растворов следующего состава: 25% анилина,
50% анилина, 20% фенола.
Твёрдая
фаза какого состава и в каком количестве
(в кг) выкристаллизуется при охлаждении
раствора фенол-анилин массой 10 кг,
содержащего 70 мол.% фенола, от 310 до 290
оС? Какой состав будет иметь
раствор при конечной температуре?
Изобразите схематично кривые охлаждения
растворов следующего состава: 25% анилина,
50% анилина, 20% фенола.
Дано:
m=10 кг
х(фенол)=70%
t1=310ºC
t2=290ºC
Решение:
При охлаждении жидкости с составом 30% анилина-70% фенола до точки С, система свой состав не меняет. В точке С начинается выпадение кристаллов состава 50% анилина-50% фенола. В точке D система будет состоять из жидкой и кристаллической фаз.
Состав можно рассчитать, применив правило рычага:
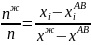
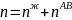
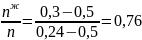
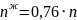
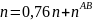
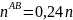
Молярная масса смеси рассчитывается по формуле:
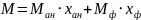
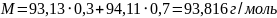
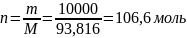
Молярную массу выпавших кристаллов состава 50% анилина- 50% фенола найдем по формуле:
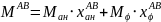
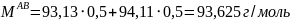
Отсюда:
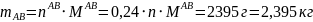
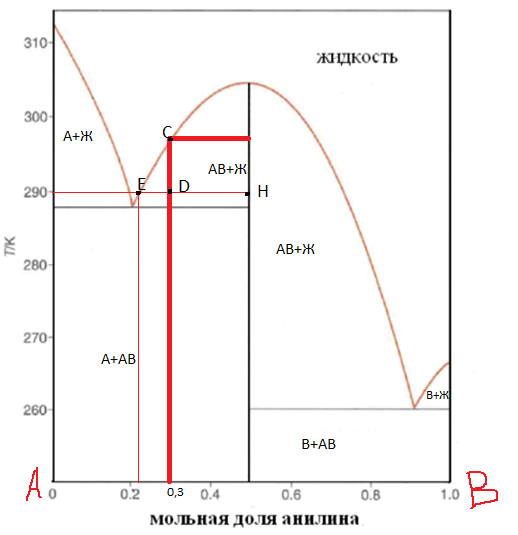
Ответ: 2, 395кг; 50% анилин-50% фенол.
