- •Основные положения теории химического строения а.М.Бутлерова. Зависимость свойств органических соединений от химического строения.
- •Изомерия: структурная, пространственная.
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
- •Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
- •1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
- •Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
- •1. Гомолитический (радикальный) разрыв связей.
- •1 . Гомологический ряд алканов: общая формула, названия
- •2. Пространственное строение молекул
- •4. Физические свойства
- •2. Изомерия алкенов
- •4. Получение алкенов
- •5. Физические свойства алкенов
- •6. Химические свойства алкенов
- •Изомеризация алкенов
- •1. Химические свойства алкенов
- •11.3 Изомерия алкинов
- •11.5 Получение алкинов
- •11.6 Физические свойства алкинов
- •11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
- •1. Строение спиртов
- •6. Способы получения спиртов
- •7. Основно-кислотные свойства.
- •8. Химические свойства одноатомных спиртов
- •3.Реакции отщепления
- •4. Реакции этерификации
- •Химические свойства альдегидов и кетонов. Реакции присоединения по двойной связи карбонильной группы (получение полуацеталей и ацеталей). Реакции конденсации.
- •Классификация
- •В) Гетерофункциональные карбоновые кислоты
- •Лабораторный синтез
- •Производные карбоновых кислот. Номенклатура. Способы получения солей, сложных эфиров, галогенангидридов, ангидридов, амидов, нитрилов. Понятия анион и ацил.
- •О сбенности строение ароматических аминов (на примере анилина)
- •1. Получение аминов при взаимодействии алкилгалогенидов с аммиаком (реакция Гофмана).
- •Химические свойства гомологов бензола — алкилбензолов
Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
Химические реакции – это процесс, который сопровождается разрывом связей между атомами в молекуле и образованием новых связей (новых молекул).
1. Гомолитический (радикальный) разрыв связей.
Разрыв связи, происходит с разъединением электронной пары.
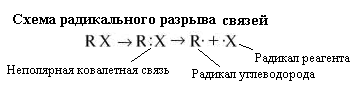
2. Гетеролитический (ионный) разрыв связей.
Р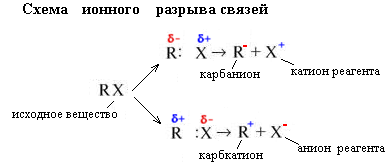 азрыв
связи, происходит без
разъединения
электронной пары.
Электронная пара (образующая ковалентную
связь) не разъединяется, а целиком
переходит к более электроотрицательному
атому, превращая его в анион. При этом
образуются короткоживущие органические
ионы – карбкатионы или карбанионы.
азрыв
связи, происходит без
разъединения
электронной пары.
Электронная пара (образующая ковалентную
связь) не разъединяется, а целиком
переходит к более электроотрицательному
атому, превращая его в анион. При этом
образуются короткоживущие органические
ионы – карбкатионы или карбанионы.
а) Электрофильный механизм разрыв связей.
Э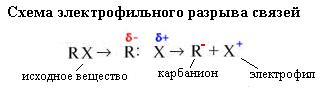 лектрофил –
«ищущий» электроны. Утверждение, что
та или иная реакция является нуклеофильной
или электрофильной, определяется
по реагенту.
лектрофил –
«ищущий» электроны. Утверждение, что
та или иная реакция является нуклеофильной
или электрофильной, определяется
по реагенту.
Карбанион имеет отрицательный заряд, а реагент Х+ (электрофил) – положительный (ищет электроны).
б) Нуклеофильный механизм разрыв связей.
Н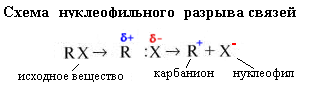 уклеофил –
ищущий ядро (положительно заряженную
частицу). Механизм реакции определяется
зарядом реагента. Карбкатион имеет
положительный заряд, а реагент Х-
- отрицательный (ищет положительно
заряженные частицы).
уклеофил –
ищущий ядро (положительно заряженную
частицу). Механизм реакции определяется
зарядом реагента. Карбкатион имеет
положительный заряд, а реагент Х-
- отрицательный (ищет положительно
заряженные частицы).
Алканы: строение, изомерия, номенклатура. Способы получения: гидрирование непредельных углеводородов, электролиз солей карбоновых кислот, восстановление карбонильных соединений, из галогеналканов (реакция Вюрца). Физические и химические свойства. Галогенирование и нитрование алканов - радикальный механизм реакций.
1 . Гомологический ряд алканов: общая формула, названия
Алканы – углеводороды, атомы углерода в которых соединены простыми связями. Общая формула: CnH2n+2.
2. Пространственное строение молекул
Атомы
углерода в алканах находятся в
состоянии sp3 –
гибридизации.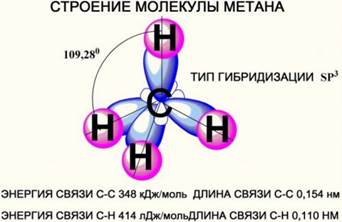
3. Номенклатура предельных углеводородов =======>>
4. Физические свойства
Температуры плавления и кипения в целом увеличиваются с увеличением числа атомов С в молекуле. Первые представители ряда алканов – газы при н.у., алканы, содержащие от 5 до 15 атомов С – обычно жидкости, свыше 15 атомов С – твердые вещества.
Г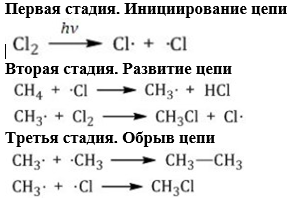 азообразные
и твердые алканы не пахнут, жидкие алканы
обладают характерным «бензиновым»
запахом.
азообразные
и твердые алканы не пахнут, жидкие алканы
обладают характерным «бензиновым»
запахом.
Все алканы бесцветны, легче воды и нерастворимы в ней. Алканы хорошо растворяются в органических растворителях, жидкие алканы (пентан, гексан) сами широко используются как растворители.
1. Реакции замещения
1.1. Галогенирование
![]() Хлорметан
может взаимодействовать с хлором и
дальше с образованием дихлорметана,
трихлорметана и тетрахлорметана:
Хлорметан
может взаимодействовать с хлором и
дальше с образованием дихлорметана,
трихлорметана и тетрахлорметана:
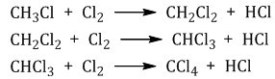
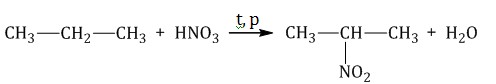
1.2. Нитрование алканов
Например. При нитровании пропана образуется преимущественно 2-нитропропан:
|
3. Реакции окисления алканов
3.1. Полное окисление – горение
CH4 + 2O2 → CO2 + 2H2O + Q
3.2. Каталитическое окисление
Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
![]()
4. Изомеризация алканов
Например, н-бутан под действием катализатора хлорида алюминия и при нагревании превращается в изобутан:
|
Получение алканов
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Например, хлорметан реагирует с натрием с образованием этана:
|
3. Электролиз солей карбоновых кислот (электролиз по Кольбе)
Это электролиз водных растворов солей карбоновых кислот.
В общем виде:
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
Алкены. Двойная связь (sp2- гибридизация). Изомерия. Номенклатура. Способы получения: элиминирование галогеноводорода из алкилгалогенидов, элиминирование воды из спиртов, дегалогенирование виц-дигалогеналканов. Физические и химические свойства.
А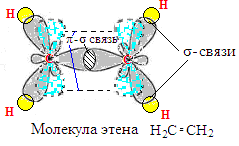 лкены
– это
ненасыщенные, ациклические углеводороды,
которые:
лкены
– это
ненасыщенные, ациклические углеводороды,
которые:
- имеют общую формулу молекул CnH2n, где n – число атомов углерода;
- второе название – «олефины»;