
- •Основные положения теории химического строения а.М.Бутлерова. Зависимость свойств органических соединений от химического строения.
- •Изомерия: структурная, пространственная.
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
- •Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
- •1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
- •Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
- •1. Гомолитический (радикальный) разрыв связей.
- •1 . Гомологический ряд алканов: общая формула, названия
- •2. Пространственное строение молекул
- •4. Физические свойства
- •2. Изомерия алкенов
- •4. Получение алкенов
- •5. Физические свойства алкенов
- •6. Химические свойства алкенов
- •Изомеризация алкенов
- •1. Химические свойства алкенов
- •11.3 Изомерия алкинов
- •11.5 Получение алкинов
- •11.6 Физические свойства алкинов
- •11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
- •1. Строение спиртов
- •6. Способы получения спиртов
- •7. Основно-кислотные свойства.
- •8. Химические свойства одноатомных спиртов
- •3.Реакции отщепления
- •4. Реакции этерификации
- •Химические свойства альдегидов и кетонов. Реакции присоединения по двойной связи карбонильной группы (получение полуацеталей и ацеталей). Реакции конденсации.
- •Классификация
- •В) Гетерофункциональные карбоновые кислоты
- •Лабораторный синтез
- •Производные карбоновых кислот. Номенклатура. Способы получения солей, сложных эфиров, галогенангидридов, ангидридов, амидов, нитрилов. Понятия анион и ацил.
- •О сбенности строение ароматических аминов (на примере анилина)
- •1. Получение аминов при взаимодействии алкилгалогенидов с аммиаком (реакция Гофмана).
- •Химические свойства гомологов бензола — алкилбензолов
Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
Функциональная группа - атом или группа атомов, которые замешают в углеводородной молекуле один или несколько атомов водорода; определяет принадлежность соединения к определенному классу и его химические свойства.
1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
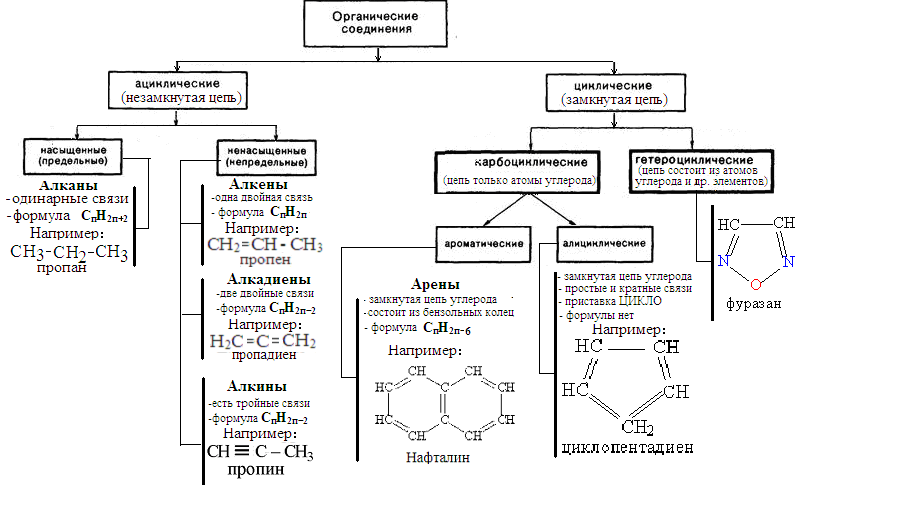
1. Ациклические (алифатические)
а) Насыщенные углеводороды представляют собой цепочки атомов углерода, соединенных простыми (одинарными) связями и окруженных атомами водорода.
б )
Ненасыщенные
углеводороды
содержат двойные или тройные связи
между атомами углерода (алкены, алкадиены,
алкины).
)
Ненасыщенные
углеводороды
содержат двойные или тройные связи
между атомами углерода (алкены, алкадиены,
алкины).
2. Циклические
а) Карбоциклическими называются соединения с замкнутой цепью атомов углерода.
Эти соединения, в свою очередь, подразделяются на ароматические и алициклические углеводороды:
Ароматические углеводороды - это соединения, содержащие бензольное кольцо.
А лициклические
углеводороды –
это все остальные карбоциклические
соединения.
лициклические
углеводороды –
это все остальные карбоциклические
соединения.
б) Гетероциклические соединения - это соединения, содержащие в цикле кроме атомов углерода, другие гетероатомы – кислород, серу, азот.
2. В зависимости от природы функциональных групп
1) Галогенопроизводные углеводороды (общая формула R -Hal):
а) фторпроизводные б) хлорпроизводные в) бромопроизводные
2) Кислородосодержащие органические соединения:
а) спирты и фенолы; б) простые эфиры; в) альдегиды; г) кетоны.
3) Азотосодержащие органические соединения:
а) амиды; б) амины; в) аминокислоты; г) нитрилы.
4) Сераорганические соединения:
а) сульфиды; б) сульфокислоты.
6. Электронные эффекты в органических соединениях. рπ- и рр – сопряжение. Влияние электронных эффектов на основно-кислотные свойства органических соединений. Теория Бёрнстеда-Лоури. Теория Льюиса.
Электронные эффекты – это смещение электронной плотности (пара валентных электронов, образующая ковалентную связь, смещается в сторону более электроотрицательного атома) в молекуле, ионе или радикале под влиянием заместителей.
И ндуктивный
эффект (I-эффeкт)
- смещение электронной плотности по
цепи σ-связей,
обусловленное различиями в
электроотрицательностях атомов.
ндуктивный
эффект (I-эффeкт)
- смещение электронной плотности по
цепи σ-связей,
обусловленное различиями в
электроотрицательностях атомов.
Индуктивный
эффект называют отрицательным
(-I-эффект
), если заместитель уменьшает электронную
плотность на атоме углерода, с которым
связан этот заместитель. При этом
заместитель приобретает частичный
отрицательный заряд (δ-), а атом углерода
- частичный положительный заряд (δ+).![]() -I-эффект
проявляют заместители, содержащие более
электроотрицательные атомы, чем атом
углерода: -F,
-Cl,
-Br,
-OH,
-NH2,
-NO2.
-I-эффект
проявляют заместители, содержащие более
электроотрицательные атомы, чем атом
углерода: -F,
-Cl,
-Br,
-OH,
-NH2,
-NO2.
Индуктивный
эффект называют положительным
(+I-эффект
), если заместитель увеличивает электронную
плотность на атоме углерода, индуцируя
на нем частичный отрицательный заряд
(δ-),
сам при этом приобретая заряд δ+:![]()
+I-эффект проявляют атомы с низкой электроотрицательностью -Mg, -Li;углеводородные радикалы (-CH3, -C2H5).
Мезомерный эффект (М-эффект) - смещение электронной плотности по цепи π-связей.
М езомерный
эффект называют отрицательным (-М),
если
заместители с электроотрицательными
атомами смещают электронную плотность
на себя, приобретая заряд заряд «-».
езомерный
эффект называют отрицательным (-М),
если
заместители с электроотрицательными
атомами смещают электронную плотность
на себя, приобретая заряд заряд «-».
М езомерный
эффект называют положительным (+М),
если
заместитель увеличивает электронную
плотность на атоме углерода, индуцируя
на нем частичный отрицательный заряд,
сам приобретая заряд «+»:
езомерный
эффект называют положительным (+М),
если
заместитель увеличивает электронную
плотность на атоме углерода, индуцируя
на нем частичный отрицательный заряд,
сам приобретая заряд «+»:
Сопряженные системы. рр, ππ и рπ – сопряжения
Сопряженные системы – это соединения с делокализованной ковалентной связью (общие орбитали).
ππ– сопряжение
ππ– сопряжение – это связь (сопряжение) двух π-связей между собой с помощью рр-связи.
Простейшим сопряженным соединением является бутадиен-1,3: СН2=СН- СН= СН2
рπ – сопряжение
р π–
сопряжение
– это
связь (сопряжение) р-орбитали
и орбиталий связанных π-связью.
π–
сопряжение
– это
связь (сопряжение) р-орбитали
и орбиталий связанных π-связью.
В молекуле винилбромида (бромэтена) две р-орбитали атомов углерода, образуют π-связь.
Влияние электронных эффектов на основно-кислотные свойства органических соединений
Кислотные свойства частицы – это её свойство отдавать (отщеплять) протон (Н+) или другую положительно заряженную частицу (CО2+, Ag+), или нейтральную частицу, которая является электроакцептором.
Основные свойства частицы – это её свойство отдавать (отщеплять) гидроксил (OH–), или другую отрицательно заряженную частицу (е-, Сl–, F–), или нейтральную частицу, которая является электродонором.
Рассмотрим влияние электронных эффектов на основно-кислотные свойства спирта. Молекула спирта может проявлять кислотные свойства и свойства основания (в зависимости от типа реагента), что обусловлено наличием полярных связей (С :О и О: Н).

Теории кислот и оснований (теория Бёрнстеда-Лоури, теория Льюиса):
По теории Бёрнстеда – Лоури:
• кислоты – это нейтральные молекулы или ионы, способные отдавать протон (доноры протона);
• основания - это нейтральные молекулы или ионы, способные присоединять протон (акцепторы протона).
По теории Льюиса:
• кислоты – это нейтральные молекулы или ионы, способные принимать электронную пару (акцепторы при образовании ковалентной связи);
•основания– это нейтральные молекулы или ионы, способные отдавать электронную пару (доноры при образовании ковалентной связи).
