
- •Основные положения теории химического строения а.М.Бутлерова. Зависимость свойств органических соединений от химического строения.
- •Изомерия: структурная, пространственная.
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
- •Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
- •Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
- •1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
- •Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
- •1. Гомолитический (радикальный) разрыв связей.
- •1 . Гомологический ряд алканов: общая формула, названия
- •2. Пространственное строение молекул
- •4. Физические свойства
- •2. Изомерия алкенов
- •4. Получение алкенов
- •5. Физические свойства алкенов
- •6. Химические свойства алкенов
- •Изомеризация алкенов
- •1. Химические свойства алкенов
- •11.3 Изомерия алкинов
- •11.5 Получение алкинов
- •11.6 Физические свойства алкинов
- •11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
- •1. Строение спиртов
- •6. Способы получения спиртов
- •7. Основно-кислотные свойства.
- •8. Химические свойства одноатомных спиртов
- •3.Реакции отщепления
- •4. Реакции этерификации
- •Химические свойства альдегидов и кетонов. Реакции присоединения по двойной связи карбонильной группы (получение полуацеталей и ацеталей). Реакции конденсации.
- •Классификация
- •В) Гетерофункциональные карбоновые кислоты
- •Лабораторный синтез
- •Производные карбоновых кислот. Номенклатура. Способы получения солей, сложных эфиров, галогенангидридов, ангидридов, амидов, нитрилов. Понятия анион и ацил.
- •О сбенности строение ароматических аминов (на примере анилина)
- •1. Получение аминов при взаимодействии алкилгалогенидов с аммиаком (реакция Гофмана).
- •Химические свойства гомологов бензола — алкилбензолов
Химические свойства гомологов бензола — алкилбензолов
Реакции замещения алкилбензолов:
Галогенирование алкилбензолов: Нитрование алкилбензолов:


Окисление: Гидрирование бензола и алкилбензолов:
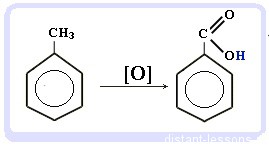

Реакция горения: все органические вещества горят с образованием углекислого газа CO2 и воды H2O:
CnH2n-6 + (3n-3)\2 O2 → nCO2 + (n-3)H2O
Реакции электрофильного замещения по Фриделю- Крафтсу
Алкилирование
![]()
1. Образование электрофильного агента:
![]()
2. Образовавшийся электрофил (СН3+) реагирует с бензолом. За счет электронного эффекта бензольное кольца получает заряд «+», происходит поляризация связей в π-кольце с разрывом одной связи – образуется π-комплекс (бывшее π-кольцо с разорванной связью).

3. Заряженное ядро π-комплекма, за счет электронного эффекта, поляризует связь С-Н (притягивает электрон) и придает водороду знак +. Затем происходит отрыв протона с образованием молекулы нитробензола.
Оставшаяся пара электронов восстанавливает ранее разорванное кольцо с π – связями.
О
 собенности
хлорирования алкилбензолов
собенности
хлорирования алкилбензолов
Процесс идет по электрофильному замещению.
![]()
Ориентация замещения в производных бензола
I .
Электронодонорные заместители
способствуют электрофильному замещению
в орто-
и пара-положениях
бензольного кольца и называются
заместителями
(ориентантами) первого рода.
.
Электронодонорные заместители
способствуют электрофильному замещению
в орто-
и пара-положениях
бензольного кольца и называются
заместителями
(ориентантами) первого рода.
Примеры донорных заместителей: СН3, -OH, -NH2, Cl и др.
II. Электроноакцепторные заместители направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
Примеры акцепторных донорных: NO2, H SO3,CCl3, -CN, -COOH Например, толуол, содержащий заместитель первого рода (СН3), нитрируется и бромируется в пара- и орто- положения:
Фенолы. Классификация. Изомерия. Номенклатура. Способы получения. Основно-кислотные свойства. Химические свойства (галогенирование, получение моногалогенпроизводных, получение простых эфиров. Нитрование, галогенирование, алкилирование, ацилирование по бензольному кольцу.)
Фенолы - производные ароматических углеводородов, в молекулах которых гидроксильная группа (- ОН) непосредственно связана с атомами углерода в бензольном кольце.
Классификация фенолов
1. Различают одно-, двух-, трехатомные фенолы в зависимости от количества ОН-групп в молекуле.

Изомерия и номенклатура
Возможны 2 типа изомерии:
изомерия положения заместителей в бензольном кольце;
изомерия боковой цепи (строения алкильного радикала и числа радикалов)

Например: 2-метилфенол, 1-гидрокси-2-метилбензол, орто-Крезон - это названия одного и того же фенола.
Способы получения
1). Кумольный способ получения фенола.
В настоящее время кумольный способ используется как основной в мировом производстве фенола.

2). Из каменноугольной смолы (Сложная смесь более чем 1000 ароматических соединений – выход мал):
C6H5ONa + H2SO4(разб) → С6H5 – OH + NaHSO4
Продукт обработки фенолята натрия (содержится в смоле) едким натром
3). Из галогенбензолов:
С6H5-Cl + NaOH t,p → С6H5 – OH + NaCl
4). Сплавлением солей ароматических сульфокислот с твёрдыми щелочами:
C6H5-SO3Na + NaOH t → Na2SO3 + С6H5 – OH (натриевая соль бензолсульфокислоты + щелочь)
Основно-кислотные свойства
Общие формулы фенола, спирта и кислоты, позволяет изучать основно- кислотные свойства в сравнении.
![]()
Кислотные свойства - сильные. По кислотным свойствам фенол превосходит этанол в 106 раз, и воду. При этом во столько же раз уступает уксусной кислоте из-за влияния кислорода (с двойной связью) на подвижность протона.
![]()
Основные свойства -слабые. Фенолы – более слабые нуклеофилы (основные свойства), чем спирты. Поэтому реакцию образования солей (фенолят) проводят в присутствии щелочи: фенолы при этом образуют более сильные нуклеофилы – феноляты:
![]()
Галогенирование Получение моногалогенпроизводных.


Получение простых эфиров: (R-O-R)I
Образование фенолятов. 2) Образование простых эфиров фенолов Нитрование.



Алкилирование фенолов по бензольному кольцу
А
 цилирование —
введение ацильного остатка RCO- (ацила)
в состав органического соединения, как
правило, путём замещения атома водорода.
цилирование —
введение ацильного остатка RCO- (ацила)
в состав органического соединения, как
правило, путём замещения атома водорода.
Углеводы. Классификация углеводов. Классификация моносахаридов. Принадлежность к D и L ряду. Углеводы. Образование циклических (полуацетальных) форм моносахаридов (пиранозная, фуранозная). Формулы Хеуорса. α и β- диастереомеры. Гликозидный гидроксид.








