
- •Основные положения теории химического строения а.М.Бутлерова. Зависимость свойств органических соединений от химического строения.
- •Изомерия: структурная, пространственная.
- •А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
- •Б) Пространственная изомерия алкенов
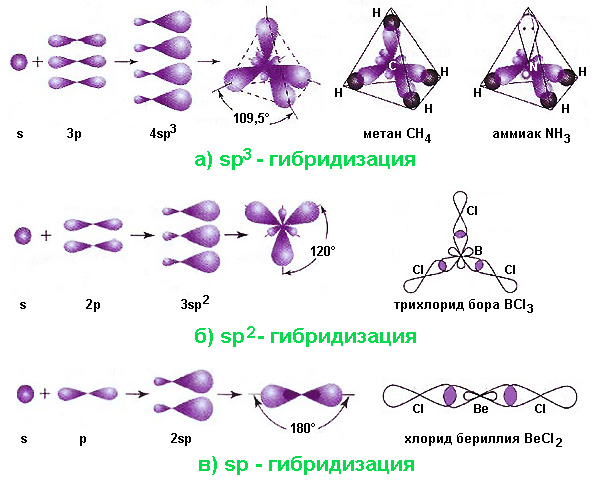
- •Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
- •Классификация органических соединений. Понятие гомологический ряд. Функциональная группа.
- •1. Классификация органических соединений в зависимости от строения цепи (углеродного скелета)
- •Механизмы химических реакций. Гомолитический и гетеролитический разрывы химической связи. Радикальный, электрофильный и нуклеофильный механизмы реакций (схемы).
- •1. Гомолитический (радикальный) разрыв связей.
- •1 . Гомологический ряд алканов: общая формула, названия
- •2. Пространственное строение молекул
- •4. Физические свойства
- •2. Изомерия алкенов
- •4. Получение алкенов
- •5. Физические свойства алкенов
- •6. Химические свойства алкенов
- •Изомеризация алкенов
- •1. Химические свойства алкенов
- •11.3 Изомерия алкинов
- •11.5 Получение алкинов
- •11.6 Физические свойства алкинов
- •11.7 Реакции присоединения: реакция Кучерова (гидратация этина).
- •1. Строение спиртов
- •6. Способы получения спиртов
- •7. Основно-кислотные свойства.
- •8. Химические свойства одноатомных спиртов
- •3.Реакции отщепления
- •4. Реакции этерификации
- •Химические свойства альдегидов и кетонов. Реакции присоединения по двойной связи карбонильной группы (получение полуацеталей и ацеталей). Реакции конденсации.
- •Классификация
- •В) Гетерофункциональные карбоновые кислоты
- •Лабораторный синтез
- •Производные карбоновых кислот. Номенклатура. Способы получения солей, сложных эфиров, галогенангидридов, ангидридов, амидов, нитрилов. Понятия анион и ацил.
- •О сбенности строение ароматических аминов (на примере анилина)
- •1. Получение аминов при взаимодействии алкилгалогенидов с аммиаком (реакция Гофмана).
- •Химические свойства гомологов бензола — алкилбензолов
Основные положения теории химического строения а.М.Бутлерова. Зависимость свойств органических соединений от химического строения.
1-е положение. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям.
2-е положение. Свойства веществ зависят не только от качественного и количественного состава, но и от порядка соединения атомов в молекуле.
Явление, при котором может существовать несколько веществ, имеющих один и тот же состав и одну и ту же молекулярную массу, но различающихся строением молекул и свойствами, называют явлением изомерии.
3-е положение. По свойствам вещества можно определить строение его молекулы, а по строению - предвидеть свойства.
Для примера, рассмотрим основные свойства алканов (класс насыщенных углеводородов):
- для представителей этого класса углеводородов не характерны реакции присоединения, поскольку все связи в молекуле одинарные (насыщенные, и очень прочные);
- алканы вступают в реакции замещения атома водорода на галоген (галогенирование) по радикальному механизму (замещение нейтрального атома водорода на нейтральный радикал галогена с неспаренным электроном);
- для алканов характерно взаимодействие с кислородом воздуха. При горении в качестве продуктов реакции выступает углекислый газ, водяные пары. Реакция сопровождается образованием значительного количества тепла;
- при взаимодействии метана с кислородом воздуха возможен взрыв. Подобный эффект характерен для всех алканов и их смесей.
4-е положение. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
Изомерия: структурная, пространственная.
Изомерия — явление, заключающееся в существовании химических соединений — изомеров, — одинаковых по атомному составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и, вследствие этого, по свойствам.
А) Структурная изомерия алкенов Виды структурной изомерии: изомерия углеродного скелета, изомерия положения двойной связи и межклассовая изомерия.
1. Изомерия цепи (углеродного скелета)- начиная с С4Н8.
![]()
2. Изомерия положения двойной связи (также начинается с бутена - С4Н8):
![]()
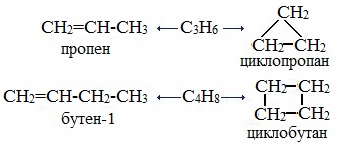
3. Межклассовая изомерия, начиная с С3Н6 (алкены изомерны другому классу соединений — циклоалканам).
Б) Пространственная изомерия алкенов
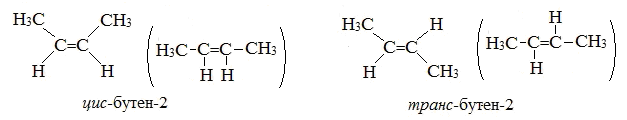
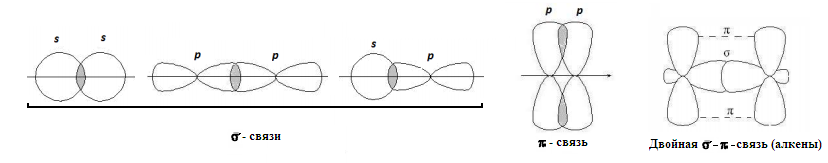
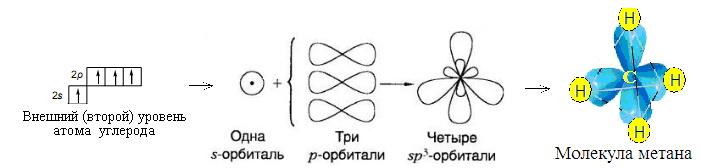
Строение электронных подуровней атома углерода. Гибридное состояние атомных орбиталей: sp3-; sp2-; sp-гибридизации. Понятие о σ и π- связях.
Г![]()
 ибридизация
– это мысленная операция превращения
обычных атомных орбиталий в новые,
геометрия которых соответствует
пространственному строению молекул.
ибридизация
– это мысленная операция превращения
обычных атомных орбиталий в новые,
геометрия которых соответствует
пространственному строению молекул.
Химическая связь в органических соединениях. Ковалентная простая, двойная, тройная связь. Образование связи в метане и четыреххлористом углероде. Донорно-акцепторный механизм: образование иона оксония. Семиполярная связь. Водородная связь.
Химическая связь в органических соединениях – это связь за счет электростатических сил, которые связывают атомы в молекулы, ионы и радикалы.
К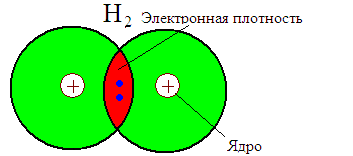 овалентная
связь
- это связь, которая обеспечивается
за счет перекрывания электронных облаков
взаимодействующих атомов.
овалентная
связь
- это связь, которая обеспечивается
за счет перекрывания электронных облаков
взаимодействующих атомов.
В алканах пара электронов образуется простую (одинарную) неполярную ковалентную связь.
![]()
Атомы углерода находятся в состоянии sp3-гибридизации и связаны друг с другом одинарной σ-связью.
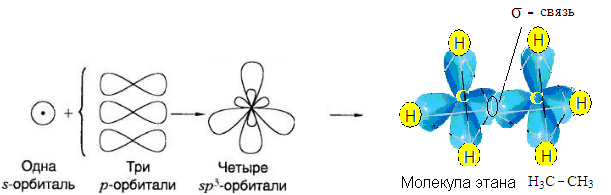
В алкенах две пары электронов образуется двойную неполярную ковалентную связь.
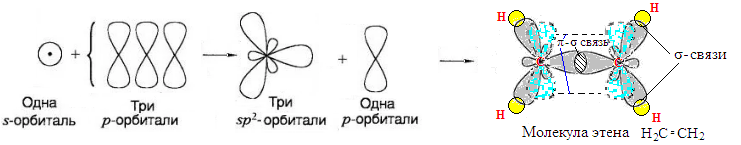
В алкинах три пары электронов образуется тройную неполярную ковалентную связь.
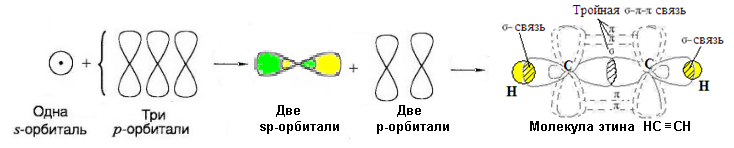
Образование связи в метане и четыреххлористом углероде
Метан - это простейший углеводород, бесцветный газ (в нормальных условиях) без запаха, химическая формула — CH4.
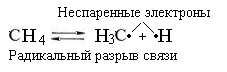
Благодаря неспаренным электронам, свободные радикалы обладают высокой химической активностью.
Ч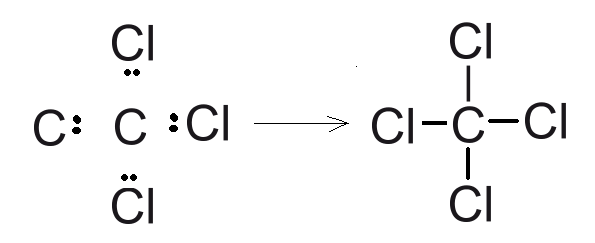 етыреххлористый
углерод
или тетрахлорметан – это тяжелая
бесцветная жидкость с характерным
запахом.
етыреххлористый
углерод
или тетрахлорметан – это тяжелая
бесцветная жидкость с характерным
запахом.
При образовании ковалентных связей в четыреххлористом углероде метане применяется sp3 – гибридизация атома углерода (как в метане), но в отличие от метана, общие электронные пары значительно смещены в сторону атомов хлора (р-орбитали), поскольку он обладает большей электротрицательностью по сравнению с углеродом, что приводит к образованию полярной ковалентной связи С :Cl.
Разрыв такой связи, происходит без разъединения электронной пары. Электронная пара (образующая ковалентную связь) не разъединяется, а целиком переходит к более электроотрицательному атому, превращая его в анион.
При этом образуются короткоживущие органические ионы – это ионный или гетеролитический разрыв связей.
![]()
Благодаря зарядам ионы обладают высокой химической активностью, образуя ионные химические связи.
Донорно-акцепторный механизм: образование иона оксония.
Ион оксония (гидроксо́ний) НзО+ — комплексный ион, соединение протона с молекулой воды.
Н2О + Н+ = Н3О+
![]()

Так как у атома кислорода на внешнем уровне остались еще два электрона (s-типа), он может образовать третью связь ковалентного типа по донорно-акцепторному механизму с катионом водорода, который имеет свободную орбиталь1s0.
Семиполярная связь
С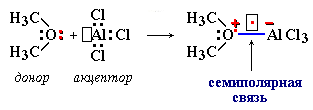 очетание
ковалентной
донорно-акцепторной и ионной связей
называют
семиполярной
связью.
Образование
этой связи происходит при взаимодействии
атома-донора и атома-акцептора, не
имеющих зарядов.
очетание
ковалентной
донорно-акцепторной и ионной связей
называют
семиполярной
связью.
Образование
этой связи происходит при взаимодействии
атома-донора и атома-акцептора, не
имеющих зарядов.
В результате, при образовании связи, на атоме-донора возникает положительный заряд, а на атоме-акцепторе, предоставившем вакантную орбиталь, - отрицательный.
Водородная связь
Э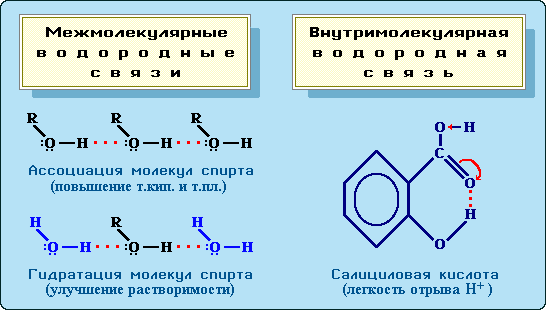 то
связь, образующаяся между атомом
водорода, который уже связан с атомом,
имеющим высокую электроотрицательность,
и другим электроотрицательным атомом.
то
связь, образующаяся между атомом
водорода, который уже связан с атомом,
имеющим высокую электроотрицательность,
и другим электроотрицательным атомом.
