
ликвидации пожаров в химической лаборатории
.pdfСПБГУАП группа 4736 https://new.guap.ru/i03/contacts
ИНСТРУКЦИЯ по работе в химической лаборатории
Общие правила работы в лаборатории
Непременным условием успешного изучения курса химии является выполнение студентами лабораторных работ. Лабораторные занятия имеют своей задачей помочь студентам усвоить законы и теоретические положения химии, уяснить влияние различных условий на течение химических процессов, ознакомиться со свойствами наиболее важных элементов и их соединений.
В каждой лабораторной работе имеется введение, содержащее основные теоретические сведения, необходимые для осмысленного выполнения опытов, для понимания их химической и физико-химической сущности.
1.Перед каждым лабораторным занятием студент должен дома изучить теоретическое введение и прочитать описание техники выполнения предстоящей лабораторной работы.
2.В верхней одежде в лабораторию входить не разрешается. Все личные вещи, не являющиеся необходимыми для выполнения работы, сдавать в гардероб. Работать в лаборатории разрешается только в специальном халате.
3.Если нет специальных указаний преподавателя, опыты должны проводиться в точном соответствии с их описанием в данном руководстве.
4.Без разрешения преподавателя нельзя проводить никаких опытов, не предусмотренных планом.
5.При всех работах следует соблюдать максимальную осторожность, помня, что неаккуратность, невнимательность, недостаточное знакомство с приборами, аппаратами и свойствами веществ, с которыми ведутся работы, могут повлечь за собой появление несчастных случаев.
6.Работая по заданию, нужно выполнять только ту работу, которая поручена и разъяснена, и не отвлекаться посторонними делами и разговорами.
7.На рабочих столах и вокруг работающих не должно быть ничего лишнего. При работе следует соблюдать тишину, экономить реактивы, электроэнергию, бережно относиться к оборудованию, мебели, посуде. Нельзя оставлять без присмотра работающие установки, включенные электронагревательные приборы, спиртовки.
8.Химические реакции следует проводить только с такими количествами и концентрациями веществ, в такой посуде и приборах и в таких условиях, какие указаны в руководстве, отступления допускаются только с разрешения руководителя работы.
9.В химической лаборатории нельзя принимать пищу и хранить продукты.
10.Уходя из лаборатории, нужно убрать рабочее место, выключить нагревательные приборы и тщательно вымыть руки. Лабораторию можно покидать после выполнения работы с разрешения преподавателя.
11.К работе в химической лаборатории допускаются студенты, прошедшие полный инструктаж, что оформляется соответствующей записью в специальном журнале по технике безопасности и закрепляется подписями
3
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
студентов и лиц, проводивших инструктаж.
12.Во время проведения опытов следует внимательно наблюдать за всеми изменениями, происходящими в результате реакций.
13.Результаты наблюдений сразу же после каждого опыта следует записать в лабораторную тетрадь. Запись в тетради начинается с указания номера и названия лабораторной работы, а также даты ее выполнения. Записи в тетради должны быть краткими и четкими.
Основным из того, что студент должен записать в лабораторную тетрадь, является:
1) условия, при которых производится опыт; 2) наблюдения (образование осадка, изменение цвета раствора или осадка,
выделение или поглощения теплоты, газообразование и т.д.); 3) уравнения происходящих реакций; 4) расчеты и выводы.
В случае работы с прибором следует нарисовать его схему.
Обращение с реактивами
1.Беря вещество, внимательно читайте этикетку и при малейшем сомнении наведите справку или проведите проверку.
2.Взяв для проведения опыта раствор из склянки, надо сразу же закрыть
еепробкой и поставить на место.
3.Необходимо следить за сохранением чистоты реактивов:
o нельзя высыпать или выливать обратно в сосуд неиспользованный или частично использованный реактив;
o не путать пробки от колб и бутылей с реактивами; o не доставать вещество из банки грязным шпателем;
o если нужно взять небольшое количество раствора пипеткой, необходимо налить его перед этим из колбы в стакан, чтобы не испортить реактив в колбе.
4. Реактивы, находящиеся под вытяжкой (концентрированные кислоты), нельзя переносить на рабочий стол.
Меры предосторожности
Работая в лаборатории, студент должен соблюдать следующие меры предосторожности:
1.Все опыты с ядовитыми и вредными веществами (цианистые соединения, хлор, бром, сероводород, аммиак, органические растворители, летучие кислоты и т.п.), следует проводить только в вытяжном шкафу («под тягой»).
2.Все работы проводить в плотно застегнутом халате и следить за тем, чтобы реактивы (особенно кислоты и щелочи) не попали на поверхность кожи
иодежду.
3.Наливая раствор, держать пробирку и колбу на некотором отдалении от
4
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
себя, во избежание попадания жидкости на одежду или кожу.
4.При нагревании жидкости держать пробирку отверстием в сторону от себя и от людей, находящихся рядом.
5.Никакие вещества в химической лаборатории нельзя пробовать на вкус,
атакже пользоваться для питья какой-либо химической посудой. Определять запах вещества необходимо с осторожностью, не делая при этом глубокого вдоха, а направляя к себе пары или газы движением руки.
6.Не приближать лицо к сосуду, в котором нагревается жидкость, так как при кипении жидкости может произойти ее разбрызгивание.
7.Перед каждым опытом тщательно осматривать аппаратуру и посуду, убеждаться в ее исправности и в правильности сборки установки или прибора.
8.При разбавлении концентрированной серной кислоты водою нельзя приливать воду к кислоте; надо приливать тонкой струей серную кислоту к холодной воде при помешивании.
9.После окончания работы всю посуду необходимо тщательно вымыть, вылив остатки реактивов из нее в специально отведенное место под вытяжкой (в слив).
Первая помощь при химических ожогах кожи
При попадании на кожу кислоты или щелочи нужно удалить жидкость ватным тампоном, промыть пораженное место обильным количеством воды изпод крана (не менее 15 мин. и лучше теплой). Затем наложить примочку, пропитанную нейтрализующим веществом. При ожогах кислотами (соляной, азотной, серной, фосфорной), а также хлором или бромом, в качестве нейтрализатора применять 2%-ный раствор карбоната аммония или гидрокарбоната натрия. При ожогах щелочью – 2%-ный раствор уксусной или лимонной кислот. При ожоге фтороводородной кислотой после промывания обильным количеством воды наложить компресс с 20%-ной суспензией оксида магния в глицерине.
Первая помощь при ожогах глаз
При проведении любых операций, связанных хотя бы с малейшей опасностью повреждения или засорения глаз, работать без очков или маски запрещается.
Ожоги глаз возможны по многим причинам: при неаккуратной работе, при сплавлении металлов, от брызг при выпаривании веществ и перемешивании прокаливаемых солей, при нагревании различных жидкостей, разбавлении кислот и др.
Очень опасно попадание брызг кислоты или щелочи в глаза. Особо опасны для глаз щелочи, они быстро вступают во взаимодействие с тканями глаза, проникая в его глубокие слои. Чрезвычайно опасно попадание в глаза
5
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
концентрированных и горячих растворов щелочей. Поражение глаз щелочью требует продолжительного лечения и очень часто заканчивается потерей зрения. В случае попадания агрессивных веществ в глаза необходимо немедленное промывание глаз струей воды (лучше теплой) в течение 10-15 минут. Затем при попадании в глаза кислоты продолжают промывание 2%-ным раствором гидрокарбоната натрия, а при попадании щелочи – раствором хлорида натрия (с той же концентрацией, что и щелочь) в течение 30-60 мин. После чего нужно немедленно обратиться к врачу.
Дополнительные меры по предупреждению пожаров, загораний и взрывов
Лабораторную работу нужно выполнять, как правило, стоя; не оставлять рабочее место без присмотра. Не выливать легковоспламеняющиеся и горючие вещества в канализацию, а собирать в герметически закрывающуюся тару.
Не загромождать коридоры и проходы лаборатории, а также проходы к средствам пожаротушения. Надо иметь в виду, что взрывоопасные соединения (или смеси) могут образоваться в ходе реакции или при длительном хранении веществ.
Правила и средства ликвидации пожаров в химической лаборатории.
Косновным правилам относятся следующие:
1.Немедленно сообщить по телефону 101 пожарному посту (команде) о загорании или включить пожарную сигнализацию.
2.Перекрыть магистральные вентили, краны газовой сети, вентиляции, обесточить электропроводку.
3.Удалить из лаборатории в безопасное место все огне- и взрывоопасные вещества.
4.Воспользоваться средствами ликвидации пожаров в химической лаборатории для тушения пожара.
Средства тушения пожара. К ним относятся вода, огнетушители, асбестовые одеяла или кошмы, ящики с сухим песком. При выборе средств ликвидации пожаров необходимо учитывать химические превращения, которые могут произойти в условиях повышенной температуры.
Специфика тушения водой. Для ликвидации небольших очагов пламени чаще берут воду из водопроводного крана. При необходимости подачи большого количества воды пользуются внутренним пожарным водопроводом. При тушении пожара воду направляют на поверхность горящих веществ, вследствие чего их температура резко понижается до границы, при которой они не воспламеняются. Образующийся при этом водяной пар препятствует доступу кислорода к зоне горения.
Однако воду нельзя использовать для тушения горящего электрооборудования, находящегося под напряжением; горящих веществ, вступающих с водой в реакцию с выделением тепла или образованием опасных соединений (металлические натрий, калий, магний и его сплавы, алюминий в порошке или стружке, карбид кальция и т.д.), а также горящих углеводородов и
6
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
других, не смешивающихся с водой жидкостей, плотность которых меньше единицы, так как при этом они всплывают, и площадь пожара значительно увеличивается.
Во всех случаях, когда процесс горения не может происходить без доступа воздуха и площадь горения невелика, ее засыпают песком или плотно накрывают асбестовым одеялом. Последнее используют и при загорании одежды. Часто пострадавший пытается бежать, его нужно остановить (например, повалив на пол), и набросить на него асбестовое одеяло или кошму из плотной ткани.
Огнетушители. Наиболее эффективны, особенно при больших очагах пожара, огнетушители. Из них чаще используются углекислотные (марки ОУ-2 и др.), которые заполняются сжиженным диоксидом углерода под давлением 6 МПа. Однако они малоэффективны при гашении тлеющих материалов и, кроме того, их нельзя использовать при тушении горящей одежды на человеке (снегообразная масса диоксида углерода при попадании на кожу вызывает обморожение), а также при горении щелочных металлов (ЩМ), поскольку они реагируют с CO2. Для подавления горения ЩМ используют порошковые огнетушители.
Отчет по лабораторным работам
Выполнив все лабораторные работы, предусмотренные программой, студент сдает отчет. На отчете студент должен предоставить лабораторную тетрадь преподавателю для проверки. При сдаче отчета он должен уметь:
1)изложить технику выполнения опытов;
2)дать теоретическое объяснение результатов опытов;
3)составлять молекулярные и ионные уравнения реакций обмена;
4)составлять уравнения окислительно-восстановительных реакций.
7
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Лабораторная работа №1
Анализ этилового спирта
Совершенно чистый 100% этиловый спирт – гигроскопичная бесцветная жидкость почти без запаха с температурой кипения 780 и плотностью при 200 С 0,7892 г/см3. Присутствие влаги придает ему характерный запах алкоголя. В зависимости от способа получения и очистки в товарном этиловом спирте могут присутствовать различные примеси: высшие спирты, альдегиды, кетоны, карбоновые кислоты, углеводороды и другие вещества, содержание которых обычно не превышает десятых долей процента. Наличие тех или иных примесей до некоторой степени указывает на происхождение спирта. Например, в этиловом спирте, полученном методом гидратации этилена, допускается содержание изопропилового спирта до 0,2%. В техническом гидролизном спирте содержание метилового и высших спиртов (сивушных масел) доходит также до 0,2%, а содержание альдегидов до 500мг/л. В ректификационном спирте, полученном из зерна, содержание этих примесей снижается до тысячных долей процента.
Цель работы: Определение содержания этилового спирта
Выпускаемый нашей промышленностью этиловый спирт содержит от 88 до 96,2 об. Этанола в зависимости от метода синтеза и качества очистки. За исключением незначительного количества примесей органических веществ, остальное составляет вода. Так как плотность воды значительно больше плотности этилового спирта, то по плотности анализируемого спирта можно с достаточной точностью определить в нем содержание и воды и спирта. Определение плотности проводят с помощью специальных ареометровспиртометров. В спиртовых таблицах , утвержденных Комитетом стандартов, мер и измерительных приборов при Совете Министров СССР, по значению плотности при 200 С анализируемого спирта находят:
1)содержание спирта при 200 С (в объемн. %);
2)объем безводного спирта при 200 С (в л), заключающийся в данном объеме или в 1 кг;
3)содержание спирта при 200 С (в вес. %).
При наличии в техническом этиловом спирте примесей в количестве, превышающем норму, установленные ГОСТ – ом, следует в процентное
содержание спирта, найденное по таблице, внести поправку. Значение этих поправок также находят по специальным таблицам. Например, в анализируемом спирте содержится 1% эфира. По плотности найдено, что содержание спирта составляет 93%. Чтобы узнать истинное содержание спирта, следует из 93 % вычесть поправку на эфир равную 1,3%
Цель работы: Определение содержания изопропилового спирта
8
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Метод определения изопропилового спирта в этиловом спирте состоит в их окислении хромовой смесью по реакциям:
2K2Cr2O7 +8H2SO4 + C2H5(OH) → 3CH3COOH + 2Cr2(SO4)3 + 2K2SO4 + 11H2O
K2Cr2O7 +4H2SO4+3CH3CH(OH)CH3→3CH3COCH3 +Cr2(SO4)3 +2K2SO4+
7H2O
Образовавшийся ацетон отгоняют, а затем в щелочной среде окисляют его йодом:
I2 + 2NaOH → NaIO + NaI + H2O
3NaIO + CH3COCH3 → CHI3 + CH3COONa + 2NaOH
После окисления раствора
NaIO + NaI + 2HCI →2NaCI + I2 + H2O
Выделившийся йод оттитровывают тиосульфатом натрия.
Реактивы
Едкий натр, 4н. раствор.
Соляная кислота, плотность 1,19 г/см3 Хромовая смесь. В мерную колбу емкостью 1 л отвешивают 100г
бихромата калия, наливают 600 мл воды и растворяют при помешивании. К раствору постепенно приливают из цилиндра 250мл серной кислоты ( плотность 1,84 г/см3) и слегка перемешивают, а затем после охлаждения доводят до метки водой.
Йод , 0,1 н.раствор.
Тиосульфат натрия, 0,1 н. раствор. Крахмал, 0,5% раствор.
Методика определения
25 мл воды наливают в мерную колбу емкостью 100 мл и взвешивают с точностью до 0,01 г. Затем наливают в нее с помощью пипетки 2 мл анализируемого спирта, перемешивают и снова взвешивают с той же точностью. По разности масс узнают массу анализируемого спирта. В колбу доливают воды до метки и тщательно перемешивают. В круглодонную колбу емкостью 500 мл вливают весь спиртовой раствор из мерной колбы, 100 мл хромовой смеси, вносят 1-3 кусочка пемзы или фарфора и присоединяют к ней обратный шариковый холодильник. Содержимое колбы нагревают до кипения. После пятиминутного кипения и некоторого охлаждения отсоединяют
9
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
холодильник и промывают его внутреннюю трубку водой. К колбе присоединяют двухшариковый дефлегматор, наклонный водяной холодильник и перегоняют образовавшийся при окислении ацетон и воду в мерный цилиндр емкостью 100 мл, который помещают в стакан с холодной водой. Перегонку прекращают, когда в мерном цилиндре наберется 80 мл дистиллята. Полученный дистиллят переливают в коническую колбу с пробкой и прибавляют к нему 12 мл 4 н. раствора едкого натра, 25мл 0,1 н. раствора йода, перемешивают, закрывают пробкой и оставляют стоять. Через 10 мин к раствору приливают 5 мл концентрированной соляной кислоты и выделившийся избыток йода оттитровывают тиосульфатом натрия, приливая в конце титрования 2-3 мл 0,5% раствора крахмала.
Содержание изопропилового спирта х (в вес. %) подсчитывается по формуле
х1=( V1 – V2)∙0,000967 ∙ 1,035 ∙ 100/ G = ( V1 – V2) ∙0,1/ G
где V1- объем точно 0,1 н. Раствора тиосульфата на
трия, пошедший на титрование 25 мл точно 0,1 н. раствора йода, мл;
V2 – объем точно 0,1 н. Раствора тиосульфата натрия, пошедший на титрование избытка йода в анализируемой пробе, мл;
0,000967количество ацетона, эквивалентное 1 мл точно 0,1 н.
раствора тиосульфата натрия, г;
1,035 – коэффицент для перевода ацетона в изопропиловый спирт; G – навеска испытуемого спирта, г.
Вопросы:
1.Какие примеси присутствуют в этиловом спирте?
2.Метод определеия содержания изопропилового спирта в этиловом спирте состоит?
3.Что находят в спиртовых таблицах по значению плотности при 200 С анализируемого спирта?
Лабораторная работа №2
Определение содержания органических кислот в спирте
Цель работы: Определение содержание кислот в спирте посредством титрования раствором едкой щелочи.
Содержание кислот в спирте определяется посредством титрования раствором едкой щелочи. Результаты анализа выражаются в расчете на уксусную кислоту (в мг на 1 л спирта).
10
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Реактивы:
Едкий натр, 0,1н. раствор. Лакмус, 1% водный раствор.
Методика определения
В две конические колбы емкостью 500 мл наливают по 100 мл испытуемого спирта, по 100 мл дистиллированной воды и по 0,5 мл раствора лакмуса.
Содержимое одной из колб при помешивании титруют 0,1 н. раствором NaOH до появления первого посинения раствора.
Для более отчетливого наблюдения за изменением окраски сравнивают цвета растворов в обеих колбах.
Количество кислоты в расчете на уксусную кислоту х (в мг на 1л спирта) подсчитывают по формуле.
х= V ∙ 0,006 ∙ 1000 ∙ 1000 /100 = 60 ∙ V
V – объем точно 0,1 н. раствора едкого натра, пошедший на титрование 100 мл спирта, мл;
0,006 – количество уксусной кислоты, эквивалентное 1 мл точно 0,1 н. раствора едкого натра, г.
Нейтрализованный раствор спирта сохраняет для определения в нем содержания сложных эфиров.
Вопросы:
1.Какие вещества называют спиртами?
2.Составьте уравнения реакций, характеризующие химические свойства спиртов.
3.Как на производстве получают этанол и метанол?
Лабораторная работа №3
Определение воды в спирте
Цель работы Определение воды в спирте.
Привзаимодействии воды, содержащейся в спирте, с карбидом кальция выделяется ацетилен:
CaC2 + H2O → C2H2 + Ca(OH)2
По объему выделившегося ацетилена подсчитывают эквивалентное количество воды.
11
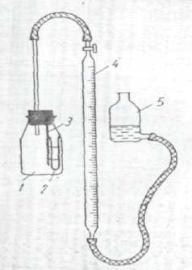
СПБГУАП группа 4736 https://new.guap.ru/i03/contacts
Описание и подготовка прибора
Прибор для определения воды газометрическим методом представлен на рис.1. Один конец газовой бюретки 4 с реакционным сосудом 1, а к другому концу присоединена уравнительная склянка 5 с 10% раствором хлористого кальция, насыщенным ацителеном.
Перед началом определения вынимают пробку из реакционного сосуда, открывают кран и поднятием уравнительной склянки доводят жидкость в бюретке до нулевой отметки. Закрыв кран, уравнительную склянку устанавливают на стол. Если при этом уровень жидкости в бюретке сначала понизится, а затем установится на определенном месте, кран бюретки герметичен.
Рис. 1 Прибор для определения воды: 1- реакционный сосуд; 2- пробирка; 3- держатель пробирки; 4 – газовая бюретка; 5 – уравнительная склянка.
Из бюретки наливают в пробирку 0,5-1,0 мл анализируемого спирта с таким расчетом, чтобы при реакции выделилось не более 90 мл ацетилена. Пробирку с помощью резинки быстро прикрепляют к держателю – стеклянной палочке, вделанной в пробку. Затем этой пробкой закрывают реакционный сосуд, куда предварительно насыпают 1-2 г карбида кальция, и собранный прибор проверяют на герметичность.
Поднятием уравнительной склянки устанавливают жидкость в бюретке и в уравнительной склянке на одном уровне, который считают за начальное положение. Банку осторожно наклоняют и дают испытуемой жидкости по каплям вытекать на карбид кальция. Выделившийся ацетилен поступает в бюретку. Сосуд несколько раз встряхивают до прекращения изменения объема газа в бюретке. Измеряют объем ацетилена, отмечая при этом температуру окружающего воздуха и атмосферное давление.
12
