
- •1. Транспорт лекарственных веществ системой крови и лимфы (макротранспорт) и через биологические мембраны (микротранспорт).
- •2. Метаболизм лекарственных веществ, его фазы, суть метаболических превращений в каждой фазе.
- •1) Метаболическая трансформация
- •2) Биосинтетические реакции
- •3. Биотрансформация как первая фаза метаболизма лекарственных веществ в организме. Ферменты первой фазы метаболизма.
- •1) Окислительно-восстановительные реакции
- •2)Гидролиз
- •4. Цитохром р-450, его свойства. Индукторы и ингибиторы цитохрома р-450
- •5. Конъюгация как вторая фаза метаболизма лекарственных веществ в
- •6. Механизм действия лекарственных веществ. Понятие мишени для лекарственных веществ. Роль мембранных белков и липидов в механизме действия лекарственных веществ.
- •8. Типы рецепторов плазматических мембран: рецепторы-ионные каналы, рецепторы, сопряженные с g-белками, рецепторы-протеинкиназы. Их участие в развитии ответа клетки на лекарственные вещества.
- •9. Вторичные мессенджеры. Образование и деградация. Их роль в развитии ответа клетки на лекарственные вещества.
- •10. Внутриклеточные рецепторы. Их участие в ответе клетки на лекарственные вещества.
- •11. Биохимия холинергического синапса. Биосинтез, депонирование и выброс ацетилхолина, регуляторы этих процессов.
- •12. Гидролиз ацетилхолина на холинэстеразе, его механизм. Ингибиторы холинэстеразы, их типы. Реактиваторы холинэстеразы.
- •13. Холинэстеразы, их типы, локализация. Строение и функционирование ацетилхолинэстеразы.
- •Строение
- •Механизм действия
- •16. Катехоламины, их представители, особенности химической структуры, их функции в организме.
- •17. Биохимия адренергического синапса. Депонирование, выделение и обратный захват норадреналина. Регуляторы этих стадий.
- •18. Биосинтез катехоламинов, их деградация. Регуляция этих процессов.
- •19. Адренорецепторы, их типы и распределение в организме. Механизмы трансмембранной передачи сигнала, опосредованные адренорецепторами.
- •1. Ионотропные гамк-рецепторы
- •23. Биохимия глицина, как тормозногонейромедиатора. Глициновые рецепторы. Транспортные системы для глицина и других аминокислот.
- •2)Глутатионовая система транспорта
- •25. Роль гистамина в биохимии аллергических реакций. Рецепторы гистамина, их типы, агонисты и антагонисты.
- •27. Биохимия рецепторов серотонина, типы и распределение серотониновых рецепторов в организме.
- •28. Эндогенные опиоиды, их виды. Биохимия опиоидных рецепторов, их типы и участие в формировании реакций на наркотические анальгетики. Агонисты и антагонисты опиоидных рецепторов.
- •31. Биосинтез и метаболизм простагландинов. Циклооксигеназа, ее разновидности и ингибиторы. Ингибиторы синтеза простагландинов, тромбоксансинтетазы, липоксигеназы.
- •32.Белково-пептидные гормоны. Биосинтез и секреция белково-пептидных гормонов. Их механизм действия на эффекторные клетки.
- •33. Биохимия гормонов гипоталамуса. Соматокринин, соматостатин, рилизинг-факторы тиреотропного, кортикотропного и гонадотропного гормонов. Их роль в функционировании организма.
- •1. Гормон роста, пролактин
- •2. Тиреотропин, лютеинизирующий гормон и фолликулостимулирующий гормон
- •3. Группа гормонов, образующихся из проопиомеланокортина
- •4. Гормоны задней доли гипофиза
- •35.Тиреокальцитонин и паратгормон. Биосинтез и его регуляция. Основные биохимические эффекты.
- •36. Гормоны поджелудочной железы. Глюкагон и инсулин. Их биологическая роль. Биохимический механизм действия инсулина. Рецепторы инсулина, их строение и функционирование.
- •Механизм действия инсулина
- •Активация инсулинового рецептора
- •2. Реакции, связанные с активностью ферментов map-киназ – в целом управляют активностью хроматина (медленные и очень медленные эффекты инсулина).
- •Два пути реализации эффектов инсулина Реакции, связанные с активностью фосфатидилинозитол-3-киназы
- •Действие фосфатидилинозитолдифосфат-3-киназы на фосфатидилинозитол-4,5-дифосфат Мишени и эффекты
- •Инактивация инсулина
- •Глутатион-инсулин-трансгидрогеназа, которая восстанавливает дисульфидные связи между цепями а и в, в результате чего гормон распадается.
- •Инсулиназа (инсулин-протеиназа), гидролизующая инсулин до аминокислот.
- •Патология Гипофункция
- •37. Биохимия углеводного обмена. Роль углеводов в образовании макроэргов и гликозилировании белков.
- •Регуляция синтеза и секреции
- •Механизм действия - цитозольный
- •Мишени и эффекты
- •Инактивация тиреоидных гормонов
- •42. Липиды, их биологическая роль и локализация в организме. Классификация липидов по химическому строению. Биосинтез холестерола, жирных кислот, триглицеридов: фармакологическая регуляция.
- •Биосинтез холестерола
- •4. Обрыв цепи.
- •44.Обмен фосфолипидов и их роль в рецепторных механизмах действия лекарственных веществ.
- •Реакции синтеза фосфолипидов с использованием фосфатидной кислоты
- •3 Путь – обратное превращение
- •45. Обмен жирных кислот и их роль в механизме действия лекарственных средств.
- •Синтез жирных кислот
- •Образование ацетил-sКоА из лимонной кислоты
- •Образование малонил-sКоА из ацетил-sКоА
- •Активные группы синтазы жирных кислот
- •Реакции синтеза жирных кислот Окисление жирных кислот (β-окисление)
- •Элементарная схема β-окисления
- •Этапы окисления жирных кислот
- •Реакция активации жирной кислоты
- •Карнитин-зависимый транспорт жирных кислот в митохондрию
- •Последовательность реакций β-окисления жирных кислот
- •46. Биохимия свертывающей системы крови: ферменты принимающие участие в коагуляции и фибринолизе, их фармакологическая регуляция.
- •1. Превращание фибриногена в фибрин-мономер.
- •47. Ферменты, принимающие участие в метаболизме эндогенных низкомолекулярных веществ и ксенобиотиков.
- •48. Повышение активности лекарственных веществ в результате реакции биотрансформации.
- •1)Повышение активности лекарственных веществ
- •2)Образование активного метаболита из неактивного вещества-пролекарства
- •49. Образование токсических продуктов лекарственных веществ в результате биотрансформации
- •50. Кофакторы и витамины, принимающие участие в метаболизме аминокислот и нейромедиаторов.
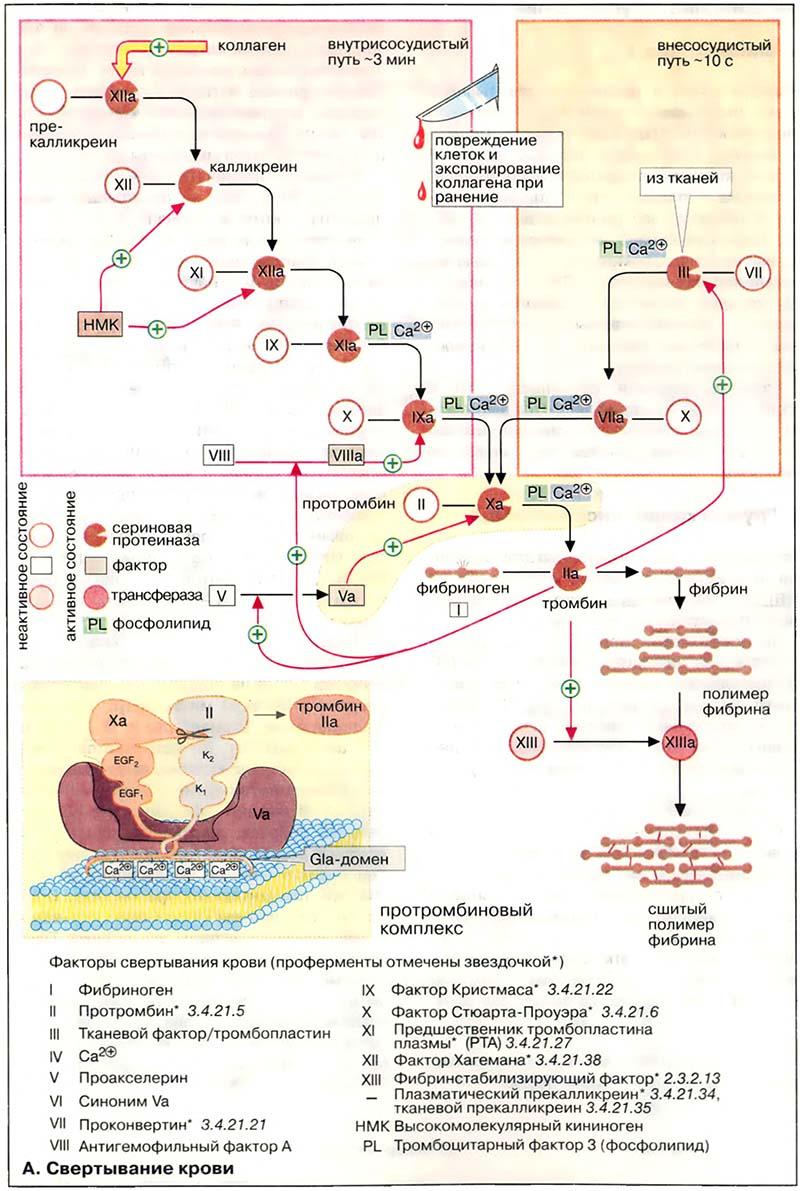
46. Биохимия свертывающей системы крови: ферменты принимающие участие в коагуляции и фибринолизе, их фармакологическая регуляция.
При свёртывании крови происходит ферментативное превращение растворимого белка плазмы фибриногена в фибриновый полимер, сеть волокон нерастворимого белка. В этой реакции принимает участие фермент тромбин (фактор IIа), который протеолитически отщепляет от молекулы фибриногена небольшой пептидный фрагмент, в результате чего освобождаются участки связывания, что позволяет молекуле фибрина агрегировать в полимер. Затем с помощью глутамин-трансферазы (фактора XIII) образуются изопептидные связи боковых цепей аминокислот фибрина, что приводит к формированию нерастворимого фибринового сгустка (тромба).
Свёртывание крови может запускаться двумя различными путями: вследствие нарушения целостности ткани (внесосудистый путь, на схеме справа) или процессами, которые начинаются на внутренней поверхности сосуда (внутрисосудистый путь, на схеме слева). В обоих случаях запускается каскад протеолитических реакций: из неактивных предшественников ферментов (зимогенов, условно обозначаемых на схеме окружностями) путём отщепления пептидов образуются активные сериновые протеиназы, которые в свою очередь действуют на другие белки. Оба реакционных пути нуждаются в ионах Ca2+ и фосфолипидах [ФЛ (PL)] и оба завершаются активацией фактором Xa протромбина (фактора II) с образованием тромбина (IIа).
Внутрисосудистый путь инициируется коллагеном, который в норме не экспонирован на внутренней поверхности кровеносных сосудов: его контакт с кровью приводит к активации фактора XII. Внесосудистый путь активации начинается с освобождения фактора III (тканевого тромбопластина) из повреждённых клеток ткани. В течение нескольких секунд этот фактор приводит к свёртыванию крови в области раны.
Факторы свёртывания II, VII, IX и X содержат необычную аминокислоту, γ-карбоксиглутаминовую (Gla). Остатки Gla, которые образуются в результате посттрансляционного карбоксилирования остатков глутаминовой кислоты, группируются в особых белковых доменах. Они присоединяют ионы Ca2+ и вследствие этого связывают соответствующие регуляторные факторы с фосфолипидами на поверхности плазматической мембраны. На рисунке это схематически представлено на примере протромбинового комплекса (Va, Xa и II). Вещества, способные связывать свободные ионы Ca2+ в виде комплекса, например цитрат, предотвращают это взаимодействие с фосфолипидами и тормозят свёртывание. Для синтеза остатков Gla необходим в качестве кофактора витамин K.
Генетически обусловленный дефицит отдельных факторов свёртывания приводит к кровоточивости (гемофилия).
В процессе формирования фибринового тромба можно выделить четыре этапа.
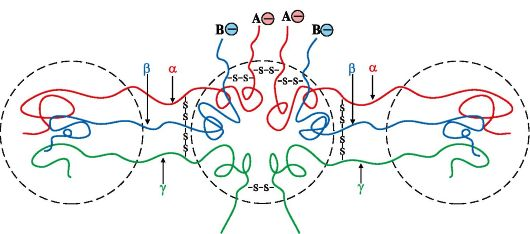
1. Превращание фибриногена в фибрин-мономер.
Молекула фибриногена состоит из шести полипептидных цепей трех типов - 2Аа, 2Вр, 2γ. Они связаны между собой дисульфидными связями и образуют три домена А- и В-участки находятся на N-концах цепей Аа и Вр соответственно Эти участки содержат много остатков дикарбоновых аминокислот и поэтому заряжены отрицательно, что препятствует агрегации молекул фибриногена (рис. ниже). Тромбин, который относится к группе сериновых протеаз, отщепляет А- и В-пептиды от фибриногена; в результате образуется фибрин-мономер.
2. Образование нерастворимого геля фибрина. В молекулах фибрина-мономера имеются участки, комплементарные к другим молекулам фибрина, - центры связывания, между которыми образуются нековалентные связи. Это приводит к полимеризации молекул фибрина и формированию нерастворимого геля фибрина (рис. ниже). Он непрочен, так как образован слабыми нековалентными связями.
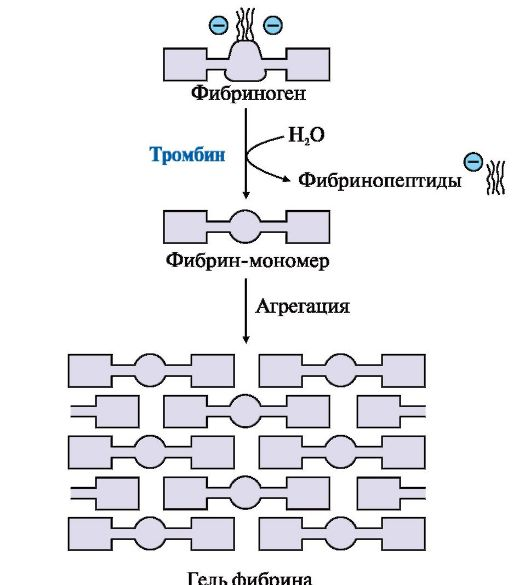
Фибриноген, освобождаясь под действием тромбина от отрицательно заряженных пептидов 2А и 2В, превращается в фибрин-мономер. Взаимодействие комплементарных участков в доменах молекул фибрина-мономера с другими такими же молекулами приводит к образованию геля фибрина
3. Стабилизация геля фибрина. Фермент трансглутамидаза (фактор XIIIa) образует амидные связи между радикалами аминокислот Глн и Лиз мономеров фибрина и между фибрином и гликопротеином межклеточного матрикса фибронектином.
4. Сжатие геля осуществляет сократительный белок тромбоцитов тромбостенин в присутствии АТФ.
Контроль за свёртыванием крови
Процесс свёртывания крови находится в постоянном равновесии между активацией и торможением. Для торможения в плазме имеются очень эффективные ингибиторы протеиназ. Сериновые протеиназы системы свёртывания инактивируются антитромбином. Его действие усиливается сульфатированным глюкозаминогликаном — гепарином. Тромбомодулин, расположенный на внутренней стенке кровеносных сосудов, инактивирует тромбин, образуя с ним стехиометрический комплекс. За протеолитическое разрушение факторов V и VIII в плазме отвечает белок c. Этот белок в свою очередь активируется тромбином и, тем самым, реализуется самотормозящийся механизм свёртывания крови.
Антагонисты витамина К, такие, как дикумарин, подавляют синтез активных факторов коагуляции и действуют поэтому также как ингибиторы свёртывания.
Вещества, способные связывать свободные ионы Ca2+ в виде комплекса, например цитрат, предотвращают это взаимодействие с фосфолипидами и тормозят свёртывание.
