
- •Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное
- ••Изотермы типа I отражают мономолекулярную адсорбцию
- •1. История создания БЭТ
- •2. Основные положения теории полимолекулярной адсорбции
- •Строение полимолекулярного слоя
- •3. Уравнение полимолекулярной адсорбции
- ••Процесс адсорбции можно представить в виде последовательных равновесных реакций:
- ••В 1937 г. Брунауэр С., Эммет П. и Теллер Е. вывели уравнение изотермы
- •Уравнение изотермы полимолекулярной адсорбции является основным уравнением обобщенной теории Лэнгмюра.
- •4. Применение:
- •Вывод:
- •Контрольные вопросы:
- •Спасибо за внимание!

Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное
учреждение высшего образования «Волгоградский государственный медицинский университет»
Кафедра химии
Теория полимолекулярной адсорбции (БЭТ)
Выполнила: студентка фармацевтического факультета 3 курса 1 группы Хворостова А.С.
Проверила: старший преподаватель Складановская Н.Н
г. Волгоград, 2020г
|
Содержание |
1 |
История |
2 |
Положения теории |
3 |
Уравнение полимолекулярной адсорбции |
4 |
Применение |
|
Выводы |
5 |
Контрольные вопросы |

•Изотермы типа I отражают мономолекулярную адсорбцию
•Изотермы типа II и III обычно связывают с образованием при адсорбции многих слоев, то есть, с полимолекулярной адсорбцией
•Изотермы типа IV и V отличаются тем, что для них характерна конечная адсорбция при приближении давления пара к давлению насыщения

1. История создания БЭТ
Для объяснения этого явления и описания S – образных изотерм адсорбции М.Поляни в 1915 году предложил «потенциальную теорию полимолекулярной адсорбции»
1.Адсорбция обусловлена физическими силами
2.На поверхности адсорбента нет активных центров, а молекулы удерживаются вблизи поверхности силовым полем
3.Адсорбционные силы действуют на значительном расстоянии, поэтому на поверхности адсорбента существует некоторый адсорбционный объем, по толщине больший, чем размер отдельной молекул
4.Действие адсорбционных сил по мере удаления от поверхности уменьшается и на некотором расстоянии практически становится равным нулю
•Теория Поляни не дала математического выражения изотермы адсорбции.
•Современная же форма уравнения полимолекулярной адсорбции (основного уравнения обобщенной теории Ленгмюра) была предложена лишь примерно двадцать лет спустя Брунауэром, Эмметом и Теллером.

2. Основные положения теории полимолекулярной адсорбции
•1. На поверхности адсорбента имеется определенное число равноценных в энергетическом отношении активных центров, способных удерживать молекулы адсорбтива.
•2. Каждая молекула первого слоя представляет собой возможный центр для адсорбции и образования второго адсорбционного слоя; каждая молекула второго слоя является возможным центром адсорбции в третьем и т. д.
•3. Для упрощения взаимодействием соседних адсорбированных молекул в первом и последующих слоях пренебрегают.
•4. Первый слой адсорбата образуется в результате действия сил Ван- дер-Ваальса между адсорбентом и адсорбатом, последующие в результате конденсации.
•5. Все молекулы во втором и более далеких слоях ведут себя подобно молекулам жидкости.
•6. Возможно построение последующих слоев при незаполненном первом.

Строение полимолекулярного слоя

3. Уравнение полимолекулярной адсорбции
Для вывода уравнения в теории БЭТ приняты следующие допущения:
1.Уравнение Лэнгмюра применимо не только к первому слою, но и к последующим слоям.
2.Поверхность адсорбента однородна (все активные центры одинаковой силы).
3.Теория не учитывает взаимодействие между адсорбированными молекулами адсорбата.

•Процесс адсорбции можно представить в виде последовательных равновесных реакций:
где В – адсорбат; – адсорбционный центр; – адсорбционный комплекс.
•Константы равновесия для этих реакций соответственно равны:
•Для выражения концентрации соответствующих комплексов можно
записать: |
ААВ = Кр Ао Р |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|||||
|
ААВ2 |
= К |
1 |
[АВ] Р = К |
1 |
К |
А Р2 |
||||
|
|
|
|
|
|
р |
о |
||||
|
ААВ3 |
= К |
2 |
[АВ ] Р = К |
1 |
К |
К |
А Р3 |
|||
|
|
|
|
2 |
|
|
2 |
|
р о |
||
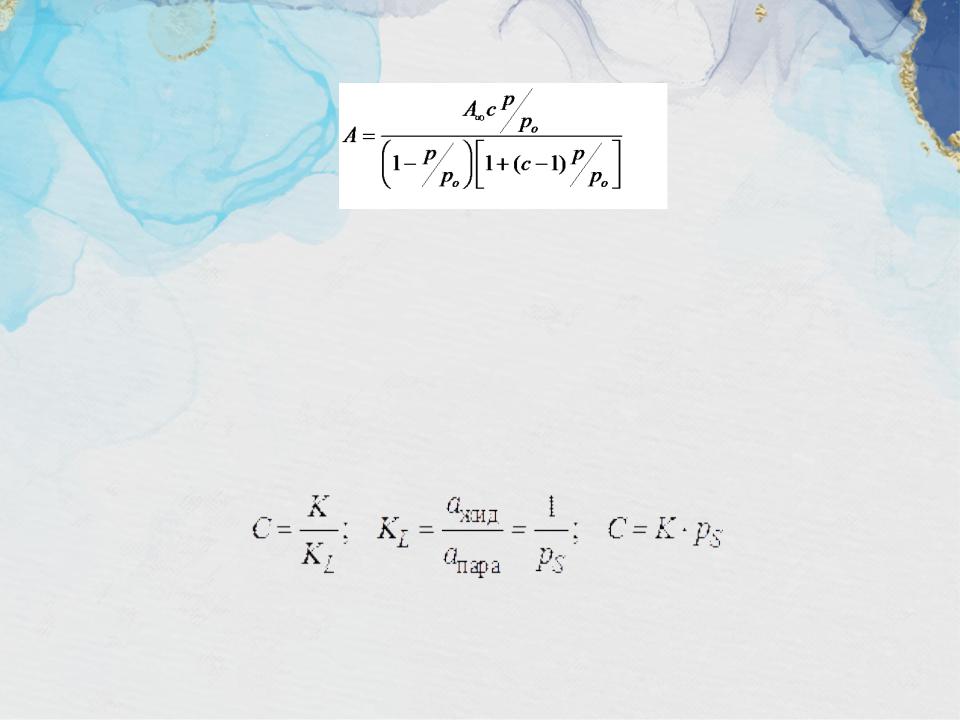
•В 1937 г. Брунауэр С., Эммет П. и Теллер Е. вывели уравнение изотермы адсорбции:
где А∞ - емкость одного адсорбционного слоя, зависящая от геометрии молекул и определяемая площадью, которую занимает одна молекула в насыщенном монослое (или число адсорбционных центров, приходящихся на единицу поверхности или массы адсорбента)
р/рs– относительное давление пара
(р – равновесное давление пара, рs – давление насыщенного пара)
С – константа, характеризующая энергию взаимодействия в адсорбционном слое
K1 = K2 = KL
где KL – константа конденсации пара
К – константа адсорбционного равновесия в уравнении Лэнгмюра
αжид, αпара – активность в-ва в жидком состоянии и в состоянии насыщенного пара соответственно

Уравнение изотермы полимолекулярной адсорбции является основным уравнением обобщенной теории Лэнгмюра.
При обработке экспериментальных результатов уравнение БЭТ используют в линейной форме
•Уравнение изотермы адсорбции БЭТ широко используется для определения величины удельной поверхности адсорбентов
•Изотерма адсорбции выражается прямой линией, отсекающей на оси ординат отрезок,
равный 1 / А∞ С , а тангенс угла ее наклона к оси абсцисс равен (С − 1) / А∞ С.
