
Семинар 4 Распределение Максвелла
.pdf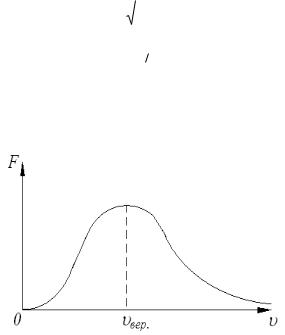
4. Распределение Максвелла
При статистическом методе описания равновесного состояния макроскопической системы одинаковых частиц основной характеристикой является функция распределения или плотность вероятности случайной величины. В случае теплового движения компоненты скоростиx , y , z частиц рассматриваются как независимые случайные величины,
изменяющиеся непрерывным образом от - до + . Если система из большого числа одинаковых частиц находится в тепловом равновесии с температурой Т, то справедлив закон распределения Максвелла. Согласно этому закону, распределение частиц по абсолютным значениям скорости
|
|
|
|
|
|
|
|
2 |
2 |
2 |
|||
|
||||||
|
|
|
x |
y |
z |
|
имеет вид
|
m 3 2 |
|
|
m 2 |
|
|
|
|
|
|
|
2 |
|
||||
F ( ) |
|
|
e |
|
2kT |
4 |
|
, |
|
|
|||||||
|
2kT |
|
|
|
|
|
|
|
где m – масса частицы и k=1,38 10-23Дж/К – постоянная Больцмана. График зависимости F( ) приведен на рисунке.
Максимум функции F( ) определяет наиболее вероятную скорость частиц. Функция распределения F( ) определяет вероятность dP( ) того, что произвольная частица имеет абсолютное значение скорости в интервале
, +d ,
dP( ) F( )d
и подчиняется условию нормировки
|
1 |
F ( )d dP 1 .
0 0
Задача №10 Определить наиболее вероятную среднюю и среднеквадратичную
скорости молекул хлора Cl2 при температуре Т=500К. Молярная масса хлора
71г .
Решение Наиболее вероятная скорость движения молекул идеального газа в
условиях равновесия находится с помощью уравнения
14

|
|
m |
3 2 |
|
|
|
|
|
|
|
m |
2 |
|
|
|
|
|
|
|
m |
3 2 |
|
|
|
|
|
|
m |
2 |
|
|
|
|
m |
2 |
||||
dF |
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
4 |
|
|
|
(e |
|
2kT |
|
|
) |
|
|
|
|
4 |
|
|
e |
|
2kT |
|
|
e |
|
2kT |
|||||||||
d |
|
|
d |
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
2kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2kT |
|
|
|
|
kT |
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m 3 2 |
|
|
|
m 2 |
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
4 e |
|
2kT ( |
|
|
|
|
|
2) 0 . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
2 kT |
|
|
|
|
|
|
|
|
|
|
kT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Отсюда находим два решения:
2
(10.1)
|
0, |
|
|
2kT |
|
. |
(10.2) |
2 |
|
||||||
1 |
|
|
m |
|
|||
|
|
|
|
|
|||
Скорость 1 определяет положение |
|
минимума функции |
F( ) и является |
||||
минимальной скоростью. Скорость 2 |
определяет положение |
максимума |
|||
функции F( ) и является наиболее вероятной скоростью движения молекул. |
|||||
Используя данные из условия задачи, находим |
|
||||
|
|
|
|
|
|
вер. 2 |
2kT |
|
346 м с . |
(10.3) |
|
|
|||||
|
|
m |
|
||
Здесь m  NA 1,1 10 25 кг - масса одной молекулы, Авогадро.
NA 1,1 10 25 кг - масса одной молекулы, Авогадро.
Средняя скорость движения молекул хлора
NA 6 1023 1 моль - число
|
|
|
|
|
|
|
|
|
|
|
|
m 3 2 |
|
|
m 2 |
|
|
|
|
|
|
m |
3 2 |
|
|
||||||||||||||
|
|
|
F ()d |
|
|
|
|
|
3 |
|
|
4 e |
|||||||||||||||||||||||||||
|
ср |
|
|
|
|
|
|
|
e |
|
2kT |
|
4 |
|
d |
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||
|
|
|
0 |
|
|
|
|
|
|
|
0 |
2 kT |
|
|
|
|
|
|
|
|
|
|
2 kT |
|
0 |
|
|
||||||||||||
|
|
|
m |
3 2 |
|
|
2kT |
2 |
|
|
|
2 |
|
|
|
|
|
|
1 2 |
|
1 |
|
2 |
|
|
|
|
2 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
e u u3du |
2kT |
|
|
|
u2e u |
|
|
|
ue u |
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
2kT |
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
|
|
2 |
|
|
|
|
|
|
|
||||||||
|
|
|
1 2 |
|
1 |
|
|
|
|
0 |
8kT |
|
1 2 |
|
|
|
|
|
|
|
|
|
|
|
|
0 |
0 |
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
2kT |
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
4 |
|
|
e u |
du2 |
|
|
|
|
|
|
390 м с . |
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
m |
|
|
2 |
|
0 |
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
m 2
2kT 3d
du
(10.4)
Среднеквадратичная скорость молекул хлора
|
|
|
|
1 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
3kT |
|
|
|
||
|
|
|
|
|
|
|
|
|
|||
ср.кв |
2 |
|
2 F ()d |
|
|
424 м с . |
(10.5) |
||||
m |
|||||||||||
|
|
|
0 |
|
|
|
|
|
|
||
При вычислении интеграла в (10.4) использовалось известное значение несобственного интеграла
|
|
|
|
|
|
|
|
||||
e u 2 du |
. |
||||
|
|||||
0 |
2 |
|
|
||
|
|
|
|
||
Интересно отметить, что все три вычисленные скорости теплового движения молекул хлора превышают скорость звука в воздухе 330м/с.
Ответ: вер 346м / с , ср 390м / с , ср.кв 424м / с .
Задача №11 Как зависит от давления Р средняя скорость ср частиц идеального газа
при адиабатном процессе?
Решение Задача решается с помощью уравнения адиабатного процесса
PV const , |
(11.1) |
15

где Р – давление, V – объѐм и – показатель адиабаты, формулы для средней скорости теплового движения частиц
ср |
|
|
8kT |
|
(11.2) |
|
|
||||||
m |
||||||
|
|
|
|
|
и уравнения состояния идеального газа – уравнения Клапейрона-Менделеева
|
|
|
|
PV RT , |
|
|
(11.3) |
||||
записанного для 1 моля газа. |
|
|
|
|
|
|
|
|
|
|
|
Из (11.1) и (11.3) следует, что |
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
T C P |
, |
|
|
(11.4) |
||||
|
|
|
|
|
1 |
|
|
|
|
||
где С1 – постоянная. Подставляя Т из (11.4) в (11.2), получим |
|
||||||||||
|
|
|
|
8kС2 |
|
|
1 |
|
1 |
|
|
|
|
|
|
|
|
p 2 |
C p 2 |
, |
(11.5) |
||
|
|
1 |
|
||||||||
ср |
|
|
|||||||||
|
|
|
m |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где С2 – постоянная.
1
Ответ: ср C2 p 2 , С2 – постоянная и – показатель адиабаты (для идеального
газа Ср  CV 5
CV 5 3).
3).
При достаточно большой температуре в тепловом движении многоатомной молекулы участвуют все еѐ степени свободы: поступательные, вращательные и колебательные. В случае теплового равновесия справедлив классический закон о равнораспределении средней кинетической энергии теплового движения по всем степеням свободы молекулы. При этом средняя кинетическая энергия теплового движения, приходящаяся на 1 степень свободы равна kT/2, где k – постоянная Больцмана и Т – температура системы:
 кин.х
кин.х 
 кин. у
кин. у 
 кин.z
кин.z  12 kT ,
12 kT ,
 кин.вр
кин.вр  12 kT ,
12 kT ,
 кин.кол.
кин.кол.  12 kT .
12 kT .
Полная средняя кинетическая энергия теплового движения многоатомной молекулы определяется формулой
 кин.
кин.  n 12 kT ,
n 12 kT ,
где n – полное число степеней свободы молекул, участвующих в тепловом движении при заданной температуре Т.
Задача №12 Определить среднеквадратичную угловую скорость ср.кв. вращения
молекул кислорода О2 относительно оси симметрии молекулы, если температура газа Т=300К и момент инерции относительно заданной оси
I=19,2 10-40г/см2.
16
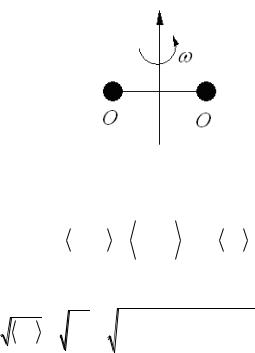
Решение Согласно классическому закону о равнораспределении средней
кинетической энергии по всем степеням свободы многоатомной молекулы
кин.вр |
|
1 |
I 2 |
|
1 |
I 2 |
|
1 |
kT . |
(12.1) |
|
2 |
2 |
2 |
|||||||||
|
|
|
|
|
|
|
|
Отсюда находим, что среднеквадратичная угловая скорость вращения молекулы кислорода
|
|
|
|
|
kT |
|
|
1,3810 23 300 |
|
|
1012 c 1 . |
|
|
|
2 |
|
|
|
|
4, 64 |
(12.2) |
||||
|
|
|
|
|||||||||
ср.кв |
|
|
|
|
I |
|
|
19, 2 10 40 10 3 10 4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Ответ: ср.кв 4,64 1012c 1 .
17
