
Семинар 3. Уравнение Ван-дер-Ваальса
.pdf
3. Уравнение Ван-дер-Ваальса
Для описания реальных газов необходимо учитывать конечные размеры частиц и их энергию взаимодействия. Если молей газа находятся в сосуде объѐмом V, то для свободного движения частиц доступна только область объемом V b . Здесь b – объем одного моля частиц при их плотной упаковке. На малых расстояниях частицы отталкиваются, а на больших – притягиваются. В результате частицы, находящиеся вблизи стенок сосуда испытывают действие сил притяжения со стороны остальных частиц. Соответственно концентрация частиц около стенок сосуда уменьшается, поскольку для подлета к стенке частица затрачивает часть своей кинетической энергии на совершение работы против указанной силы притяжения. Уменьшение концентрации частиц вблизи стенок приводит к уменьшению давления на величину 2a V 2 . Здесь а - постоянная для каждого газа, зависящая от взаимодействия частиц.
V 2 . Здесь а - постоянная для каждого газа, зависящая от взаимодействия частиц.
Таким образом, давление газа описывается выражением
P |
RT |
2 |
a |
, |
V b |
|
|||
|
V 2 |
|
||
где в правой части первое слагаемое обусловлено тепловым поступательным движением частиц, а второе слагаемое – взаимодействием между частицами, R 8,31 Дж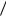 моль К – универсальная газовая постоянная. Величина
моль К – универсальная газовая постоянная. Величина
Pмол 2 a2
V
называется молекулярным внутренним давлением. Здесь предполагается, что введенные поправки на конечные размеры частиц и их взаимодействия относительно малы:
b |
1 |
, |
|
a |
1 . |
||
|
|
|
|||||
|
V |
|
|
|
|
RTV |
|
Уравнение состояния реального газа обычно записывается в |
|||||||
стандартной форме |
|
|
|
|
|
|
|
(P 2 |
|
a |
)(V b) RT |
||||
|
|
||||||
|
|
V 2 |
|
|
|||
и называется уравнением Ван-дер-Ваальса.
Задача №7
Оценить молекулярное давление Pмол в воде, если для воды постоянная
a 0,55 Hм4 моль2 , молярная масса |
1810 3 кг моль |
и плотность |
|
1г см3 103 кг м3 . |
|
|
|
Решение |
|
||
Согласно определению, молекулярное давление |
|
||
P 2 |
a |
, |
(7.1) |
|
|||
мол |
V 2 |
|
|
где - число молей вещества в объеме V.
11

Если взять единичный объем V1 1м3 , то число молей вещества в этом объеме
1
и молекулярное давление (7.1) запишется в виде
P |
2 |
a |
|
2 |
a 1, 7 109 |
Па , |
|
2 |
|||||
мол |
1 V2 |
|
|
|
||
|
|
1 |
|
|
|
|
что на 4 порядка больше атмосферного давления.
Ответ: Pмол 2 a 1, 7 109 Па .2
Задача №8 Считая, что в процессе испарения жидкости еѐ пары описываются
уравнением Ван-дер-Ваальса, а удельная теплота испарения q равна работе против сил молекулярного давления Pмол , выразить q через значения Pмол и
плотность жидкости ж .
Решение
Согласно принятой модели
V |
|
|
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
q П |
Pмол dV П 2 |
a |
dV 2a( |
1 |
|
|
1 |
|
) |
|
||||||||||
2 |
|
|
|
|
|
|||||||||||||||
VЖ |
|
|
|
VЖ |
V |
|
|
|
VЖ |
VП |
|
|
||||||||
2 |
a |
2 |
a |
|
V |
|
P |
V |
|
|
Pмол |
|
. |
(8.1) |
||||||
|
V 2 |
|
|
|
|
|
|
|||||||||||||
|
V |
|
|
|
|
|
Ж |
мол |
|
Ж |
|
|
|
|
|
|
||||
|
|
|
Ж |
|
Ж |
|
|
|
|
|
|
|
|
|
|
|
Ж |
|
|
|
Здесь VЖ и VП - удельный объем соответственно жидкости и пара и предполагается, что VП VЖ 1 Ж .
Если использовать результаты решения задачи №7,то удельная теплота парообразования для воды равна 1,7 106 Дж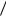 кг , что немного меньше табличного значения 2, 26 106 Дж
кг , что немного меньше табличного значения 2, 26 106 Дж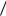 кг при атмосферном давлении.
кг при атмосферном давлении.
Ответ: q Pмол .
Ж
Задача №9
Выразить давление Pкр , температуру Tкр и объем Vкр одного моля
вещества в критической точке через постоянные a и b уравнения Ван-дер- Ваальса.
|
Решение |
Если температура газа T меньше критической температуры Tкр , |
|
изотерма P P(V ) , |
T const газа Ван-дер-Ваальса имеет 1 минимум и один |
максимум, как показано на рисунке. При критической температуре точка минимума сливается с точкой максимума, образуя точку перегиба
12

с координатами (Vкр , Pкр ). Здесь Vмол - объѐм, занимаемый частицами газа при
плотной упаковке.
Для решения задачи используется тот факт, что в точке перегиба
|
|
P |
|
|
|
2 P |
|
0 . |
(9.1) |
||||
|
|
|
|
||||||||||
|
|
V |
|
|
V 2 |
|
|||||||
|
|
|
V Vкр |
|
|
V Vкр |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||
Запишем уравнение Ван-дер-Ваальса для точки перегиба в виде |
|
||||||||||||
P V |
3 |
(RT |
bP )V 2 |
aV ab 0 . |
(9.2) |
||||||||
кр |
кр |
|
|
|
кр |
|
|
кр |
кр |
кр |
|
||
Продифференцируем полученное равенство дважды по Vкр с учѐтом (9.1): |
|||||||||||||
3P V 2 |
2(RT |
bP )V a 0 , |
(9.3) |
||||||||||
|
|
кр |
|
|
кр |
|
|
|
|
кр |
|
кр кр |
|
|
|
6Pкр Vкр 2(RTкр bPкр ) 0 . |
(9.4) |
||||||||||
Система уравнений (9.2) - (9.4) позволяет выразить Pкр , Vкр и Tкр |
через |
||||||||||||
постоянные a и b. Умножая уравнение (9.4) на Vкр2 |
и вычитая из полученного |
|||||
соотношения уравнение (9.3), получим |
|
|
|
|
||
3P V |
2 |
a . |
(9.5) |
|||
кр |
кр |
|
|
|
|
|
Из (9.2) и (9.4) с учѐтом (9.5) следует, что |
|
|||||
Vкр 3b . |
|
|
(9.6) |
|||
Подставляя Vкр из (9.6) в (9.5), находим |
|
|
|
|
||
Pкр |
|
|
a |
. |
(9.7) |
|
|
|
|||||
|
27b2 |
|||||
Из (9.4) с использованием (9.6) и (9.7) следует, что |
|
|||||
Tкр |
|
|
8a |
|
. |
(9.8) |
|
|
|
|
|||
|
|
|
|
|||
27Rb
Все три критические величины связаны между собой универсальным для всех веществ соотношением
Pкр Vкр 3 ,
RTкр 8
что не вполне соответствует действительности. Это обусловлено тем, что уравнение Ван-дер-Ваальса лишь приближѐнно описывает реальные газы.
Ответ: |
P |
a |
, V |
3b , T |
|
8a |
. |
27b2 |
|
||||||
|
кр |
кр |
кр |
|
27Rb |
||
13
