
4219
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение
высшего образования «Воронежский государственный лесотехнический университет
имени Г.Ф. Морозова»
БИОТЕХНОЛОГИЯ
Методические указания по организации и прохождению учебной практики для студентов по направлению подготовки
35.04.10 – Ландшафтная архитектура
Воронеж 2015
2
УДК 630*
Сиволапов, А. И. Биотехнология [Текст] : методические указания по организации и прохождению учебной практики для студентов по направлению подготовки 35.04.10 – Ландшафтная архитектура / А. И. Сиволапов, И. Ю. Исаков, В. А. Сиволапов ; М-во образования и науки РФ, ФГБОУ ВО «ВГЛТУ». – Воронеж, 2015. – 31 с.
Печатается по решению учебно-методического совета ФГБОУ ВПО «ВГЛТА» (протокол № 3 от 14 ноября 2014 г.)
Рецензент канд. биол. наук, заведующий лабораторией лесной биотехнологии ВНИИЛГИСбиотех О.С. Машкина
Методические указания могут быть использованы при обучении слушателей по соответствующим программам дополнительного профессионального образования.
3
ОГЛАВЛЕНИЕ
Введение…………………………………………………………………….. 4
1.Микроклональное размножение растений с использованием
биотехнологии in vitro …………………………………………….. 4
1.1.Инструменты и оборудование для подготовки эксплантов
растений …………………………………………………………… 5
1.2.Оборудование для приготовления питательных сред для
микрочеренкования ……………………………………………… 6
1.3.Оборудование для получения и выращивания регенерантов
древесных растений ……………………………………………….. |
9 |
Заключение ………………………………………………………… |
12 |
2.Методы стерилизации при проведении работ с культурой тканей березы, ольхи и тополя ……………………………………. 12
2.1. Стерилизация посуды, ламинар-бокса и питательных сред ……. |
13 |
2.2.Поверхностная стерилизация растительного материала
(эксплантов) ………………………………………………………. 13
2.3. |
Регламент стерилизации эксплантов сортов тополя |
15 |
2.4. |
Питательные среды для микроклонального размножения ……... |
18 |
3.Методика видовой идентификации ДНК с помощью молекуляр-
|
но-генетических методов анализа ………………………………... |
20 |
3.1. Сбор образцов для ДНК-анализа ………………………………… |
20 |
|
3.2. |
Протокол выделения ДНК ………………………………………… |
20 |
3.3. |
Спектрофотометрическое измерение концентрации ДНК ……... |
20 |
3.4.Протокол постановки ПЦР ……………………………………….. 21
3.5. Протокол постановки электофореза в агарозном геле ………….. 21
3.6.Протокол выделения и очистки ампликона из агарозного геля
(на примере наборов Eurugen Cleanup Mini) …………………….. |
22 |
3.7. Протокол постановки секвенирующей ПЦР …………………….. |
22 |
3.8.Протокол очистки продуктов секвенирующей ПЦР набором
BigDye® XTerminator Purification Kit ……………………………. 23
3.9.Протокол определения структуры ДНК на генетическом
|
анализаторе ABI PRISM 310 ……………………………………… |
23 |
3.10. |
Протокол анализа результатов секвенирования ………….……... |
24 |
4. |
Биотехнология in vitro в лесокультурной практике …………….. |
25 |
4.1.Технологическая схема производства посадочного материала ценных генотипов тополя, березы и ольхи методом in vitro для создания плантационных культур ………………………………... 25
Библиографический список ………………………………………. |
27 |
Приложение 1 ……………………………………………………… |
28 |
Приложение 2 ……………………………………………………… |
29 |
4
ВВЕДЕНИЕ
Биотехнология – наука о методах и технологиях создания и использования генетически трансформированных биологических объектов (растений, животных и микроорганизмов) для интенсификации производства или создания новых продуктов различного назначения.
Учебная практика по биотехнологии для студентов по направлению подготовки 35.04.10 – Ландшафтная архитектура предусматривает знакомство и приобретение практических навыков по трем разделам дисциплины:
-микроклональное размножение растений с использованием биотехнологии in vitro;
-применение метода ДНК-анализа для генетической паспортизации сортов растений;
-биотехнология in vitro в лесокультурной практике.
Поэтапные вопросы биотехнологии in vitro рассматриваются на базе лаборатории биотехнологии ВНИИЛГИСбиотех.
Применение ДНК-анализа рассматривают на базе отдела генетики Центра защиты леса.
Практическое внедрение биотехнологии in vitro в лесокультурной практике рассматривается на базе Учебно-опытного лесхоза ВГЛТУ.
Биотехнологический процесс включает следующие компоненты: биологический агент, субстрат, целевой продукт, аппаратуру и совокупность управляющих ими методов. Регенерация – восстановление целого организма из его части. Наиболее сложной является регенерация растений из отдельных клеток. Особенно трудно этот процесс происходит у древесных растений.
1. Микроклональное размножение растений с использованием биотехнологии in vitro
Суть предлагаемой технологии, предназначенной для массового тиражирования хозяйственно ценных сортов тополей, березы и выращивания качественного стандартного посадочного материала для создания плантационных культур, заключается в следующем. Регенерация растений осуществляется на основе пролиферации пазушных меристем (прямой выгонки пазушных побегов), их укоренения и мультипликации полученных микрорастений, т.е. с помощью модели размножения, исключающей этап каллусообразования. При этом в качестве эксплантов используются узловые сегменты активно растущих летних неодревесневших (а не зимних одревесневших) побегов, применение гормональных питательных сред ограничивается всего одним сроком культивирования (один месяц) первичных эксплантов взрослых деревьев, а на этапе укоренения микропобегов, их доращивания и мультипликации используются одни и те
5
же безгормональные среды. Предлагаемая схема адаптации и доращивания регенерантов тополя в условиях открытого грунта позволяет получать качественный однородный (стандартный) двухлетний посадочный материал для создания специализированных плантаций.
Преимущества настоящей технологии по сравнению с имеющимися разработками заключаются в следующем:
1.В существенном повышении эффективности клонального микроразмножения трудночеренкуемых ценных генотипов тополя за счет использования в качестве эксплантов активно растущих неодревесневших летних побегов, изолированных в июне месяце (а не наиболее часто используемых эксплантов зимних побегов), что является одним из ключевых моментов методики.
2.Оптимизация условий стерилизации первичных эксплантов (поэтапная стерилизация, обеспечивающая получение до 90 % асептических жизнеспособных культур), а также инициации развития основного побега (с эффективностью до 77 %), что вполне достаточно для последующих этапов клонального микроразмножения.
3.В упрощении и удешевлении технологии за счет оптимизации питательных сред, использовании одних и тех же безгормональных питательных сред для мультипликации, спонтанного укоренения и доращивания микропобегов, дающих одинаково высокий результат для хозяйственно ценных трудночеренкуемых генотипов тополя.
4.Уменьшение возможности возникновения сомаклональной изменчивости и сохранение генетической ценности исходного материала, обеспечение внутриклоновой однородности (стандартности) посадочного материала.
1.1. Инструменты и оборудование для подготовки эксплантов растений
Инструменты (анатомические пинцеты, скальпели, шпатели, ножницы, секатор, лезвия) для манипуляций по эксплантированию, пересадке и микрочеренкованию материала в ламинарных боксах;
-Колбы и стаканы из термостойкого стекла на 0,25; 0,5; 0,8 и 1 л; мерные цилиндры на 25, 50 мл, 1 и 2 л, мерные пипетки на 1, 2, 5 и 10 мл для приготовления питательных сред, стерилизации воды и растительного материала. Склянки с притертыми пробками для хранения маточных растворов (50, 100 мл, 1 л);
-Стеклянные или пластиковые сосуды (биологические пробирки, банки, контейнеры и колбы емкостью до 250 мл) для выращивания культур, чашки Петри.
Подготовка эксплантов заключается в нарезке черенков с ростовых побегов. Для этого используют секатор, лезвия; черенки хранят в полиэтиленовых мешках в холодильнике.
6
Подготовку лабораторной посуды к работе проводят в моечной комнате. Она оборудуется мойкой с горячей и холодной водой, дистиллятором, сушильными шкафами, лабораторными столами, шкафами для хранения посуды. Посуду моют, используя бытовые моющие средства, тщательно промывают водопроводной водой, ополаскивают дистиллированной водой, сушат. Перед стерилизацией горлышки культуральных сосудов сушат, закрывают фольгой, чашки Петри заворачивают в плотную бумагу или помещают в бюксы. Пинцеты, скальпели, ножницы и др. инструменты стерилизуют в ламинар-боксе, обжигая в пламени спиртовки непосредственно перед использованием.
Встерилизационной комнате проводится стерилизация посуды, инструментов и питательных сред. В ней размещаются сушильные шкафы и автоклавы. Приготовленную посуду стерилизуют сухим жаром в сушильном шкафу при tº = 160 ºC не менее двух часов или паром в автоклаве 1 час при давлении 1 атм
Воперационной комнате устанавливается ламинар-бокс. Она должна быть изолирована от сквозняков и других источников заражения воздуха микроорганизмами или их спорами. Здесь осуществляют поверхностную стерилизацию и изоляцию растительной ткани, вводят ее в культуру, проводят пересадку (субкультивирование). Комната оборудуется лампами ультрафиолетового облучения (УФ); перед работой обязательно проводится влажная уборка с использованием дезинфицирующих средств. В самом ламинар-боксе стерильность поддерживается за счет постоянной подачи воздуха через специальные фильтры, обеспечивающие его механическую и бактерицидную очистку (продувку), обязательной ультрафиолетовой обработки перед работой с последующей 30-минутной продувкой, тщательной обработки внутренних поверхностей ламинар-бокса этиловым спиртом.
1.2. Оборудование для приготовления питательных сред для микрочеренкования
Для приготовления питательных сред используют чистую посуду, стерильную одежду, рабочую поверхность столов в асептических комнатах и инструменты перед работой дополнительно стерилизуют спиртом. Используют колбы и стаканы из термостойкого стекла на 0,25; 0,5; 0,8 и 1 л; мерные цилиндры на 25, 50 мл, 1 и 2 л, мерные пипетки на 1, 2, 5 и 10 мл для приготовления питательных сред, стерилизации воды и растительного материала; склянки с притертыми пробками для хранения маточных растворов (50, 100 мл, 1 л); алюминиевую фольгу для колпачков на культуральные сосуды; вату для работы в боксе; этиловый спирт для спиртовки и других стерилизационных работ в боксе; электроплитки.
Лабораторную посуду стерилизуют в паровом стерилизаторе. Стерилизатор паровой ВК-30-01 предназначен для стерилизации
паром под давлением лабораторной посуды (стеклянные или пластиковые
7
сосуды, биологические пробирки, банки, контейнеры и колбы емкостью до 250 мл для выращивания культур, чашки Петри), салфеток; инструментов (анатомические пинцеты, скальпели, шпатели, ножницы), перчаток и других предметов, воздействие пара на которые не вызывает изменения их функциональных свойств.
Стерилизатор предназначен для эксплуатации в помещении при температуре окружающего воздуха от + 10 до + 35 ºС и максимальном значении относительной влажности 80 % при 25 ºС (рис. 1).
При эксплуатации стерилизатора необходимо соблюдать «Методические указания по дезинфекции, предстерилизационной очистке и стерилизации изделий медицинского назначения» (МУ-287-113-98), «Правил технической эксплуатации электроустановок потребителем», «Правил техники безопасности при эксплуатации электроустановок потребителем».
Во всех технологических этапах работы применяется дистиллированная вода, для её получения используется аквадистиллятор.
Стерилизатор является сосудом, работающим под давлением. Во избежание аварии при работе с ним необходимо соблюдать все требования настоящего руководства, требований «Правил устройства и безопасной эксплуатации сосудов, работающих под давлением» ПБ 03-576-03, действующих «Правил эксплуатации и требования безопасности при работе на паровых стерилизаторах», «Правил технической эксплуатации электроустановок потребителей»
Аквадистиллятор электрический АЭ-10 МО предназначен для производства очищенной воды в биотехнологической лаборатории.
Условия эксплуатации:
-температура окружающего воздуха от +10 до +35º; - относительная влажность 80 % при температуре +25 ºС.
Качество исходной воды, поступающей в аквадистиллятор, должно соответствовать требованиям ГОСТ 2874-82, СанПин. 1.4.1074-01 при содержании в ней аммиака не более 0,2 мг/л, или исходная вода должна быть предварительно очищена от солей жесткости, углекислоты, аммиака, восстанавливающих веществ или других примесей, характерных для региональных источников питьевой воды и влияющих на качество производимой воды, до соответствия ее указанным выше стандарту и требованию по содержанию аммиака.
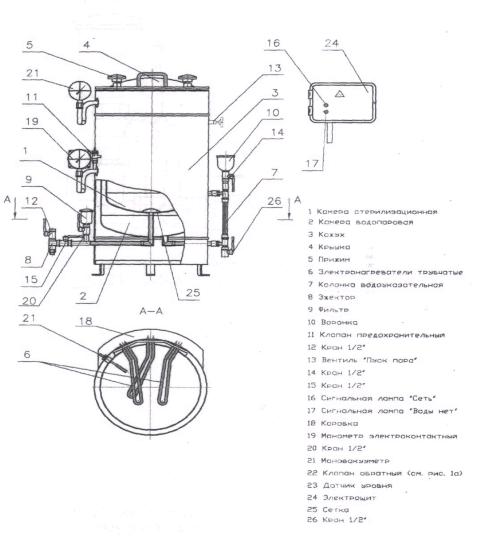
8
Рис. 1. Стерилизатор паровой ВК-30-01
Аквадистиллятор предназначен для производства пара из исходной воды путем нагрева с дальнейшей конденсацией пара и получением очищенной воды с температурой в пределах от 70 до 85 ºС.
Аквадистиллятор представляет собой цилиндр, состоящий из трех частей: камеры конденсации – 1, камеры испарения – 2 и электроблока 3 (рис. 2).
Для обеспечения безопасной работы на аквадистилляторе необходимо соблюдать «Правила технической эксплуатации электроустановок потребителей» и «Правила техники безопасности при эксплуатации электроустановок потребителей».
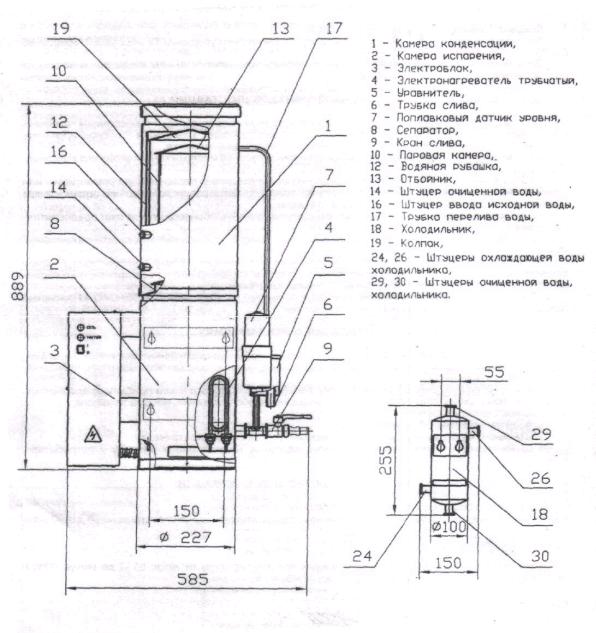
9
Рис. 2. Аквадистиллятор электрический АЭ-10МО
1.3. Оборудование для получения и выращивания регенерантов древесных растений
Все работы с асептическими культурами проводятся в ламинарных боксах с бактерицидным облучением (рис. 3).

10
Рис. 3. Ламинарный бокс для микроклонального черенкования
Выращивание регенерантов проводится в специальных климаткамерах, на стеллажах при постоянном освещении (рис. 4). Она оборудуется стеллажами, на которых размещаются культуральные сосуды с изолированными культурами, в ней поддерживается искусственный микроклимат: постоянная температура (25 – 26 ºС), регулируется освещенность (в пределах от 1000 до 4000 люкс), 60 – 70 %-ная относительная влажность воздуха.
