
4140
.pdf
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ
«ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ ЛЕСОТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ Г.Ф. МОРОЗОВА»
ХИМИЯ
Окислительно-восстановительные реакции
Методические указания для самостоятельной работы студентов по всем направлениям подготовки
Воронеж 2016
2
УДК 54
Химия. Окислительно-восстановительные реакции [Текст] : методические указания для самостоятельной работы студентов по всем направлениям подготовки / Л. И. Бельчинская, О. А. Ткачева, А. И. Дмитренков, Л. А. Новикова ; М-во образования и науки РФ, ФГБОУ ВО «ВГЛТУ». – Воронеж, 2016. – 24 с.
Печатается по решению учебно-методического совета ФГБОУ ВО «ВГЛТУ» (протокол № 6 от 03 июня 2016 г.)
Рецензент канд. хим. наук, доц. кафедры общей и неорганической химии ФГБОУ ВО «ВГУИТ» Ю.С. Перегудов
3 |
|
ОГЛАВЛЕНИЕ |
|
Введение……………………………….………………………………………. |
4 |
Основные понятия и определения…………………………………………… |
4 |
Правила определения степеней окисления………………………………….. |
5 |
Окислители и восстановители……………………………………………….. |
6 |
Виды окислительно-восстановительных реакций………………………….. |
8 |
Составление уравнений ОВР………………………………………………… |
8 |
Метод электронного баланса………………………………………………… |
9 |
Метод полуреакций (электронно-ионный метод)…………………………... |
13 |
Направление протекания ОВР в зависимости от различных факторов…… |
17 |
Взаимодействие металлов с кислотами……………………………………... |
18 |
Взаимодействие неметаллов с кислотами…………………………………... |
20 |
Типичные реакции окисления-восстановления…………………………….. |
21 |
Библиографический список ……………….………………………………… |
23 |
4
Введение. Основные понятия и определения
Окислительно-восстановительные реакции играют огромную роль в природе и технике. Без этих реакций невозможна жизнь, потому что дыхание, обмен веществ, горение, синтез растениями клетчатки из углекислого газа и воды
–все это окислительно-восстановительные процессы.
Спомощью реакций этого типа получают такие важные вещества как аммиак (NH3), серную (H2SO4) и соляную (HCl) кислоты и многие другие продукты. Вся металлургия основана на восстановлении металлов из их соединений – руд. Коррозия металлов, многие методы защиты металлов от коррозии – также окислительно-восстановительные процессы. Большинство химических реакций
–окислительно-восстановительные.
Приведем важнейшие определения, связанные с окислительновосстановительными реакциями.
Окислительно-восстановительными реакциями (ОВР) называются ре-
акции, протекающие с изменением степени окисления элементов, входящих в реагенты и продукты. Например, Н20 + Cl20 → 2H+1Cl-1.
Окисление и восстановление – это встречно-параллельные химические реакции, то есть окисление всегда сопровождается восстановлением и, наоборот, восстановление всегда связано с окислением.
Окисление – это процесс отдачи электронов. Восстановление – процесс присоединения электронов.
Окислителями называются вещества, присоединяющие электроны. Во время реакции они восстанавливаются. При этом их степень окисления уменьшается.
Восстановителями называются вещества, отдающие электроны. Во время реакции они окисляются. Их степень окисления повышается.
ПРИМЕР 1:
Окислительно-восстановительная реакция между водородом и фтором
Н20 + F20 → 2H+1F-1
разделяется на две полуреакции:
1)окисление: Н20 – 2ē → 2H+1. (восстановитель Н2);
2)восстановление: F20 + 2ē → 2F-1 (окислитель F2).
5
Степень окисления – это условный заряд атома, вычисленный исходя из предположения, что все связи в соединении ионные (то есть электронные пары полностью смещены в сторону атомов с большей электроотрицательностью).
Степень окисления может быть положительной, отрицательной, нулевой и даже дробной.
Правила определения степеней окисления
Значения некоторых степеней окисления следует запомнить. Это нетрудно сделать, если вспомнить, что в периодической системе (ПС) элементов номер группы показывает число электронов на наружном электронном слое атома, а также максимальную положительную степень окисления. Минимальную отрицательную степень окисления можно рассчитать, отняв от восьми номер группы (восемь – число электронов на полностью завершенном электронном слое). Постоянные степени окисления некоторых элементов приведены в табл. 1.
Таблица 1
№ |
|
|
|
|
групп- |
|
Постоянные |
|
Исключения |
пы |
|
|
||
|
степени окисления |
|
|
|
в ПС |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
+1 |
Н, Li, Na, K, Rb, Cs, Fr |
–1 |
NaH ; CaH2 : |
|
|
водород, щелочные металлы |
|
Н+1 в гидридах металлов |
2 |
+2 |
Ca, Sr, Ba, Ra, Mg, Zn |
|
|
|
|
щелочно-земельные металлы, |
|
|
|
|
магний, цинк |
|
|
|
|
|
|
|
3 |
+3 |
Al |
|
|
|
|
|
|
|
6 |
–2 |
O |
–1 |
Н2О2 : О–1 в пероксидах |
|
|
|
+2 |
ОF2 : О+2 во фториде кислорода |
7 |
–1 |
F |
|
|
|
|
|
|
|
Впростом веществе элемент имеет нулевую степень окисления (Na0, S0, Cl20, O20).
Сумма всех степеней окисления в сложном веществе равна нулю.
Вионе сумма степеней окисления элементов равна заряду иона.
6
Для того чтобы определить степень окисления элемента, выполняют следующую последовательность действий:
а) записывают значения известных степеней окисления; б) значение неизвестной степени окисления обозначают через х;
в) составляют уравнение равенства электрических зарядов, решая его, находят значение х.
ПРИМЕР 2:
Рассчитать степень окисления азота в веществах:
а) NH3 ; |
NxH3+1 |
: x + 3(+1) = 0; |
x = –3. |
Ответ: N–3. |
||
Б) NO2 ; |
NxO2-2 |
: x + 2(–2) = 0; |
x = +4. |
Ответ: N+4. |
||
В) N2O5 ; |
N2xO5-2 : 2x |
+ 5(–2) = 0; |
x = +5. Ответ: N+5. |
|||
Г) КNO2 ; |
К+1NxO2-2 : |
+1 + x + 2(–2) |
= 0; |
x = +3. Ответ: N+3. |
||
Д) N2O ; |
N2хO–2 : 2х + (–2) = 0; х = |
+1. |
Ответ: N+1. |
|||
Задания для самостоятельного решения Определите степени окисления всех элементов в следующих веществах:
1) |
H2SO4 |
; |
4) |
KmnO4 ; |
7) HclO3 ; |
2) |
H2SO3 |
; |
5) |
MnO2 ; |
8) Na3PO4 ; |
3) |
H2S ; |
|
6) K2Cr2O7 ; |
9) C2H6 . |
|
Окислители и восстановители
Чтобы произошла окислительно-восстановительная реакция, необходимо присутствие атомов, молекул или ионов, взаимно противоположных по своей способности отдавать или присоединять электроны.
В п е р и о д а х периодической системы элементов Д.И. Менделеева с повышением порядкового номера элемента восстановительные свойства простых веществ ослабевают, а окислительные усиливаются, и становятся максимальными у галогенов. Объясняется это строением атомов элементов.
Так, в III периоде натрий – самый активный восстановитель. На внешнем энергетическом уровне атома Na находится всего один электрон. Отдав его, атом натрия превращается в катион: Na0 – 1ē → Na+1.
Атом хлора содержит на внешнем уровне 7 ē. Принимая недостающий до завершения уровня 1 ē, атом хлора превращается в анион: Cl0 + 1ē → Cl–1.

7
Если рассматривать изменение окислительных и восстановительных свойств сверху вниз по г л а в н ы м п о д г р у п п а м периодической системы элементов Д.И. Менделеева, то наблюдается такая закономерность: с повышением порядкового номера элемента возрастают восстановительные свойства его атомов, а окислительные – убывают. Причина этого заключается в том, что сверху вниз возрастает число энергетических уровней, радиус атомов становится больше и, следовательно, слабее удерживаются внешние электроны.
Важнейшие окислители и восстановители приведены в табл. 2.
|
Таблица 2 |
|
|
Окислители |
Восстановители |
|
|
Простые вещества – неметаллы (кисло- |
Простые вещества – металлы, Н2, С. |
род, галогены и др.). |
|
|
|
Соединения, содержащие элемент в мак- |
Соединения, содержащие элемент в ми- |
симальной степени окисления (K2Cr2O7, |
нимальной степени окисления (K2S, H2S, |
K2CrO4, HNO3, KmnO4, H2SO4) |
CH4, HN3, HCl, KI) |
|
|
Соединения, содержащие элемент в про- |
Соединения, содержащие элемент в про- |
межуточной степени окисления (NaNO2, |
межуточной степени окисления (SO2, |
Ag2O, MnO2, H2O2 , «царская водка») |
СО, Na2SO3, HNO2, альдегиды, спирты) |
|
|
Электроток на аноде при электролизе |
Электроток на катоде при электролизе |
|
|
Многие элементы могут выполнять роль окислителей и восстановителей, в зависимости от того, в какой степени окисления они находятся.
ПРИМЕР 3:
S–2 |
S0 |
|
S+4 |
S+6 |
Н2S–2 |
S0 |
|
Н2S+4О3 |
Н2S+6О4 |
Минимальная |
Промежуточные |
Максимальная |
||
степень окисления |
степени окисления |
степень окисления |
||
Безусловный |
Могут выполнять роль |
Безусловный |
||
восстановитель |
как окислителя, так и восстановителя |
окислитель |
||
|
|
|
|
|
Только отдает |
S0 + О20 → S+4º2 |
(S0 – восстановитель) |
Только принимает |
|
электроны |
S0 + Fe0 → FeS–2 (S0 – окислитель) |
электроны |
||
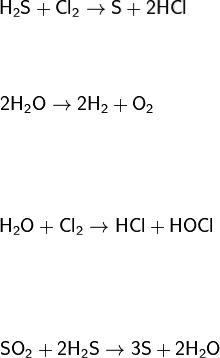
8
Задания для самостоятельного решения Определите, какую роль (окислителя или восстановителя) могут выпол-
нять следующие вещества в ОВР: |
|
||
1) |
HNO3 ; |
4) KmnO4 ; |
7) HclO4 ; |
2) |
Na2SO3 ; |
5) MnO2 ; |
8) Na3PO4 ; |
3) |
Cl2 ; |
6) K2Cr2O7 ; |
9) CH4 . |
Виды окислительно-восстановительных реакций
Межмолекулярные – реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Внутримолекулярные – реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
Диспропорционирование (самоокисление-самовосстановление) – реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Репропорционирование (конпропорционирование) – реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления:
Составление уравнений ОВР
Для нахождения пропорции веществ, вступающих в химическую реакцию, часто требуется уравнять ОВР. Уравнивание ОВР сводится к нахождению стехиометрических коэффициентов (то есть, количества молей каждого соединения). Стехиометрические коэффициенты могут принимать только значения целых величин от 1 и выше, дробные стехиометрические коэффициенты допускаются лишь в некоторых случаях записи термохимических уравнений.
Применяют два методы уравнивания ОВР: метод электронного баланса и метод полуреакций.
9
Метод электронного баланса
Этот метод более прост и используется в случае протекания реакции в газообразной среде (например, процессы горения или термического разложения соединений).
Число электронов, отдаваемых восстановителем, должно равняться числу электронов, присоединяемых окислителем.
Метод электронного баланса основан на сравнении степеней окисления атомов в исходных и конечных веществах.
Для правильного уравнивания следует придерживаться определенной последовательности действий:
1.Определить степени окисления всех элементов в исходных и конечных веществах.
2.Найти элементы, которые изменяют степень окисления (окислитель и восстановитель).
3.Составить для них схемы переходов электронов (электронные уравнения).
4.Уравнять число отданных и принятых электронов.
5.Расставить коэффициенты в уравнении ОВР перед формулами окислителя и восстановителя.
6.Расставить остальные коэффициенты, уравнивая вначале атомы металлов, затем неметаллов, последними уравнять атомы водорода и кислорода.
ПРИМЕР 4:
Уравнять окислительно-восстановительную реакцию:
Al + HCl → AlCl3 + H2.
Решение. Определяем степени окисления всех элементов в исходных и конечных веществах и находим элементы, которые изменяют степень окисления (эти элементы подчеркнуты)
Al0 + H+1Cl-1 → Al+3Cl-13 + H02
10
Записываем уравнения процессов окисления и восстановления. Обязательно учитываем количество атомов, участвующих в процессах:
Al0 3 ē → Al+3
2H+1 + 2 ē → H02
Уравниваем число отданных и принятых электронов (наименьшее общее кратное для трех отданных и двух принятых электронов равно 6).
Определяем коэффициенты при окислителе и восстановителе, то есть первую строку умножаем на 2, вторую на 3:
Al0 3 ē → Al+3 |
| |
| |
2 – процесс окисления, Al0 – восстановитель, |
|
| |
6 | |
|
2H+1 + 2 ē → H02 |
| |
| 3 – процесс восстановления, 2H+1 – окислитель. |
|
2 Al0 +6 H+1 → 2 Al+3 + 3 H02
Переносим полученные коэффициенты в молекулярное уравнение:
3 Al + 6 HCl → 2 AlCl3 + 3 H2
Подсчитываем число атомов каждого элемента в левой и правой частях уравнения (т.е. проверяем соблюдение закона сохранения массы):
В левой части |
|
В правой части |
||
2 |
атома Al |
= |
2 |
атома Al |
6 |
атомов Н |
= |
6 |
атомов Н |
6 |
атомов Сl |
= |
6 атомов Cl |
|
Вывод: реакция уравнена
. ПРИМЕР 5:
Уравнять окислительно-восстановительную реакцию:
H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2 O.
Решение. Определяем степени окисления всех элементов в исходных и конечных веществах и находим элементы, которые изменяют степень окисления
H+12 S-2 + K+1Mn+7О-24 + H+12S+6О-24 → S0 + Mn+2S+6О-24 + K+12S+6 О-24 + H+12О-2
